La función de la vitamina D en el manejo de la Osteoporosis: Consenso Latinoamericano
Gilberto González V.1 (Presidente), Marina Arriagada2, Raúl Jervis3, para el grupo de trabajo*
The role of vitamin D in the management of osteoporosis: Latin American Consensus
1Departamento de Endocrinología, Facultad de Medicina, Pontificia Universidad Católica de Chile, Santiago, Chile.
2Clínica de Reumatología y Rehabilitación, Fundación Chilena de Osteoporosis, Santiago, Chile.
3Hospital Metropolitano, Quito, Universidad Central del Ecuador, Universidad de las Américas, Ecuador.
*Los miembros del grupo de trabajo se enumeran en los reconocimientos.
Correspondencia:
Dr. Gilberto González V.
Departamento de Endocrinología, Escuela de Medicina, Pontificia Universidad Católica de Chile.
Lira 85, 5º piso. Santiago-Chile.
Tel: 056-02-354-3095 - Fax: 0569-02-638-5675
E-mail: ggonzale@med.puc.cl
Introducción
Se estima que alrededor de mil millones de personas en el mundo sufren deficiencia o insuficiencia de vitamina D1, lo cual denominamos como niveles inadecuados de vitamina D, como se define más adelante. Los niveles inadecuados de vitamina D provocan un incremento de la pérdida y recambio óseo, así como debilidad muscular, generando o acelerando osteopenia, osteoporosis y un riesgo mayor de caídas y fracturas de cadera1. La deficiencia de vitamina D puede causar raquitismo en niños y osteomalacia en adultos. Recientemente, se llevó a cabo un debate entre un grupo de trabajo constituido por veinte médicos de once países latinoamericanos en San Pablo, Brasil, bajo la dirección de GG, MA y RJS, con la finalidad de revisar la prevalencia y los efectos de los niveles inadecuados de vitamina D, así como para establecer un consenso para Latinoamérica en cuanto a la función de la vitamina D en el manejo de la osteoporosis. Las fracturas vertebrales en Latinoamérica son comunes3. La prevalencia elevada de los niveles inadecuados de vitamina D es de gran preocupación debido al envejecimiento proyectado de la población y al riesgo creciente de fracturas osteoporóticas con el paso de la edad. El presente documento analiza los últimos adelantos relacionados con la importancia de la vitamina D en la osteoporosis y asimismo describe el primer Consenso para Latinoamérica sobre la función de la vitamina D en el manejo de la osteoporosis.
Biología de la vitamina D
Síntesis y metabolismo de la vitamina D
Entre las fuentes de vitamina D se encuentran la producción
endógena en la piel, ciertos alimentos y suplementos.
La exposición de la piel a la radiación solar ultravioleta B
(UVB) es la fuente principal de vitamina D en gran parte de
la población mundial1, gracias a la síntesis de vitamina D3.
Las fuentes dietéticas de vitamina D son escasas (pescados
grasos, aceite de pescado, huevos y alimentos fortificados)
y, en la mayoría de los países, no están disponibles o no se
consumen con regularidad. La síntesis de vitamina D en
la piel ocurre con la conversión del 7-dehidrocolesterol en
previtamina D3 al exponerse a la radiación UVB; posteriormente,
la previtamina D3 se transforma en vitamina D3 en
un proceso foto-químico o no enzimático1. La vitamina D,
incluyendo la vitamina D3 producida de manera endógena
y la vitamina dietética D2/D3, circula unida a la proteína
fijadora de vitamina D y se almacena y es liberada desde
las células grasas. La vitamina D se hidroxila en el hígado
para producir 25-hidroxivitamina D [25(OH)D] el metabolito
circulante principal y cuya medición es utilizada para
evaluar el contenido de vitamina D. La forma activa de la
vitamina D, 1,25-dihidroxivitamina D [1,25(OH)2D], se
produce en el riñón mediante la hidroxilación de 25(OH)
D. La producción renal de la vitamina D activa es controlada
estrictamente por retroalimentación negativa y por las concentraciones de la hormona paratiroidea (PTH), calcio
y fósforo, así como por el factor de crecimiento de fibroblastos
231.
Funciones de la vitamina D
Una función esencial e irremplazable de la vitamina D es su papel en la homeostasis mineral, principalmente en la absorción de calcio y de fósforo en el intestino, además del incremento de la reabsorción renal de calcio, la disminución de la síntesis y secreción de la PTH, y los efectos en los osteoblastos y osteoclastos1. Datos recientes demuestran que el contenido de vitamina D afecta la función muscular, y su suministro mejora la fuerza muscular, reduciendo así el riesgo de caídas5. Es importante señalar que los receptores de vitamina D están presentes en la mayoría de los tejidos y células del cuerpo humano. Es de gran interés el papel que puede jugar la vitamina D en la disminución del riesgo de desarrollar cánceres comunes, como el cáncer de colon y el cáncer de mama; enfermedades autoinmunes como diabetes tipo 1 y esclerosis múltiple; enfermedades infecciosas y enfermedades cardiovasculares1.
Definición de niveles inadecuados
de Vitamina D
El nivel sérico de la vitamina D activa [1,25(OH)2D] está controlado estrictamente por diferentes mecanismos de control homeostático y, por lo tanto, no es un buen indicador del estado de la vitamina D. En su lugar, el nivel sérico de 25(OH)D se utiliza como la mejor medición del contenido corporal de vitamina D1,6.
Los rangos de referencia de los niveles séricos de 25(OH) D en estudios previos se basaron en la población y es probable que se hayan incluido sujetos con niveles inadecuados de vitamina D. Existen enfoques recientes empleados para definir los niveles adecuados e inadecuados de vitamina D que utilizan cambios fisiológicos en mecanismos de homeostasis mineral. Por ejemplo, el nivel sérico de 25(OH) D se asocia inversamente con los niveles de la PTH7 hasta que los niveles séricos de 25(OH)D aumentan a 30-40 ng/ ml (correspondientes a 75-100 nmol/l, factor de conversión, x 2,5), suprimiendo hasta el máximo las concentraciones de la PTH1.
Basándose en estos datos, diversos autores proponen que los niveles séricos mínimos adecuados para 25(OH)D se encuentran en el rango de 28-32 ng/ml (70-80 nmol/l)8. Hollis 6 establece 32 ng/ml como el nivel “normal” mínimo para 25(OH)D circulante y señala que todavía deben determinarse los niveles óptimos, siendo probable que éstos difieran para las diferentes funciones fisiológicas.
Para fines prácticos de este documento, definimos los niveles inadecuados de vitamina D como niveles séricos de 25(OH)D igual o inferiores a 30 ng/ml (≤ 75 nmol/l), subdivididos en insuficiencia de vitamina D en niveles de 10-30 ng/ml (25-75 nmol/l) y deficiencia de vitamina D como < 10 ng/ml (< 25 nmol/l).
Prevalencia de los niveles inadecuados de vitamina D en Latinoamérica: Alcance del problema
Los niveles inadecuados de vitamina D son comunes tanto en Latinoamérica como a nivel mundial; afectan a gente de todas las edades y con mayor frecuencia a las mujeres posmenopáusicas. Entre las razones propuestas por las que existe una prevalencia elevada de los niveles inadecuados de vitamina D se incluyen la falta de exposición al sol, una disminución en la capacidad de sintetizar la vitamina D en la piel con el paso de la edad, el uso de filtros y bloqueadores solares, la pigmentación de la piel, pocas fuentes dietéticas de vitamina D y un uso poco frecuente de suplementos de vitamina D.
En un estudio internacional transversal de 2.606 mujeres posmenopáusicas con osteoporosis –realizado en 18 países localizados dentro de una latitud que variaba de 64°N a 38°S– Lips9, el porcentaje de mujeres con niveles inadecuados de vitamina D (niveles de 25(OH)D inferiores a 30 ng/ ml) en países latinoamericanos fue del 67% en México, del 42% en Brasil y del 50% en Chile9.
Otras investigaciones corroboran la existencia de una prevalencia elevada de niveles inadecuados de vitamina D en Latinoamérica, particularmente en personas de mayor edad, pero también en jóvenes. En su estudio de 555 mujeres posmenopáusicas sanas en Chile, Rodríguez y cols10, encontraron que casi la mitad (48%) tenía niveles séricos de 25(OH) D inferiores a 17 ng/ml (< 42,5 nmol/l).
De manera similar, en Sao Paulo, Brasil, el 71% de los pacientes de edad avanzada hospitalizados (n = 177) y el 56% de los pacientes de edad avanzada ambulatorios (n = 243), presentaban niveles de 25(OH)D inferiores a 20 ng/ml (< 50 nmol/l); además, el 62% y el 54% padecía de hipertiroidismo secundario11.
En Santiago, Chile (latitud 33ºS), González y cols12, reportaron que el 60% de las mujeres postmenopáusicas (n = 60) y el 27% de las mujeres premenopáusicas (n = 30) tenían niveles séricos de 25(OH)D inferiores a 20 ng/ml. Aunque los alimentos no están fortificados con vitamina D en Santiago, la mayoría de estas mujeres tenían una exposición normal al sol y en esta ciudad éste es suficientemente fuerte durante todo el año como para producir vitamina D en la piel. No obstante, muchas mujeres de mayor edad presentaban niveles inadecuados de vitamina D, inclusive durante el verano: los porcentajes de mujeres posmenopáusicas con niveles inferiores a 20 ng/ml fueron del 63% y del 57% en invierno y verano, respectivamente, y de mujeres premenopáusicas, 47% y 7%, respectivamente12.
Estudios en Argentina encontraron una prevalencia elevada de niveles inadecuados de vitamina D en sujetos tanto jóvenes como de edad avanzada, así como diferencias estacionales y geográficas sustanciales en los niveles séricos de 25(OH)D. Al final del invierno, dependiendo de la región (latitudes 26°S a 55°S), del 52% al 87% de las personas de edad avanzada sanas (n = 339) que habitaban en siete ciudades diferentes de Argentina tenían niveles séricos de 25(OH) D inferiores a 20 ng/mL13.
En Buenos Aires, Argentina (34ºS), tanto sujetos sanos jóvenes (n = 76) como de edad avanzada (n = 83) mostraron variaciones estacionales en los niveles séricos de 25(OH) D, registrándose hiperparatiroidismo secundario sólo en las personas de edad avanzada en invierno (28%) y en verano (21%)14. Durante el invierno, el 70% y el 65% de los jóvenes y personas de edad avanzada tuvieron niveles de 25(OH)D de inferiores a 20 ng/ml, respectivamente; en invierno, los porcentajes fueron ~15% en ambos grupos14.
Saraiva y cols15, reportaron un intervalo mayor a 30 días antes de que se observen cambios en los niveles séricos de 25(OH)D como resultado de la exposición o privación de la luz solar; en consecuencia, las mayores diferencias estacionales se registraron entre julio y febrero, los meses siguientes a los de menor y mayor radiación UV, respectivamente. En la población de su estudio de 250 personas de edad avanzada que vivían en San Paulo, Brasil, los niveles séricos de 25(OH)D variaron estacionalmente en correlación inversa con los niveles de la PTH. Los porcentajes de personas con niveles séricos de 25(OH)D inferiores a 20 ng/ml (<50 nmol/l) fueron de 66% en invierno, 70% en primavera, 33% en verano y 38% en otoño. Se registró hiperparatiroidismo secundario en el 70%, 62%, 36% y 41% en invierno, primavera, verano y otoño, respectivamente15.
En Venezuela, Ramos y cols16,17, comunicaron valores de 25(OH)D para mujeres premenopáusicas de entre 31 y 50 años, de un promedio (± SD) de 53 (± 24) ng/ml, 133 [± 60] nmol/l; rango, 25-133 ng/ml [63-333 nmol/l]. El promedio de los niveles de 25(OH)D fue 34 (± 8) ng/mL entre hombres (n = 35) y mujeres (n = 47), mayores de 60 años de edad (p < 0,001 para la diferencia entre mujeres premenopáusicas y las de edad avanzada). No hubo una diferencia significativa en los niveles entre hombres y mujeres, ni tampoco hubo correlación entre los niveles 25(OH)D y la edad en ninguno de los grupos16. Sin embargo, los niveles fueron significativamente diferentes (p = 0,05) entre las personas de edad avanzada que vivían en unidades geriátricas (edad promedio de 76 años) y entre quienes vivían en la comunidad (edad promedio de 68 años), 31 contra 37 ng/ml. El porcentaje de pacientes con niveles de 25(OH)D igual o inferiores a 20, 30 ó 53 ng/ml (el promedio premenopáusico), fue de 11%, 51% y 98%, respectivamente, en unidades geriátricas y 0%, 25% y 92%, respectivamente, en la comunidad. Los niveles promedio (± SD) de 25(OH)D en hombres venezolanos con una densidad mineral ósea baja (52 [± 15] ng/ml) fueron similares a los reportados en las mujeres premenopáusicas18.
Efectos de los niveles inadecuados de vitamina D
Conforme disminuyen los niveles séricos de 25(OH)D, los incrementos en las concentraciones de PTH provocan un mayor recambio óseo y resorción ósea con la liberación de calcio del hueso; disminución en la reabsorción tubular de fósforo e incremento en la producción de vitamina D (1,25[OH]2D) activa en el riñón1.
Con niveles de 25(OH)D inferiores a 10 ng/ml (< 25 nmol/L), el sistema homeostático ya no puede compensar; en consecuencia, las concentraciones bajas extracelulares de calcio y fosfato ionizados provocan defectos en la mineralización de la matriz ósea orgánica recientemente formada y la presencia de un cuadro clínico de raquitismo en niños y osteomalacia en adultos. La osteomalacia puede causar dolor óseo aislado o generalizado, con un cuadro clínico que puede asemejarse a la osteoporosis19.
Entre los efectos extraesqueléticos de los niveles inadecuados de vitamina D se incluyen la disminución de la fuerza muscular y del equilibrio, con un riesgo mayor de caídas5.
La vitamina D y las fracturas osteoporóticas
Los resultados de dos metanálisis recientes5,20 respaldan la importancia de la vitamina D en cuanto a la reducción del riesgo de caídas y fracturas osteoporóticas en personas de edad avanzada ambulatorias e institucionalizadas. La prevención de fracturas fue óptima en estudios con niveles promedio alcanzados de 25(OH)D de ~40 ng/mL~100 nmol/l; (Figura 2)20.
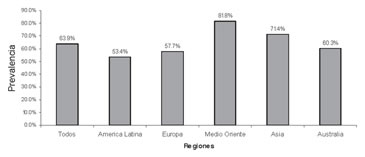 Figura 1. Niveles inadecuados de vitamina
D en mujeres con osteoporosis:
estudio transversal de 2.606 mujeres
posmenopáusicas con osteoporosis.
(Los niveles séricos inadecuados de vitamina
D se definieron como 25(OH)
D inferiores a 30 ng/ml [< 75 nmol/l].)
Adaptado de Lips P, y cols. J Intern
Med 2006; 260: 245–549. “Copyright
2010 Wiley. Used with permission
from Lips P, Hosking D, Lippuner K y
cols. The prevalence of vitamin D inadequacy
amongst women with osteoporosis:
an international epidemiological
investigation, J Intern Med, John
Wiley and Sons”.
Figura 1. Niveles inadecuados de vitamina
D en mujeres con osteoporosis:
estudio transversal de 2.606 mujeres
posmenopáusicas con osteoporosis.
(Los niveles séricos inadecuados de vitamina
D se definieron como 25(OH)
D inferiores a 30 ng/ml [< 75 nmol/l].)
Adaptado de Lips P, y cols. J Intern
Med 2006; 260: 245–549. “Copyright
2010 Wiley. Used with permission
from Lips P, Hosking D, Lippuner K y
cols. The prevalence of vitamin D inadequacy
amongst women with osteoporosis:
an international epidemiological
investigation, J Intern Med, John
Wiley and Sons”.
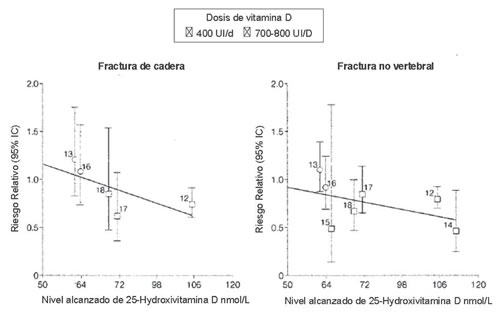
Figura 2. El riesgo de fracturas de cadera y no vertebrales disminuye con los niveles séricos crecientes de 25(OH)D (relación inversa significativa con p ≤ 0,03): resultados de un metanálisis20. Las cifras que acompañan a cada dato se refieren a estudios incluidos en el metanálisis; en todos ellos se administró colecalciferol (vitamina D3)2. Fracture prevention with vitamin D supplementation: a meta-analysis of randomized controlled trials, 2005; 293: 2257-64. “Copyright© 2010 American Medical Association. All rights reserved”.
La suplementación de vitamina D en dosis de 700-800
UI/día redujo el riesgo relativo de fractura de cadera un 26%
y de cualquier fractura no vertebral un 23%20. En el segundo
metanálisis5, la suplementación de vitamina D mostró reducir
el riesgo de caídas mayores al 20% en personas de edad
avanzada ambulatorias o institucionalizadas con una salud
estable. La función de las extremidades inferiores de las personas
de edad avanzada ambulatorias (60 años o más) es perceptiblemente
mejor con niveles de 25(OH)D de 16-38 ng/
ml (40-94 nmol/l) que con niveles inferiores a 16 ng/ml21. En
conjunto, estos estudios sugieren que la reducción en fracturas
debido a la vitamina D se debe en parte a su efecto en
las caídas.
Suplementación con vitamina D
Los niveles inadecuados de vitamina D son prevenibles y tratables. La opinión de los expertos es que los adultos que no tienen una adecuada exposición al sol requieren de una suplementación de vitamina D de aproximadamente 800- 1.000 UI/día1. Es probable que se necesiten dosis mayores para tratar la deficiencia de vitamina D. Las dosis recomendadas se basan en estudios de vitamina D3 (colecalciferol); la potencia de la vitamina D2 (ergocalciferol) parece ser menor1. La vitamina D puede suministrarse diariamente o de manera intermitente (semanalmente, mensualmente, o cada 3-6 meses) en una dosis total con base en la dosis diaria de de 800-1.000 UI, por ejemplo, 100.000 UI de la vitamina D3 cada 4 meses20. Un consenso europeo reciente establece que se debe recomendar la suplementación de calcio y vitamina D en mujeres con osteoporosis, así como en aquellas con mayor riesgo de desarrollar osteoporosis22.
La adherencia del paciente a la suplementación es esencial para que sea eficaz22. No obstante, la falta de adherencia al tratamiento de enfermedades crónicas es un problema común en la práctica clínica y, en particular, el apego a los suplementos de calcio y vitamina D es bajo, identificándose la falta de motivación como la causa de no apego en un estudio23.
La toxicidad por vitamina D es poco común
Se justifica el uso de una dosis de vitamina D3 de 10.000 UI/día en la población en general ya que no causa efectos adversos24. La vitamina D es una prohormona y su conversión a vitamina D activa es regulada por mecanismos de retroalimentación complejos. No se conocen casos de toxicidad por vitamina D asociada con la exposición al sol; asimismo, es improbable la exposición tóxica a la vitamina D a través del alimento, incluyendo alimentos fortificados adecuadamente24. La intoxicación por vitamina D se presenta en niveles séricos de 25(OH)D mayores a 150 ng/ml (374 nmol/l)1.
Posterior a la revisión y discusión de la información anteriormente expuesta, el grupo de trabajo cuyos nombres se incluyen al final de este documento, concordó su opinión respecto las siguientes preguntas:
- ¿Cuál es su opinión en relación con la importancia de los niveles inadecuados de vitamina D (insuficiencia y deficiencia)?
El panel reconoce la importancia de identificar los niveles adecuados de vitamina D para una salud esquelética óptima. De acuerdo a la evidencia actual, los niveles de 25(OH) D inferiores a 30 ng/ml (< 75 nmol/L) deben considerarse niveles inadecuados de vitamina D. El panel acepta las siguientes definiciones: insuficiencia de vitamina D con niveles de 25(OH)D de 10-30 ng/ml y deficiencia de vitamina D con niveles de 25(OH)D inferiores a 10 ng/ml.
- ¿Cuál es la prevalencia de los niveles inadecuados de vitamina D en su país y en Latinoamérica? ¿Existen datos suficientes?
Existen estudios epidemiológicos sobre la vitamina D para Argentina, Brasil, Chile, Colombia, México, Perú y Venezuela; los resultados de dichos estudios indican una prevalencia elevada de niveles inadecuados de vitamina D en mujeres posmenopáusicas.
El panel reconoce la necesidad de contar con estudios epidemiológicos, empleando métodos iguales o similares en todos los países latinoamericanos que no cuentan con datos sobre la prevalencia de niveles inadecuados de vitamina D. Además, el panel reconoce la necesidad de evaluar el nivel de conocimiento –entre la comunidad médica y los pacientes– sobre la importancia de la vitamina D en relación con la osteoporosis.
- ¿Cuándo es recomendable medir los niveles de 25(OH)D?
En virtud de la prevalencia elevada de niveles inadecuados de vitamina D y la seguridad de la dosis recomendada de la vitamina D3, no es necesario ni se recomienda medir los niveles de la 25(OH)D para el manejo médico de la mayoría de pacientes con osteoporosis posmenopáusica.
El panel recomienda medir los niveles de la 25(OH)D principalmente en las siguientes situaciones: sospecha de osteoporosis secundaria, en pacientes de edad avanzada institucionalizados y en algunos casos para vigilar el tratamiento de pacientes con alto riesgo de desarrollar deficiencia de vitamina D (por ejemplo, pacientes de edad avanzada, aquellos que reciben tratamiento anticonvulsivo crónico) así como cuando se sospecha de osteomalacia.
- ¿Cuáles son las siguientes formulaciones de vitamina D disponibles en su país y cuáles deberían estar disponibles?.
En la mayoría de los países latinoamericanos, la vitamina D está disponible sólo en formulaciones combinadas con calcio o se añade a multivitamínicos en dosis de 200-1.000 UI.
El panel recomienda, enfáticamente, a la industria y a las agencias gubernamentales contar con formulaciones individuales de vitamina D en dosis de 800 UI para la suplementación diaria o para el suministro de dosis altas equivalentes para cada semana, mes, o cada 3-6 meses (10,000, 50,000 o 100,000 UI). Estas dosis se pueden utilizar en la corrección inicial de la deficiencia de vitamina D e incluso en el tratamiento continuo, teniendo precaución en cuanto a la dosificación.
Las dosis elevadas se pueden suministrar con mayor frecuencia durante un período limitado en caso de haber deficiencia de vitamina D.
- 5. ¿Cuál considera usted que es un umbral seguro para los niveles de vitamina D?, ¿Cuál es la dosis diaria de vitamina D requerida para alcanzar tal umbral de seguridad?
El panel acuerda que hay un temor injustificado en la comunidad médica en relación con la toxicidad de la suplementación de vitamina D a las dosis recomendadas.
Los efectos tóxicos de la vitamina D que causan la hipercalciuria y la hipercalcemia se presentan con niveles séricos de 25(OH)D mayores a 160 ng/ml (400 nmol/L).
Una dosis diaria continua por arriba de las 10.000 UI de vitamina D puede llegar a ser tóxica.
Por lo tanto, la dosis recomendada de vitamina D de 800-1.000 UI/día no representa ningún riesgo.
Agradecimientos
Los autores agradecen al Prof. Uri A. Liberman por su guía y contribuciones a la formulación de las declaraciones del consenso. La ayuda editorial fue proporcionada por la Dra. Elizabeth V. Hillyer con el apoyo financiero de Merck Sharp & Dohme (MSD). La mesa redonda fue patrocinada por MSD.
Miembros del grupo de trabajo
Dr. Gilberto González (Presidente), Departamento de
Endocrinología, Facultad de Medicina, Pontificia Universidad
Católica de Chile, Santiago, Chile.
Dra. Marina Arriagada (Coordinadora), Clínica de Reumatología y Rehabilitación, Fundación Chilena de Osteoporosis, Santiago, Chile.
Dr. Raúl Jervis (Coordinador), Hospital Metropolitano, Quito, Universidad Central del Ecuador, Universidad de las Américas, Ecuador.
Dr. Wellington Aguirre, Facultad de Ciencias Médicas, Universidad Central del Ecuador, Quito, Ecuador.
Dr. Ascanio Bencosme, Departamento de Ginecología y Obstetricia, Pontificia Universidad Católica Madre y Maestra, Santiago, República Dominicana.
Dr. Jorge Castillo, Universidad Nacional de Colombia, Servicio de Endocrinología, Compensar EPS, Bogotá, Colombia.
Dra. Sonia Cerdas, Servicio de Endocrinología, Hospital CIMA San José, Costa Rica.
Dr. Pedro Alberto García-Hernández, Servicio de Endocrinología y Centro de Osteoporosis, Hospital Universitario, Monterrey, Nuevo León, México.
Dr. Renato Guzmán, Servicio de Inmuno-Reumatología, Departamento de Medicina Interna, Clínica Saludcoop 104, Bogotá, Colombia.
Dr. José Guillermo Jiménez Montero, Servicio de Endocrinología, Hospital CIMA San José, Costa Rica. Dra. Marise Lazaretti Castro, División de Enfermedades Osteometabólicas y Endocrinología, Universidad Federal de São Paulo (UNIFESP), Brasil.
Dr. Luis Lunar, Servicio de Endocrinología y Diabetes, Clínica Integral Louis Braille II, Caracas, Venezuela.
Prof. Dra. Zulema Man, Centro TIEMPO, Fundación FUNDEMOS, Buenos Aires, Argentina.
Dr. David Martín, Unidad de Menopausia y Osteoporosis, Clínica El Ávila, Caracas, Venezuela.
Dr. José Alexandre Mendonça, Servicio de Reumatología, Pontificia Universidad Católica de Campanas, Brasil.
Dr. José Fernando Molina, Universidad CES, y la Unidad de Osteoporosis y Climaterio, Clínica del Prado, Medellín, Colombia.
Dr. Luis Vidal Neira, Servicio de Reumatología, Hospital María Auxiliadora, Lima, Perú.
Dr. Sergio Ragi Eis, CEDOES - Diagnostico e Pesquisa da Osteoporose do Espirito Santo, Vitória, Brazil.
Dra. Vera Lucia Szejnfeld, Servicio de Reumatología, UNIFESP/EPM, Brasil.
Dr. Eduardo Manuel Vega, Centro Internacional de Investigaciones en Obesidad y Endocrinopatías, Buenos Aires, Argentina.
Dr. Casimiro Velazco, Instituto de Endocrinología, Nutrición y Osteoporosis, Santo Domingo, República Dominicana.
Dra. María Soledad Verdesoto, Servicio de Endocrinología de Solca (Sociedad de Lucha Contra el Cáncer), Ecuador.
Referencias
- Holick MF. 2007. Vitamin D deficiency. N Engl J Med 357: 266-81.
- Lips P. 2001. Vitamin D deficiency and secondary hyperparathyroidism in the elderly: consequences for bone loss and fractures and therapeutic implications. Endocr Rev 22: 477-501.
- Clark P, Cons-Molina F, Deleze M, et al. 2009. The prevalence of radiographic vertebral fractures in Latin American countries: the Latin American Vertebral Osteoporosis Study (LAVOS). Osteoporos Int 20: 275-282.
- Morales-Torres J, Gutiérrez-Urena S 2004. The burden of osteoporosis in Latin America. Osteoporos Int 15: 625-632.
- Bischoff-Ferrari HA, Dawson-Hughes B, Willett WC, y cols. 2004. Effect of Vitamin D on falls: a meta-analysis. JAMA 291: 1999-2006.
- Hollis BW. 2008. Assessment of vitamin D status and definition of a normal circulating range of 25-hydroxyvitamin D Curr Opin Endocrinol Diabetes Obes 15: 489-494.
- Lips P, Duong T, Oleksik A, et al. 2001. A global study of vitamin D status and parathyroid function in postmenopausal women with osteoporosis: baseline data from the multiple outcomes of raloxifene evaluation clinical trial. J Clin Endocrinol Metab 86: 1212-1221.
- Dawson-Hughes B, Heaney RP, Holick MF, et al. 2005. Estimates of optimal vitamin D status. Osteoporos Int 16: 713-716.
- Lips P, Hosking D, Lippuner K, et al. 2006. The prevalence of vitamin D inadequacy amongst women with osteoporosis: an international epidemiological investigation. J Intern Med 260: 245-254.
- Rodríguez-Portales J, Valdivia CG, Trincado MP. 2007. Fracturas vertebrales, osteoporosis y vitamina D en la posmenopausia: Estudio en 555 mujeres en Chile. Rev Med Chile 135: 31-36.
- Saraiva GL, Cendoroglo MS, Ramos LR, y cols. 2007. Prevalencia da deficiencia, insuficiencia de vitamina D e hiperparatiroidismo secundario em idosos institucionalizados e moradores na comunidade da cidade de Sao Paulo, Brasil. Arq Bras Endocrinol Metabol 51: 437-442.
- González G, Alvarado JN, Rojas A, et al. 2007. High prevalence of vitamin D deficiency in Chilean healthy postmenopausal women with normal sun exposure: additional evidence for a worldwide concern. Menopause 14: 455-461.
- Oliveri B, Plantalech L, Bagur A, et al. 2004. High prevalence of vitamin D insufficiency in healthy elderly people living at home in Argentina. Eur J Clin Nutr 58: 337-342.
- Fassi J, Russo Picasso MF, Furci A, y cols. 2003. Variaciones estacionales de 25hidroxivitamina D en jóvenes y ancianos de la ciudad de Buenos Aires. Medicina (B Aires) 63: 215-220.
- Saraiva GL, Cendoroglo MS, Ramos LR, et al. 2005. Influence of ultraviolet radiation on the production of 25 hydroxyvitamin D in the elderly population in the city of Sao Paulo (23 degrees 34’S), Brazil. Osteoporos Int 16: 1649-1654.
- Ramos J, Riera-Espinoza G. Valores de 25-hydroxyvitamin D (25-OH D3) en mujeres venezolanas premenopáusicas con densidad ósea normal. Presentado en el X Congreso Venezolano de Endocrinología y Metabolismo del 11 al 15 de julio de 2006.
- Riera-Espinoza G, Riera F, Ramos J, y cols. Valores de 25-hydroxyvitamina D en ancianos que viven en una unidad geriátrica o en la comunidad. Presentado en el X Congreso Venezolano de Endocrinología y Metabolismo del 11 al 15 de julio de 2006.
- Constantino R, Ramos J, Cedeño-Taborda J, et al. 2006. Values of 25-hydroxyvitamin D (25-OH D3) in Venezuelan men with low bone mineral density. Osteoporos Int 17 (Supl 2): S143-S355.
- Holick MF. 2006. High prevalence of vitamin D inadequacy and implications for health. Mayo Clin Proc 81: 353-373.
- Bischoff-Ferrari HA, Willett WC, Wong JB, y cols. 2005. Fracture prevention with vitamin D supplementation: a meta-analysis of randomized controlled trials. JAMA 293: 2257-2264.
- Bischoff-Ferrari HA, Dietrich T, Orav EJ, y cols. 2004. Higher 25-hydroxyvitamin D concentrations are associated with better lower-extremity function in both active and inactive persons aged > or = 60 y. Am J Clin Nutr 80: 752-758.
- Rizzoli R, Boonen S, Brandi ML, et al. 2008. The role of calcium and vitamin D in the management of osteoporosis. Bone 42: 246-249.
- Rossini M, Bianchi G, Di Munno O, et al. 2006. Determinants of adherence to osteoporosis treatment in clinical practice. Osteoporos Int 17: 914-921.
- Hathcock JN, Shao A, Vieth R, et al. 2007. Risk assessment for vitamin D. Am J Clin Nutr 85: 6-18.