Frecuencia de periodontitis en una muestra de diabéticos tipo 2 y no diabéticos de Santiago de Chile
A. Verónica Araya O.1, Violeta Pavez C.2,a, Natalia Baksai L.2,b, Francisco Cordero A.1, Marta Lechuga C.3 y Gloria López S.1
Frequency of periodontitis in a sample of type 2 diabetics and non diabetics
1Sección de Endocrinología y Diabetes, Hospital Clínico de la Universidad de Chile.
2Facultad de Odontología de la Universidad de Chile.
3Departamento de Oftalmología Hospital Clínico de la Universidad de Chile.
aOdontóloga periodoncista.
bTesista de Pregrado Facultad de Odontología Universidad de Chile.
Financiado por Programa Domeyko Salud, Vicerrectoría Investigación y Desarrollo de la Universidad de Chile.
Correspondencia
Dra Verónica Araya O.
Santos Dumont 999-Independencia
Santiago-Chile.
Fax: 56-2-7776891
E-mail: varaya@redclinicauchile.cl
Recibido: 01 de Septiembre de 2011
Aceptado: 20 de Septiembre de 2011
Background: Periodontitis is highly prevalent in the general population and some diseases such as diabetes could favor its development, reaching a prevalence of over 60%. Aim: To evaluate the prevalence of periodontitis in a sample of DM2 patients and to compare it with non-diabetic subjects. Patients and Methods: We enrolled patients with DM2 and non-diabetic adult subjects. According to periodontal diagnosis, they were classified as healthy, having mild to moderate periodontitis and having severe periodontitis. Anthropometric assessment was performed and a fasting blood sample was obtained to measure blood glucose and lipid profile. In diabetics, HbA1c, creatinine, microalbuminuria, EKG and fundoscopy were evaluated. Results: We studied 62 patients with DM2, aged 55.2 ± 9.4 years and with 4.7 ± 4.6 years of diagnosis of diabetes and 65 non-diabetic subjects, aged 50 ± 9.6 years. Among diabetics, HbA1c values were 7.85 ± 2.3%. The proportion of periodontitis was significantly higher in DM2 than in non-diabetics (98 and 89%, p = 0.02). Mild to moderate and severe periodontitis was observed in 39 and 60% of diabetic patients, respectively. Among non-diabetics, 11% were healthy, 5% had gingivitis, 37% mild to moderate periodontitis and 48% had severe periodontitis. The frequency of chronic complications of diabetes was low, except for positive microalbuminuria, that was present in 42.6% of patients. Conclusions: We found a high prevalence of periodontitis in diabetic and no diabetic patients, but among the former, it was near to 100%. Periodontal examination should be considered as part of the evaluation of patients with type 2 diabetes.
Key words: Periodontitis, periodontal disease, Type 2 diabetes.
La salud periodontal resulta del equilibrio homeostático entre la colonización microbiana del surco gingivodentario y las defensas del hospedero (flora residente, saliva, respuesta inmune de mucosas). Las enfermedades periodontales, gingivitis y periodontitis, son infecciosas, generando una respuesta inflamatoria e inmunológica. La periodontitis es causada por un grupo de bacterias gram (-), principalmente anaerobias estrictas (Porphyromona gingivalis, Tanerella forsitensis, Treponema denticola), que afectan encía, ligamento periodontal, cemento radicular y el hueso alveolar. Junto a toxinas y enzimas bacterianas, se reconoce como mecanismo patogénico a la activación de una respuesta inflamatoria-inmunológica del organismo1,3. También el óxido nítrico (NO), que en el tejido periodontal y saliva formaría parte de los mecanismos de defensa no específicos contra las bacterias patógenas, en cantidades excesivas puede contribuir a la destrucción de los tejidos4. Este efecto sería mediado por las enzimas óxido nítrico sintasa inducible (iNOS) y óxido nítrico sintasa endotelial (eNOS). Se ha demostrado que la expresión de esta última en la encía, podría ser inducida por el lipopolisacárido (LPS) bacteriano y se ha documentado que la producción de NO mediada por eNOS estaría relacionada con procesos críticos de la patogénesis de la periodontitis5,6.
En estados iniciales la periodontitis es indolora sin embargo, puede alterar la calidad de vida de las personas, ya que produce sangrado gingival y halitosis. Con el avance de la lesión ocurre movilidad dentaria, y finalmente pérdida de los dientes.
Se ha descrito una prevalencia de periodontitis cercana al 35% en la población general de Latinoamérica7. Un estudio epidemiológico realizado en 1998 en Santiago de Chile, mostró un 48% en mayores de 35 años, aumentando con la edad y en estratos socio-económicos más bajos8. Recientemente, Gamonal et al evaluaron la pérdida de inserción clínica en población chilena perteneciente a 15 regiones de Chile, demostrando en más del 90% de los casos algún nivel de pérdida de inserción9.
Se ha establecido que en los sujetos diabéticos existe una mayor prevalencia y severidad de periodontitis que en los individuos no diabéticos, posiblemente debido a una hiperrespuesta inflamatoria en los tejidos periodontales, lo que lleva a pérdida de inserción en forma temprana10,12. Por otra parte, la acumulación de productos de glicosilación avanzada y la alteración que determinan en la función de las células endoteliales, afectarían al periodonto al igual que la retina o el glomérulo renal13,14.
En un estudio realizado previamente por nuestro grupo, demostramos en diabéticos tipo 1 de 18 a 30 años, una frecuencia de periodontitis de 41%15, prevalencia similar al 40% observado por Galea en Malta en diabéticos de 20 a 29 años16.
En una población de diabéticos tipo 2 seleccionada, como la de los indios Pima, se ha descrito una frecuencia de periodontitis moderada y severa cercana al 60% en mayores de 25 años17. En el estudio de Gamonal et al, también se demostró que la pérdida de inserción clínica fue significativamente mayor en los diabéticos9.
La Internacional Diabetes Federation (IDF) elaboró una guía acerca de la salud oral en personas con diabetes, publicada en el año 2009, recomendando que los médicos tratantes indaguen acerca de síntomas como sangrado gingival y halitosis18. Esto nos indica la trascendencia que está adquiriendo esta patología en el contexto del manejo actual de la diabetes.
La frecuencia de periodontitis en diabéticos tipo 2 no ha sido evaluada en forma dirigida en nuestro medio. En el contexto del proyecto "Evaluación de marcadores bioquímicos y genéticos de daño endotelial y periodontal en individuos obesos normoglicémicos, intolerantes a la glucosa y diabéticos tipo 2", del Programa Domeyko Salud de la Vicerrectoria de Investigación y Desarrollo de la Universidad de Chile, tuvimos acceso a una muestra de diabéticos tipo 2, determinamos su estado de salud periodontal y lo comparamos con una muestra de sujetos no diabéticos.
Pacientes y Métodos
En un estudio de corte transversal, se reclutó a pacientes adultos de ambos sexos, con DM2 diagnosticada según los criterios de la American Diabetes Association (ADA) 2006 y sujetos no diabéticos (ND), de diferentes sectores de Santiago, que acudieron al Hospital Clínico de la Universidad de Chile a actividades educativas en prevención de diabetes y obesidad, realizadas durante los años 2008-2009. Se excluyó a los edentados o que tenían otras patologías que presentan mayor asociación con periodontitis o inflamación crónica: cardiopatía coronaria, neoplasias, insuficiencia renal o hepática. Además se excluyeron aquellos que recibían tratamiento anticoagulante, antidepresivo o corticoides. También se excluyó a los sujetos no diabéticos con intolerancia a la glucosa.
El estado periodontal fue determinado por 3 examinadores calibrados intra e inter-examinador, ciegos para la condición médica de los pacientes, en la Facultad de Odontología de la Universidad de Chile. Se utilizó una sonda periodontal manual, modelo Universidad Carolina del Norte, para determinar porcentaje de sitios sangrantes y medir profundidad de sondaje (PS) y nivel de inserción clínica (NIC). Se consideró que un sitio presentaba "saco periodontal" si su profundidad al sondaje era mayor a 3mm, existía pérdida de inserción clínica y sangrado durante el examen. El estado periodontal se definió de acuerdo al siguiente criterio: a) Sin enfermedad periodontal: en ausencia de sacos periodontales y menos del 20% de sitios con sangrado; b) Gingivitis: en ausencia de sacos periodontales y 20% o más de sitios con sangrado; c) Periodontitis: en presencia de sacos periodontales (PS mayor o igual a 4 mm, y pérdida de inserción, en el mismo sitio). La extensión (localizada/generalizada) y severidad (leve/moderada/severa) de la periodontitis se basó en los criterios propuestos por la Academia Americana de Periodoncia (1999). Se diagnosticó periodontitis generalizada severa al haber pérdida de NIC de 5 mm o más, en presencia de sacos periodontales, en a lo menos 3 dientes de distinto sextante.
Se definió como hábito tabáquico (+) al antecedente de fumar o haber fumado, más de 1 año.
A todos se les realizó examen físico completo, consignando el peso, talla, perímetro de cintura y presión arterial. Además se les tomó muestra de sangre en ayunas para determinación de glicemia y perfil lipídico y en los sujetos diabéticos, HbA1c y creatinina. También se les midió microalbuminuria en muestra de orina matinal, electrocardiograma y se realizó fondo de ojo por oftalmólogo. A los sujetos ND que tuvieron un IMC > 26 kg/m2 o glicemia ≥ 100 mg/dl, se les realizó una prueba de tolerancia oral con 75 g de glucosa para descartar cualquier alteración de la tolerancia a la glucosa no diagnosticada.
El protocolo fue aprobado por los Comités de Ética del Hospital Clínico y de la Facultad de Odontología de la Universidad de Chile y todos los participantes previamente firmaron un consentimiento informado.
Análisis estadístico
Los datos se presentan como promedio ± DS y mediana para variables categóricas. Para establecer las diferencias entre grupos se utilizaron los tests de t de student`s para variables con distribución normal. Los tests de c2 con corrección de Yates y Mann.Whitney se utilizaron para variables discontinuas y sin distribución normal respectivamente. Se consideró significativo un p < 0,05.
Resultados
La muestra final estuvo constituida por 62 DM2 de 32 a 71 años de edad y 65 ND sin intolerancia a glucosa, en el mismo rango de edad, de diferentes áreas de Santiago y de nivel socio-económico medio bajo, medio y medio alto. La proporción entre hombres y mujeres fue similar en ambos grupos. Las características de los sujetos se muestran en la Tabla 1.
Tabla 1. Características clínicas y de laboratorio de una muestra de pacientes diabéticos tipo 2 y no diabéticos que fueron sometidos a un examen periodontal
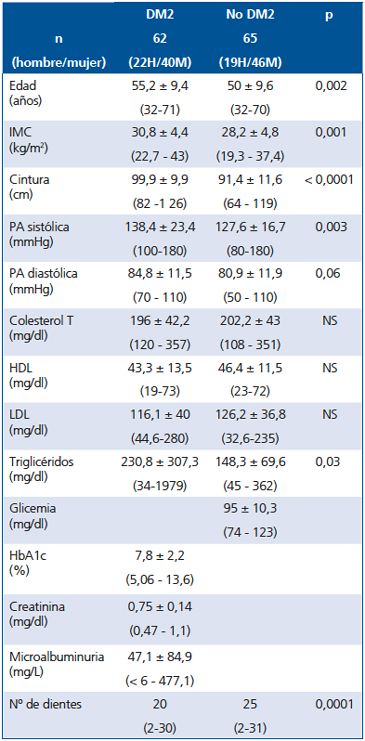
Se presentan los valores promedio ± DS y rangos. El número de dientes se presenta como mediana.
El índice de masa corporal (IMC), la circunferencia de cintura, la presión arterial sistólica y los triglicéridos fueron significativamente mayores en los diabéticos que en los no diabéticos. La edad promedio de ambos grupos se ubicó en la década de 50 a 60 años pero, fue significativamente menor en los no diabéticos.
El 89,4% de los pacientes diabéticos tenía un IMC > 26 kg/m2 y 53% > 30 kg/m2. El tiempo promedio de diagnóstico de la diabetes fue 4,7 ± 4,9 años, rango desde recién diagnosticado hasta 24 años. La terapia hipoglicemiante consistió en drogas orales en todos los casos, metformina sola o asociada a glibenclamida. El 48,5% tenía HTA en tratamiento, y 33,3%, dislipidemia en tratamiento.
En cuanto a la evaluación de repercusiones crónicas de la diabetes, el fondo de ojo mostró algún grado de retinopatía diabética en 11,6% de los casos, 5% tuvo un examen de sensibilidad de los pies con monofilamento alterado, 11% tuvo disminución de los pulsos distales, 4,8% tuvo alteración al ECG sugerente de infarto previo y 42,6% tuvo microalbuminuria (+) en la muestra de orina evaluada (> 16 mg/l).
En los sujetos ND el IMC fue > de 26 kg/m2 en 56% de los casos y 34% tuvo un IMC > 30 kg/m2. El 15,4% tenía antecedente de HTA en tratamiento y el 12% de dislipidemia en tratamiento.
En cuanto al estado periodontal, en los DM2 sólo un caso no tuvo periodontitis en cambio en los ND, 10,8% (7/65) fue sano desde el punto de vista periodontal por lo tanto, la presencia de periodontitis (independiente de su severidad), fue significativamente mayor en los DM2 que en los ND (98% vs 89%, p = 0,02). Al comparar la proporción de sujetos con periodontitis leve y moderada en ambos grupos, no hubo diferencia significativa, DM2: 38,7% (24/62) y ND: 36,9% (24/65). La proporción con periodontitis severa fue mayor en los DM2: 59,6% (37/62) vs 47,6% (31/65) en ND sin embargo, no alcanzó significancia estadística (p = 0,05) (Figura 1). En los ND 4,6% (3/65) tuvo gingivitis. El número de dientes presente fue significativamente menor en los DM2 que en los ND (20 vs 25, p = 0,0001).
No hubo diferencias significativas entre ambos grupos para el hábito de fumar, 22,7% de fumadores en el grupo DM2 y 24,6% en el grupo no diabético (p = 0,6).
Al comparar los DM2 con periodontitis leve y moderada con los DM2 con periodontitis severa, no se observó diferencia para los parámetros clínicos y de laboratorio evaluados, incluida la HbA1c. Sólo los triglicéridos fueron significativamente más altos en el grupo con periodontitis severa (195,7 ± 142,4 vs 249,1 ± 374,9 mg/ml, p < 0,001). La HbA1c tampoco se correlacionó con la severidad de la periodontitis y al comparar los DM2 con HbA1c > 7% (n = 33) con los con HbA1c < 7% (n = 33), no observamos diferencias en la proporción de sujetos con periodontitis severa.
Al analizar por sexo, la proporción de pacientes con periodontitis severa fue significativamente mayor en los hombres que en las mujeres, 66,6% vs 48,8% y la HbA1c fue significativamente mayor en ellos: 8,89 ± 2,2% vs 7,32 ± 2,1% (p < 0,02).
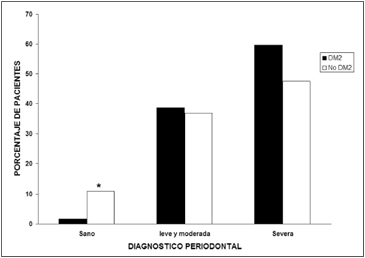 Figura 1. Distribución de los sujetos diabéticos y no diabéticos divididos según el diagnóstico periodontal en: sanos, periodontitis leve y moderada y periodontitis severa. El porcentaje de sujetos sanos es significativamente mayor en los no diabéticos (*p = 0,02). No se observó diferencia significativa entre ambos grupos para el porcentaje de sujetos con periodontitis leve y moderada (p = 0,08) o severa (p = 0,05).
Figura 1. Distribución de los sujetos diabéticos y no diabéticos divididos según el diagnóstico periodontal en: sanos, periodontitis leve y moderada y periodontitis severa. El porcentaje de sujetos sanos es significativamente mayor en los no diabéticos (*p = 0,02). No se observó diferencia significativa entre ambos grupos para el porcentaje de sujetos con periodontitis leve y moderada (p = 0,08) o severa (p = 0,05). Discusión
En este estudio, encontramos una alta frecuencia de periodontitis en una muestra de sujetos adultos de la ciudad de Santiago, siendo significativamente mayor en diabéticos tipo 2 que en el grupo de no diabéticos, lo que concuerda con lo descrito previamente en nuestro medio8,9.
Se reconoce que las bacterias causantes de periodontitis, tanto en sujetos diabéticos como no diabéticos, son las mismas. La diferencia radicaría en la respuesta secretora de mediadores inflamatorios como prostaglandina E2, factor de necrosis tumoral-alfa (TNF-a), interleuquina-6 (IL-6) e interleuquina-1b (IL-1b) de los monocitos en los diabéticos frente a la estimulación del LPS bacteriano19,24. Esto también estaría favorecido por la presencia de productos de glicosilación avanzada13,14 .
Estos mecanismos determinarían la pérdida de inserción, pérdida de hueso alveolar y finalmente, la pérdida de piezas dentarias en forma temprana.
Aunque en nuestro estudio no observamos una diferencia significativa al comparar el grado de severidad de la periodontitis entre ambos grupos, probablemente por el numero bajo de casos, si encontramos un número de dientes significativamente menor en los diabéticos, lo que concuerda con lo descrito por Gamonal et al9. Este hallazgo es relevante ya que impacta directamente en la calidad de vida de los sujetos. Por una parte, los trastornos masticatorios llevan al consumo de un tipo de alimentos que puede favorecer el aumento de peso y descontrol metabólico. Por otra parte, hay repercusiones sociales y psicológicas.
Aunque los no diabéticos seleccionados estaban en el mismo rango etáreo que los diabéticos, el promedio de edad fue algo mayor en estos últimos. Esto se debe a que la diabetes en nuestro medio prevalece sobre los 45 años. Este factor podría haber influido en la mayor frecuencia de periodontitis observada en este grupo, sin embargo, igual fue mayor a la descrita en estudios epidemiológicos para población de edad media latinoamericana7.
Otro factor de riesgo reconocido para el desarrollo de periodontitis es el tabaquismo25,26 pero, en nuestra muestra no observamos diferencias en la proporción de fumadores en ambos grupos.
En los individuos diabéticos la periodontitis se presentaría de forma similar a las complicaciones crónicas de la diabetes; es decir, a mayor duración de la diabetes mayor frecuencia de periodontitis27,28. Sin embargo, en nuestros sujetos el promedio de tiempo de diagnóstico de la diabetes fue sólo 4,7 años y la frecuencia de complicaciones crónicas observada en esta muestra, exceptuando la microalbuminuria, fue inferior al 15%, contrastando con la elevada frecuencia de periodontitis encontrada.
Se ha descrito que la periodontitis se asociaría a un mayor riesgo cardiovascular mediado por el aumento de factores inflamatorios circulantes. Se ha demostrado que algunos polimorfismos de IL1 estarían relacionados con esta asociación y con la reducción de la respuesta inflamatoria después del tratamiento periodontal29. En los DM2 la periodontitis severa se relacionaría con un riesgo de muerte por causa cardiovascular y renal 3 veces mayor que en los con periodontitis leve a moderada o sin periodontitis17. También la presencia y severidad de la periodontitis podría predecir el desarrollo de enfermedad renal en estos pacientes30. Interesantemente, alrededor del 40% de nuestros casos presentaron microalbuminuria.
Desde hace 2 décadas aproximadamente, se comenzó a relacionar la severidad de la periodontitis con la descompensación metabólica31,32 pero, los resultados del tratamiento y su relación con la mejoría del nivel de HbA1c han sido contradictorios, principalmente debido a la heterogeneidad de los grupos evaluados y los parámetros aplicados para definir mejoría del control metabólico33,35. En nuestro estudio, la falta de casos sin periodontitis no nos permitió establecer una comparación con el control metabólico y no encontramos diferencias en la proporción de periodontitis severa entre los que tenían HbA1c > 7% y < 7%. Sin embargo, los pacientes de sexo masculino tuvieron más periodontitis severa que las mujeres y la HbA1c también fue significativamente mayor en ellos (> 8,5%).
Aunque nuestra muestra es heterogénea y no fue representativa de toda la población de Santiago, pudiendo existir un sesgo de selección, diabéticos y no diabéticos tenían el mismo rango etáreo y provenían de estratos socio-económicos similares por esto, nos parece relevante el hallazgo de periodontitis en casi todos los pacientes con DM2 evaluados, superando a las otras complicaciones crónicas de la diabetes. Si consideramos que el 34% de los ND presentó obesidad, condición que también se asocia a una mayor prevalencia de periodontitis y que puede haber influido en la alta frecuencia observada también en este grupo, igualmente fue significativamente mayor en los diabéticos36.
Concluimos que, la elevada frecuencia de periodontitis detectada en diabéticos, nos obliga a considerar al examen periodontal como parte de las evaluaciones de rutina de estos pacientes, considerando el potencial impacto que esta patología puede tener sobre el control metabólico y riesgo cardiovascular.
Agradecimientos
Agradecemos a la Srta. Andrea Valdivia por su colaboración en el examen de los pacientes y al Sr. Alvaro Reyes por la asesoría estadística prestada.
Referencias
- Socransky SS, Haffajee AD. 2005. Periodontal microbial ecology. Periodontology 2000 38: 135-187.
- Page RC, Kornman K. 1997. The pathogenesis of human periodontitis: An introduction. Periodontology 2000 14: 9-11.
- Kornman K, Page RC, Tonetti M. 1997. The host response to the microbial challenge in periodontitis: assembling the players. Periodontology 2000 14: 33-53.
- Ugar-Cankal D, Ozmeric NA. 2006. Multifaceted molecule, nitric oxide in oral and periodontal diseases. Clinica Chimica Acta 366: 90–100.
- Kendall HK, Haase HR, Li H, Xiao Y, Bartold PM. 2000. Nitric oxide synthase type-II is synthesized by human gingival tissue and cultured human gingival fibroblasts. J Periodont Res 35: 194-200.
- Connelly L, Jacobs AT, Palacios-Callender M, Moncada S, Hobb AJ. 2003. Macrophage endothelial nitric-oxide synthase autoregulates cellular activation and pro-inflammatory protein expression. J Biol Chem 278: 26480-26487.
- Gjermo P, Rösing CK, Susin C, Oppermann R. 2002. Periodontal diseases in Central and South America. Periodontology 2000 29: 70–78.
- Gamonal JA, López NJ, Aranda W. 1998. Periodontal conditions and treatment needs, by CPITN, in the 35-44 and 65-74 year-old population in Santiago, Chile. Int Dent J 48: 96-103.
- Gamonal J, Mendoza C, Espinoza I, Muñoz A, Urzúa I, Aranda W, et al. 2010. Clinical Attachment Loss in Chilean Adult Population: First Chilean Nacional Dental Examination Survey. J Periodontol 81:1403-1410.
- Löe H. 1993. Periodontal disease: the sixth complication of diabetes mellitus. Diabetes Care 16: 329-334.
- Nassar H, Kantarci A, Van Dyke TE. 2007. Diabetic periodontitis: a model for activated innate immunity and impaired resolution of Inflammation. Periodontology 2000 43: 233-244.
- Nishimura F, Iwamoto Y, Soga Y. 2007. The periodontal host response with diabetes. Periodontology 2000 43: 245-253.
- Mealey BL. 2006. Periodontal disease and diabetes: A two-way street. J Am Dent Assoc 137 (10 suppl): 26s-31s.
- Roy S, Trudeau K, Roy S, Behl Y, Dhar S, Chronopoulos A. 2010. New insights into hyperglycemia-induced molecular changes in microvascular cells. J Dental Res 89: 116-127.
- Pavez V, Araya V, Rubio A, Ríos L, Meza P, Martínez B. 2002. Estado de salud periodontal en diabéticos tipo 1 de 18 a 30 años de edad, de Santiago de Chile. Rev Med Chile 130: 402-408.
- Galea H, Aganovic I, Aganovic M. 1986. Dental caries and periodontal disease experience of patients with early onset insulin dependent diabetes. Int Dent J 36: 219-224.
- Saremi A, Nelson RG, Tulloch-Reid M, Hanson RL, Sievers ML, Taylor GW, et al. 2005. Periodontal Disease and Mortality in Type 2 Diabetes. Diabetes Care 28: 27-32.
- IDF clinical guidelines task force. 2009. IDF Guideline on oral health for people with diabetes. Brussels: International Diabetes Federation.
- Salvi GE, Collins JG, Yalda B, Arnold RR, Lang NP, Offenbacher S. 1997. Monocitic TNF alpha secretion patterns in IDDM patients with periodontal diseases. J Clin Periodontol 24: 8-16.
- Salvi GE, Yalda B, Collins JG, Jones BH, Smith FW, Arnold RR, et al. 1997. Inflammatory mediator response as a potential risk marker for periodontal diseases in insulin-dependent diabetes mellitus patients. J Clin Periodontol 68: 127-135.
- Offenbacher S, Olde B, Van Dyke T. 1986. The use of crevicular fluid prostanglandin E2 levels as a predictor of periodontal attachment loss. J Periodontol Res 21:101-112.
- Araya AV, Pavez V, Pérez C, González F, Colombo A, Aguirre A, et al. 2003. Ex vivo lipopolysaccharide (LPS)-induced TNF-a, IL-1b, IL-6 and PGE2 secretion in whole blood from type 1 diabetes mellitus patients with or without periodontitis. Eur Cytokine Netw 14: 128-133.
- Lechleitner M, Koch T, Herold M, Dzien A, Hoppichler F. 2000. Tumor necrosis factor-alpha plasma level in patients with type 1 diabetes mellitus and its association with glycaemic control and cardiovascular risk factors. J Intern Med 248: 67-76.
- Duarte PM, De Oliveira MCG, Tambeli CH, Parada CA, Casati MZ, Nociti FH Jr. 2007. Overexpression of interleukin-1b and interleukin-6 may play an important role in periodontal breakdown in type 2 diabetic patients. J Periodont Res 42: 377-381.
- Bridges RB, Anderson JW, Saxe SR, Gregory K, Bridges SR. 1996. Periodontal status of diabetic and non-diabetic men: effects of smoking, glycemic control, and socieconomic factors. J Periodontol 67: 1185-1192.
- Warnakulasuriya S, Dietrich T, Bornstein MM, Casals Peidro E, Preshaw PM, Walter C, et al. 2010. Oral health risks of tobacco use and effects of cessation. Int Dent J 60: 7-30
- Oliver R, Tervonen T. 1994. Diabetes-a risk factor for periodontitis in adults. J Periodontol 65: 530-538.
- Karjalainen KM, Knuuttila ML, Von Dickhoff KJ. 1994. Association of the severity of periodontal disease whith organ complications in type 1 diabetic patients. J Periodontol 65: 1067-1072.
- López N, Quintero A, Llancaqueo M, Jara L. 2009. Efectos del tratamiento periodontal sobre los marcadores de inflamación sistémica en pacientes con riesgo de enfermedad cardíaca coronaria. Estudio piloto. Rev Med Chile 137: 1315-1322.
- Shultis WA, Weil EJ, Looker HC, Curtis JM, Shlossman M, Genco RJ, et al. 2007. Effect of Periodontitis on Overt Nephropathy and End-Stage Renal Disease in Type 2 Diabetes. Diabetes Care 30: 306-311.
- Taylor GW, Burt BA, Becker MP, Gencorj, Shlossman M, Knowler WC, et al. 1996. Severe periodontitis and risk for poor glycemic control in patients with non-insulindependent diabetes mellitus. J Periodontol 67: 1085-1093.
- Grossi SG, Skrepcinski FB, Decaro T, Robertson DC, Ho AW, Dunford RG et al. 1997. Treatment of periodontal disease in diabetics reduces glycated hemoglobin. J Periodontol 68: 713-719.
- Taylor GW, Borgnakke WS. 2008. Periodontal disease: associations with diabetes, glycemic control and complications. Oral Diseases 14: 191-203.
- Darre L, Vergnes JN, Gourdy P, Sixou M. 2008. Efficacy of periodontal treatment on glycaemic control on diabetic patients: A meta-nalysis of interventional studies. Diabetes & Metabolism 34: 497-506.
- Llambes F, Silvestre FJ, Hernandez-Mijares A, Guiha R, Caffesse R. 2008. The effect of periodontal treatment on metabolic control of type 1 diabetes mellitus. Clin Oral Invest 12: 337-343.
- Saito T, Shimazaki Y. 2007. Metabolic disorders related to obesity and periodontal disease. Periodontology 2000 43: 254-266.