Enfermedad de Graves en asociación con Miastenia Gravis: presentación de un caso y revisión de la literatura
Francisco Cordero A., Marcela Barberán M., Alejandra Lanas M. y Claudio Liberman G.
Myasthenia gravis with concomitant hyperthyroidism.
Report of one case
Departamento Endocrinología, Hospital Clínico Universidad de Chile.
Correspondencia:
Dra. Marcela Barberán M.
Servicio de Endocrinología, Hospital Clínico Universidad de Chile.
Av. Santos Dumont #999. Independencia.
Fono: 978-8557
Fax: 978-8088
E-mail: marclaes2001@gmail.com
Recibido: 20 de Junio de 2011
Aceptado: 20 de Julio de 2011
Myasthenia gravis and Graves' disease are autoimmune diseases that can coexist in the same patient. We report a 18 years old female with a history of myasthenia gravis diagnosed at the age of six, treated with neostigmine and prednisone. She starts with palpitations, dyspnea, proximal muscle weakness and exophthalmos appearing seven months after the onset of symptoms. She was admitted to the hospital due to her decompensated hyperthyroidism. After admission, she develops a myasthenic crisis, that requires mechanical ventilation. Afterwards, the patient is subjected to a thymectomy and thyroidectomy with a good postoperative evolution.
Key words: Myasthenia gravis, Graves disease, autoimmune polyendocrine syndromes, myasthenia treatment.
Paciente de 18 años, sexo femenino, con antecedente de miastenia gravis diagnosticada a los 6 años, en tratamiento con Neostigmina 15 mg cuatro veces día y Prednisona 20 mg desde hace 2 años.
Presenta cuadro desde abril de 2008, caracterizado por palpitaciones, disnea de esfuerzo y debilidad muscular proximal leve. ECG muestra signos de sobrecarga ventricular y el ecocardiograma es normal. Posteriormente se agrega xeroftalmia y diplopía, progresivas y en noviembre de 2008 aparece exoftalmo bilateral mayor a izquierda. En enero de 2009 por sospecha hipertiroidismo se solicitan exámenes: TSH: 0,01 uUI/ml (0,4-4,5), T4L: 5,18 ng/dl (0,93-1,6), T3: 4,25 pg/dl (0,78-2,08), PBQ y hemograma normal. La captación I131/24 hrs: 77%.
Con estos resultados se realiza el diagnóstico de enfermedad de Graves y se indica Tiamazol 10 mg que utilizo por dos semanas y Propanolol 20 mg cada 12 horas, el cual mantiene hasta el ingreso. Se indica tratamiento con 18 mCi I131, por lo que ingresa a nuestro centro, donde es evaluada por el equipo de endocrinología. Al examen físico se encuentra una paciente clínicamente hipertiroidea, normotensa, taquicárdica 120 por minuto, regular en reposo, sudorosa, piel caliente y fina, temblor fino de extremidades con disminución de fuerza proximal. Al examen ocular presenta isocoria reactiva, con déficit motor ocular mayor en ojo izquierdo, quemosis, edema palpebral y signos de queratitis bilateral también de predominio izquierdo, con diplopía en mirada extrema. Se palpa tiroides aumentada de tamaño en 1,5- 2 veces, consistencia firme, sin nódulos ni frémito. Dado que la paciente se encontraba con hipertiroidismo no compensado y signos de actividad ocular por su oftalmopatía distiroidea, se decide suspender tratamiento con Radioyodo.
Evaluada por oftalmología se describe oftalmopatía tiroidea GIII con actividad moderada, agudeza visual OD: 20/25, OI: 20/30, exoftalmometría: OD: 22, OI: 25, sin aumento de la tensión ocular. Se indica Prednisona 1,5 mg/kg por 7 días y TAC de órbita muestra signos de oftalmopatía tiroidea sin otras complicaciones. Paralelamente evaluada por neurología, aporta una historia de 3 meses de mayor fatigabilidad y dificultad en deglución. Al examen se encuentra diplopía, imposibilidad de mantener cuello en decúbito, Mingazzini < 20", realiza sólo una sentadilla. Se considera que cursa con Miastenia Gravis descompensada, y se aumenta Neostigmina a 15 mg cinco veces al día. En relación a patología endocrinológica (Tabla 1) se reinicia Tiamazol 10 mg cada 12 horas y se aumenta Propanolol a 40 mg cada 8 horas.
Tabla 1. Período de intervención y evaluación farmacológica
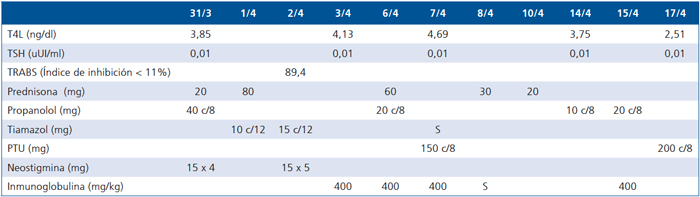
*S: Suspensión del medicamento.
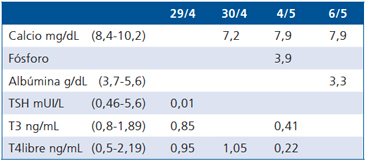
Tabla 2. Evolución Postoperatoria
A los 2 días de ingreso la paciente presenta dificultad respiratoria y desaturación menor a 80% con oxigeno ambiental. Es trasladada a la Unidad de Cuidados Intensivos (UCI) y conectada a ventilación mecánica debido a una crisis miasténica. Se maneja con medidas de soporte, administración de inmunoglobulina y se mantienen corticoides en dosis alta por 7 días, tras descartar patología infecciosa concomitante.
Evoluciona de manera favorable y luego de 5 días es trasladada a Intermedio, ventilando en forma espontánea, recibiendo la última dosis de Inmunoglobulina. En esta unidad presenta una nueva crisis Miasténica manifestada por compromiso respiratorio sin requerimiento de apoyo ventilatorio y debilidad muscular, por lo que se inicia nuevo ciclo de Inmunoglobubilas, presentando buena respuesta al tratamiento. Cuando se logra estabilidad clínica, se trasladada a sala neurología. Es dada de alta en buenas condiciones con PTU 200mg c/8 hr, propanolol 20 mg c/8 hrs, prednisona 40 mg/día, neostigmina 15 mg 5 veces al día (Tabla 1).
El TAC de tórax demostró restos tímicos, por lo que se programa cirugía. Se realiza tiroidectomía total más timectomía por videotoracoscopía, sin incidentes, utilizando atracurio 15 mg con uso de neostigmina en postoperatorio, trasladándose a UCI para monitorización, sin requerimiento de ventilación mecánica, con evolución favorable (Tabla 2). Presentó hipocalcemia de 7,2 mg/dl que se corrige con calcio y vitamina D. Se inicia levotiroxina 100 ug/día. La biopsia concluye timo congestivo con áreas de involución adiposa e hiperplasia tiroidea difusa. Es dada de alta en buenas condiciones en tratamiento con levotiroxina 100 ug, neostigmina 15 mg 5 veces día, prednisona 40 mg/día, calcio 1.500 mg más 1.200 UI de vitamina D día.
Discusión
La Miastenia Gravis es una enfermedad autoinmune, caracterizada por alteración de la transmisión neuromuscular, siendo la más frecuente de este grupo de patologías1. Su patogenia se asocia a autoanticuerpos circulantes contra el receptor de acetilcolina2. Esta patología tiene una incidencia anual de 1 a 2 por 100.000, con prevalencia de 20 a 50 por 100.000 personas, presenta su peak entre la segunda y tercera década, afectando principalmente a mujeres3.
La clínica esta dada por debilidad y fatigabilidad de los músculos con distribución característica, aumenta con la actividad y mejora con el descanso. El diagnóstico está basado en los hallazgos clínicos, junto con estimulación repetitiva nerviosa, y presencia de autoanticuerpos contra el receptor de acetilcolina (AChR) o contra la serina kinasa músculo específica (MuSK). En algunos casos es necesario realizar un test farmacológico. La presencia de anticuerpos anti receptor de ACh se encuentra presente en el 80 a 90% de los pacientes con Miastenia generalizada, a diferencia de los MuSK que están positivos en el 38-50% de los pacientes con anticuerpos anti receptos de ACh negativos2.
En el subtipo de Miastenia con anticuerpos contra MuSK, el curso clínico y la severidad es distinta, presentando una distribución bulbar con atrofia de los músculos respectivos; y el tratamiento estándar puede ser menos efectivo con anormalidades tímicas ausentes o menos pronunciadas.
El timo contiene todos los elementos que son requeridos para iniciar y mantener una respuesta autoinmune contra el receptor de acetilcolina, está profundamente involucrado en la patogénesis de la Miastenia Gravis3. La presentación clínica varía entre compromiso ocular leve a enfermedad generalizada severa. Si ambos tipos se deben considerar como enfermedades distintas es controversial4, por la mayor frecuencia de anticuerpos y enfermedad tímica en la generalizada versus la ocular.
En el hipertiroidismo, un 60-80% de los pacientes presentan debilidad muscular, principalmente después de los 40 años y no es la principal manifestación. La probabilidad de desarrollar miopatía se correlaciona con la duración del hipertiroidismo. Existe una forma aguda de miopatía con debilidad muscular proximal y distal y rara vez con compromiso bulbar y respiratorio pero que debe hacernos descartar una miastenia concomitante. El tratamiento del hipertiroidismo es suficiente para tratar la miopatía5,6.
Los trastornos tiroideos ocurren en pacientes con Miastenia Gravis, y pueden presentarse como hipertiroidismo, hipotiroidismo, bocio no toxico, tiroiditis de Hashimoto y estado eutiroídeo con anticuerpos antitiroideos positivos7. La asociación de enfermedad de Graves con Miastenia fue descrita por primera vez en 19088,9. Ambas están mediadas por anticuerpos contra receptores de membrana, anti TSH R y anti ACh R.
La prevalencia de hipertiroidismo en Miastenia Gravis varía según distintas serias, mostrando que el hipertiroidismo en pacientes con Miastenia Gravis es mayor que en la población general10. La enfermedad de Graves se desarrolla en 5% de pacientes con Miastenia y ésta se desarrolla en 0,2% de pacientes con Graves11, otras series reportan que un 17,5% de pacientes con Miastenia pueden tener hipertiroidismo8,10.
Un estudio evidenció que los pacientes con Miastenia y enfermedad tiroidea autoinmune, tienen una expresión clínica leve, con compromiso ocular preferencial, baja frecuencia de enfermedad tímica y de anticuerpos anti receptores de acetilcolina, esto apoyaría que la enfermedad ocular y generalizada son distintas, con diferentes enfermedades asociadas4.
La relación entre estas enfermedades se encuentra descrita en los Síndromes pluriglandulares autoinmunes (SPA), que se caracterizan por compromiso variable de órganos endocrinos asociados a otras patologías autoinmunes en tejidos no endocrinos, existiendo presentaciones y clasificaciones diversas, estando establecido que pacientes con miastenia pueden coexistir con patología tiroidea autoinmune.
Los SPA difieren según su prevalencia, tiempo de inicio, herencia, función inmune y enfermedades asociadas. El SPA tipo II se caracteriza por ser más frecuente que el tipo I, con edad de inicio más tardía, generalmente en adultos, herencia poligénica, sin presencia de inmunodeficiencia, y se da por la asociación de Enfermedad de Addison, Diabetes Mellitus tipo 1 y tiroiditis crónica. Existen 2 posturas frente al tipo II, existiendo los "Splitters", quienes consideran distintas combinaciones como síndromes separados:
Tipo II: Addison + tiroides o DM1
Tipo III: Tiroides + otra distinta
Tipo IV: dos o más órgano-específico distintos y los "Lumpers", que agrupan todas éstas combinaciones dentro del tipo II9,12. La asociación de enfermedad de Graves más Miastenia se ve en los SPA tipo III, que es subdividido por algunos autores. Dentro de este grupo, el IIIC incluiría enfermedad de Graves más otro trastorno autoinmune como vitíligo, alopecia, Miastenia Gravis y/o Esclerosis Múltiple13.
El clínico se puede ver enfrentado a un desafío médico frente a la asociación de Miastenia Gravis e hipertiroidismo por enfermedad de Graves, ya que la clínica puede confundirse y la debilidad muscular se puede presentar como síntoma de inicio en ambas14.
A su vez, esta asociación es relevante por las consideraciones terapéuticas. Los corticoides usados para tratar el exoftalmo y las crisis miasténicas pueden empeorar paradojalmente la miastenia15. Más de 10% de pacientes con miastenia muestran un empeoramiento de la debilidad muscular transitorio al inicio de la terapia corticoidal3. Además se debe considerar que los fármacos para tratar el hipertiroidismo, como propanolol y antitiroídeos pueden desencadenar una crisis miasténica16,17.
En la presente revisión se analiza la relación que existe entre Miastenia Gravis e hipertiroidismo, como asociación de enfermedad autoinmune. Es importante tener presente los elementos que pueden descompensar dichas patologías y la interferencia que los tratamientos pueden tener en las mismas.
Referencias
- Bird SJ. 2006. Official reprint from UpToDate® www. uptodate. com.
- Drachman DB. 1994. Medical progress: myasthenia gravis. New England Journal of Medicine 330: 1797-1810.
- Gold R, Schneider-Gold C. 2008. Current and future standards in treatment of myasthenia gravis. Neurotherapeutics 5: 535-541.
- Marino M, Ricciardi R, Pinchera A, Barbesino G, Manetti L, Chiovato L, Braverman LE, Rossi B, Muratorio A, Mariotti S. 1997. Mild clinical expression of myasthenia gravis associated with autoimmune thyroid diseases. Journal of Clinical Endocrinology & Metabolism 82: 438.
- Duyff RF, Van den Bosch J, Laman DM, van Loon BJP, Linssen WHJP. 2000. Neuromuscular findings in thyroid dysfunction: a prospective clinical and electrodiagnostic study. Journal of Neurology, Neurosurgery & Psychiatry 68: 750-755.
- Lleo A, Sanahuja J, Serrano C, Rojas R, Illa I. 1999. Acute bulbar weakness: Thyrotoxicosis or myasthenia gravis? Annals of neurology 46: 434-435.
- Kiessling WR, Pflughaupt KW, Ricker K, Haubitz I, Mertens HG. 1981. Thyroid function and circulating antithyroid antibodies in myasthenia gravis. Neurology 31: 771.
- Sahay BM, Blendis LM, Greene R. 1965. Relation between myasthenia gravis and thyroid disease. British medical journal 1: 762-765.
- Rennie GE. 1908. Exophthalmic goitre combined with myasthenia gravis. Rev Neurol Psychiatry 6: 229-233.
- Ratanakorn D, Vejjajiva A. 2002. Long term follow up of myasthenia gravis patients with hyperthyroidism. Acta neurologica scandinavica 106: 93-98.
- Peacey SR, Belchetz PE. 1993. Graves' disease: associated ocular myasthenia gravis and a thymic cyst. Journal of the Royal Society of Medicine 86: 297-298.
- Eisenbarth GS, Gottlieb PA. 2004. Autoimmune polyendocrine syndromes. Immunology of type 1 diabetes 552: 198-204.
- Betterle C, Dal Pra C, Mantero F, Zanchetta R. 2002. Autoimmune adrenal insufficiency and autoimmune polyendocrine syndromes: autoantibodies, autoantigens, and their applicability in diagnosis and disease prediction. Endocrine Reviews 23: 327.
- Tanwani MLK, Lohano MV, Ewart MDPR, Broadstone MVL, Mokshagundam MSPL. 2001. Myasthenia gravis in conjunction with graves'disease: a diagnostic challenge. Endocrine Practice 7: 275-278.
- Thanvi BR, Lo TCN. 2004. Update on myasthenia gravis. Postgraduate medical journal 80: 690.
- Kuroda Y, Endo C, Neshige R, Kakigi R. 1991. Exacerbation of myasthenia gravis shortly after administration of methimazole for hyperthyroidism. Japanese journal of medicine 30: 578.
- Adams SL, Mathews J, Grammer LC. 1984. Drugs that may exacerbate myasthenia gravis. Annals of Emergency Medicine 13: 532-538.