Diagnóstico por imágenes de las glándulas suprarrenales
Francisco Cruz O.1, Claudia Otárola U.2 y Alvaro Huete G.3
Diagnostic imaging of the adrenal glands
Departamento de Radiología, Facultad de Medicina, Pontificia Universidad Católica de Chile.
1Profesor Asociado, Jefe de Departamento.
3Profesor Asociado, Jefe de Sección Imágenes de Cuerpo.
2Fellow Imágenes de Cuerpo.
Correspondencia a:
fcruzo@uc.cl
Recibido: 30 de Agosto de 2011
Aceptado: 01 de Septiembre de 2011
1. Introducción.
2. La glándula suprarrenal normal.
3. Causas y prevalencia de lesiones suprarrenales.
4. Técnicas de imágenes actuales y su utilidad en el diagnóstico de enfermedad benigna y maligna.
- Características morfológicas.
- Técnicas sensibles a contenido lipídico intracelular.
- Comportamiento de la lesión con el uso de medio de contraste endovenoso.
- Evaluación de la actividad metabólica de la lesión mediante PET.
5. Lesiones suprarrenales frecuentes y su caracterización.
- Adenomas.
- Metástasis.
- Carcinoma adrenocortical.
- Mielolipoma.
- Linfoma.
- Tumores de colisión.
- Neuroblastoma.
- Lesiones quísticas.
- Hemorragia.
- Infección granulomatosa.
1. Introducción
Las glándulas suprarrenales son sitio frecuente de lesiones asintomáticas, que son un hallazgo en exámenes imagenológicos solicitados por otro motivo. Se les denomina "incidentalomas" y suelen ser benignos. Se ha comunicado aproximadamente un 9% de alteraciones suprarrenales en la población general, siendo las neoplasias la patología más frecuente, principalmente adenomas y metástasis1.
En pacientes con síntomas de hiperfunción suprarrenal, las imágenes se utilizan fundamentalmente para buscar su localización y posible etiología.
En la actualidad existen múltiples técnicas de diagnostico por imágenes que permiten una adecuada evaluación de las lesiones que afectan a este órgano, siendo considerable el progreso que han mostrado durante las ultimas décadas la tomografía computarizada (TC), la resonancia magnética (RM) y la tomografía por emisión de positrones (PET), las que juegan un rol fundamental en la caracterización de lesiones suprarrenales para poder predecir si se trata de una lesión benigna o una lesión maligna, lo que se logra en la gran mayoría de los casos.
El objetivo del presente artículo es describir las características de una glándula suprarrenal normal y mostrar las principales técnicas de imágenes disponibles, basándose en los conocimientos anatómicos y fisiológicos que permiten la diferenciación de cada una de las lesiones que la afectan. Además se ilustran las entidades patológicas mas frecuentes, con sus características particulares en TC, RM y PET.
2. La glándula suprarrenal normal
La glándula suprarrenal se localiza en el espacio perirrenal, contenido por la fascia de Gerota, su morfología remeda una Y o V invertida y se compone de un cuerpo y dos astas (medial y lateral), las que son de márgenes cóncavos o rectos. El espesor del cuerpo mide aproximadamente 10 mm y las astas no superan los 5 mm, siendo la longitud total de la glándula menor a 4 cm en el eje céfalo caudal. En pacientes con agenesia renal las glándulas suprarrenales adoptan una morfología discoidea, y aparecen como una imagen lineal adyacente a las estructuras paraespinales.
Microscópicamente, la corteza suprarrenal normal esta compuesta de tres capas, la zona glomerulosa, la zona fasciculata y la zona reticularis, las que producen mineralocorticoides (principalmente aldosterona), glucorticoides y andrógenos, respectivamente. La médula suprarrenal no se distingue de la corteza por imágenes2 y es responsable de la secreción de adrenalina y noradrenalina.
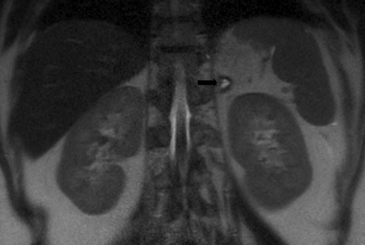
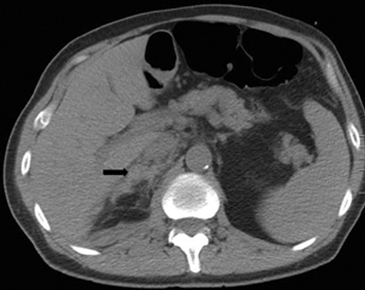
En la TC no contrastada las glándulas suprarrenales normales son homogéneas y simétricas, con una densidad muy similar a la del parénquima renal adyacente (Figura 1 a). Con un medio de contraste ev la glándula suprarrenal se opacifica en forma homogénea, similar al hígado o al bazo (Figura 1 b). Si la cantidad de tejido adiposo retroperitoneal es abundante las glándulas suprarrenales pueden aparecer enteramente rodeadas por grasa y su delimitación es más fácil (Figura 2 a); lo inverso ocurre en pacientes muy delgados con escasa grasa retroperitoneal (Figura 2 b). En RM, en secuencias ponderadas en T1 y T2 convencionales tienen una intensidad de señal homogénea, hipointensa respecto de la grasa adyacente e iso o hipointensa con respecto del parénquima hepático (Figura 3 a y b). En los cortes coronales se aprecia mejor la forma y la posición de las glándulas suprarrenales (Figura 3 c).
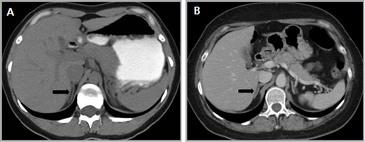 Figura 1. Glándula suprarrenal normal en tomografía computada. Cortes axiales de tomografía computada, donde se identifica la morfología normal de la glándula suprarrenal derecha (flecha) en fase no contrastada (a), y tras el uso de medio de contraste endovenoso (b).
Figura 1. Glándula suprarrenal normal en tomografía computada. Cortes axiales de tomografía computada, donde se identifica la morfología normal de la glándula suprarrenal derecha (flecha) en fase no contrastada (a), y tras el uso de medio de contraste endovenoso (b).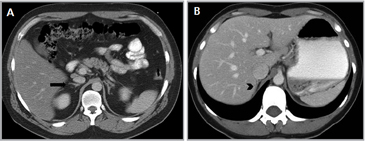
Figura 2. Cortes axiales de tomografía computada con uso de medio de contraste en un paciente con abundante grasa retroperitoneal (a), donde es fácil definir los contornos de la glándula suprarrenal (flecha), a diferencia de un paciente con escaso tejido adiposo retroperitoneal (b) en donde la glándula suprarrenal se encuentra en íntimo contacto los órganos adyacentes (cabeza de flecha).
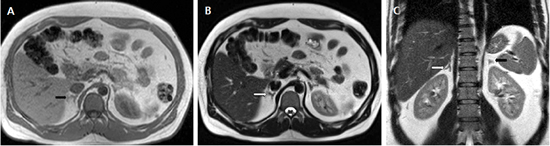 Figura 3. Glándula suprarrenal normal en resonancia magnética. (a) Cortes axial ponderado en T1 la señal de la glándula normal (flecha negra) es hipointensa respecto a la grasa retroperitoneal e isointensa respecto al parénquima hepático. (b) Cortes axial ponderado en T2 en que se muestra la glándula suprarrenal derecha (flecha blanca) y (c) corte coronal ponderado en T2 en que se muestra la glándula suprarrenal derecha (flecha blanca) y la glándula suprarrenal izquierda (flecha negra) con similares características de intendidad de señal.
Figura 3. Glándula suprarrenal normal en resonancia magnética. (a) Cortes axial ponderado en T1 la señal de la glándula normal (flecha negra) es hipointensa respecto a la grasa retroperitoneal e isointensa respecto al parénquima hepático. (b) Cortes axial ponderado en T2 en que se muestra la glándula suprarrenal derecha (flecha blanca) y (c) corte coronal ponderado en T2 en que se muestra la glándula suprarrenal derecha (flecha blanca) y la glándula suprarrenal izquierda (flecha negra) con similares características de intendidad de señal. 3. Causas y prevalencia de las lesiones suprarrenales
La patología de la glándula suprarrenal puede dividirse en neoplasias, hemorragia, quistes, infecciones y aumento de tamaño determinado por estimulación hormonal externa (hiperplasia). Las lesiones tumorales pueden agruparse a su vez como funcionantes o no funcionantes, primarias o metastásicas, benignas o malignas.
En cuanto a la etiología de las lesiones suprarrenales en la población general, las cifras promedio que se han reportado en varias series se distribuyen aproximadamente de la siguiente manera: 41% correspondería a adenomas, 10% a metástasis, 10% carcinoma adrenocortical, 9% mielolipomas, 8% feocromocitomas, y otras lesiones tales como linfoma, quistes, hemorragia, ganglioneuromas, hemangiomas y enfermedad granulomatosa darían cuenta del porcentaje restante3.
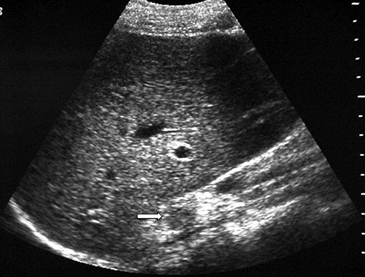
Las masas suprarrenales son un hallazgo frecuente en la población general, con una prevalencia que varía entre un 1a un 8,7% en grandes series de autopsias. Los incidentalomas se describen en aproximadamente un 4-6% de la población (Figura 4 a y b), y su prevalencia aumenta con la edad, siendo de 0,2% en pacientes entre 20 a 29 años, y de 7 a 10% en pacientes de mayor edad4. Se observan también con mayor frecuencia en pacientes obesos y diabéticos, especialmente de sexo femenino.
 A
A 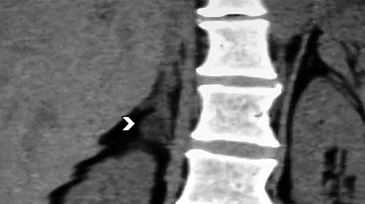 B
BFigura 4. Incidentaloma suprarrenal. Imagen de ultrasonido en región suprarrenal derecha, donde se demuestra una lesión nodular hipoecogéncia (flecha), de carácter inespecífico (a). Reformateo coronal de tomografía computada (b), demostrando una lesión hipodensa y homogénea (cabeza de flecha), con los caracteres de un adenoma típico.
La mayoría de estas lesiones, hasta un 98% de los casos, resultan benignas en el contexto de pacientes sin historia conocida de neoplasia maligna. De modo contrario, si existe el antecedente de una neoplasia maligna extraadrenal la probabilidad de que un incidentaloma suprarrenal corresponda a una localización secundaria aumenta significativamente. Hasta un 27% de los pacientes oncológicos tienen metástasis suprarrenales microscópicas y aproximadamente un 50% de las lesiones suprarrenales pesquisadas de manera incidental en este tipo de pacientes representan enfermedad metastásica4.
4. Técnicas de imágenes actuales y su utilidad en el diagnóstico de enfermedad benigna y maligna
La aproximación inicial en la caracterización de una lesión suprarrenal debe intentar determinar fundamentalmente si es benigna o maligna. Es importante contar con antecedentes clínicos que indiquen la presencia de una lesión funcionante o no funcionante. Las lesiones hiperfuncionantes, principalmente feocromocitomas y aldosteronomas, se diagnostican en un contexto clínico determinado y mediante análisis bioquímicos específicos. En relación a la determinación de la benignidad o malignidad de una masa suprarrenal se han desarrollado múltiples técnicas, principalmente TC, RM y PET, que además de basarse en fundamentos morfológicos clásicos apoyan esta discriminación en tres principios fisiológicos: a) la presencia de lípidos intracelulares; b) el comportamiento de la lesión con el uso de medio de contraste endovenoso y c) la actividad metabólica de la masa.
a) Características morfológicas
Existen múltiples características morfológicas, que si bien presentan menor especificidad que otros hallazgos, ayudan a orientar la etiología de una lesión suprarrenal:
a) Tamaño.
b) Márgenes.
c) Morfología.
d) Estabilidad en el tiempo.
e) Crecimiento acelerado.
f) Densidad y homogeneidad de la lesión.
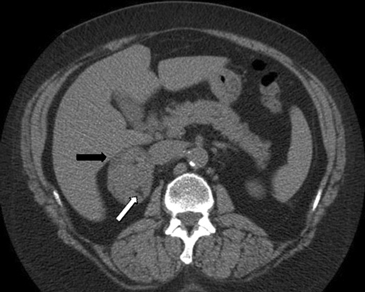
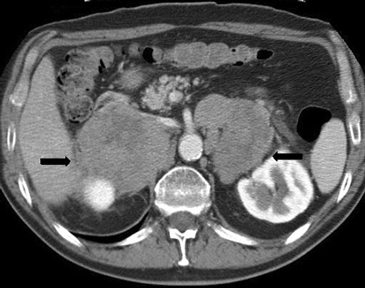
A mayor tamaño de la masa (macrotumor suprarrenal) existe una mayor probabilidad de malignidad; si el tamaño de la lesión supera los 4 cm se ha reportado un 70% de malignidad, e incluso este porcentaje asciende a un 85% en lesiones mayores a 6 cm. Algunas excepciones usuales a esta regla son los mielolipomas, los cuales se reconocen fácilmente por la presencia de tejido adiposo macroscópico (Figura 5 a), y los feocromocitomas benignos (Figura 5 b), que pueden alcanzar un gran tamaño antes de manifestarse clínicamente con el cuadro de hipertensión característico3,5.
 A
A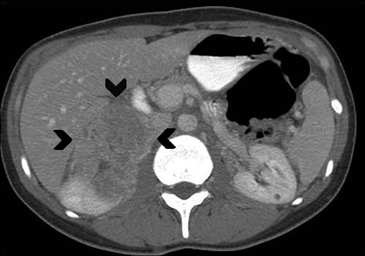 B
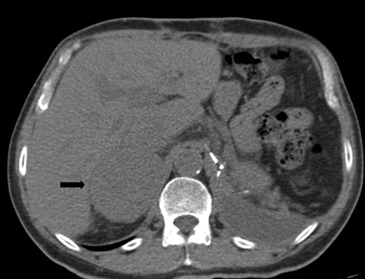
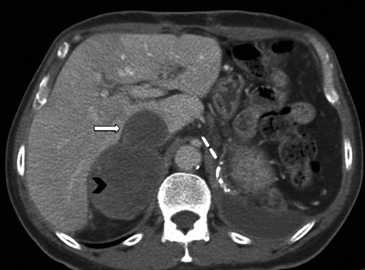
BLos márgenes de la lesión pueden ser una característica útil, los contornos irregulares se asocian a una mayor probabilidad de malignidad. Sin embargo, las metástasis, especialmente si son pequeñas, pueden presentar una morfología muy similar a la de un adenoma (Figura 6), vale decir homogéneas y de bordes bien delimitados. Se ha descrito también que la preservación de la morfología adreniforme usualmente se asocia a benignidad (Figura 7 a y b).
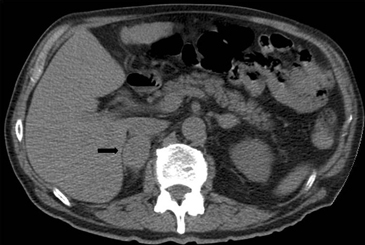 Figura 6. Lesión homogénea, de contornos bien delimitados (flecha) visualizada en tomografía computada sin contraste realizada en contexto de estudio de diseminación de cáncer mamario. A pesar de los caracteres morfológicos aparentemente benignos, se demostró que la lesión correspondía a una localización secundaria.
Figura 6. Lesión homogénea, de contornos bien delimitados (flecha) visualizada en tomografía computada sin contraste realizada en contexto de estudio de diseminación de cáncer mamario. A pesar de los caracteres morfológicos aparentemente benignos, se demostró que la lesión correspondía a una localización secundaria.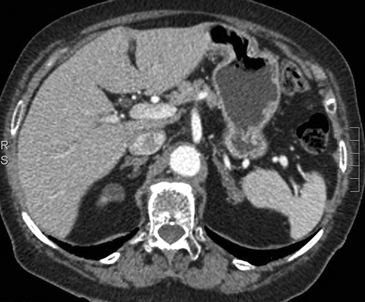 A
A
 B
B
La estabilidad de la lesión a lo largo del tiempo también es consistente con una etiología benigna, de modo contrario, si se determina crecimiento significativo de la masa en un periodo de 6 meses debe considerarse como maligna. Es conveniente insistir en investigar si el paciente ha tenido estudios previos, los que pueden ser muy útiles al momento de evaluar una lesión.
Cabe recordar que algunas lesiones benignas, tales como adenomas o mielolipomas, pueden aumentar de tamaño sustancialmente como consecuencia de una hemorragia intralesional, aunque esto es infrecuente.
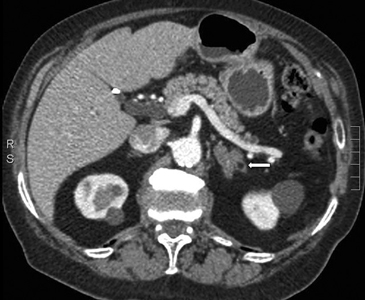
Tanto las lesiones benignas como malignas pueden presentar una atenuación heterogénea, especialmente en fases contrastadas, pero la presencia de grandes focos necróticos son mas bien orientadores de malignidad (Figura 8 a y b).
 A
A
 B
B
b) Técnicas sensibles a contenido lipídico intracelular
Como ya se mencionó previamente, dado que la gran mayoría de las lesiones suprarrenales corresponden a adenomas, y un 70% de ellos contienen lípidos intracelulares (principalmente colesterol y ácidos grasos), la detección de éste componente, ya sea mediante TC o RM es un hallazgo muy útil para distinguir este tipo de lesiones de otras malignas como las metástasis.
La presencia de lípidos intracelulares disminuye la densidad de la lesión debido a que estos son menos densos que el agua. El primer estudio en reportar la utilidad de la densitometría por TC en la diferenciación de una lesión suprarrenal benigna de una maligna fue el realizado por Lee et al6, utilizando la medición del coeficiente de atenuación o densidad de la lesión expresada en unidades Hounsfield (UH), en una TC no contrastada, demostrando que el coeficiente de atenuación promedio de los adenomas (2,2 UH) fue significativamente menor que la de las lesiones no adenomas (28,9 UH). Utilizando un punto de corte de 0 UH la sensibilidad de la TC no contrastada en la caracterización de un adenoma es cercana a un 47%, con una especificidad de aproximadamente 100% (Figura 9 a y b). Sin embargo, estudios posteriores7 han corroborado que al utilizar un punto de corte de 10 UH, la sensibilidad asciende a un 71%, y la especificidad se mantiene en prácticamente 98%, por lo que este umbral de densidad es el más utilizado en la actualidad. Es importante enfatizar que para una adecuada medición de la densidad, la región de interés (ROI) no debe incluir áreas de necrosis ni de hemorragia, y debe abarcar al menos la mitad o dos tercios de la lesión, para evitar el artefacto por ruido y el efecto de volumen parcial con el tejido adiposo adyacente (Figura 10).
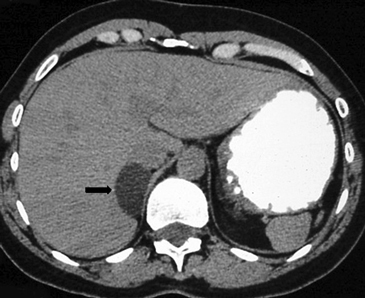 A
A 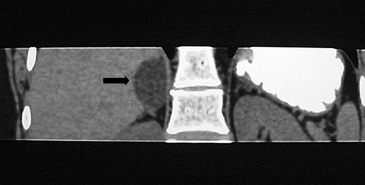 B
B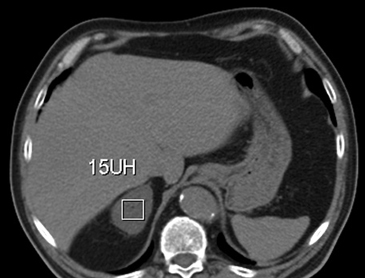 Figura 10. Adenoma suprarrenal derecho. Lesión suprarrenal derecha, cuya densidad es consistente con un adenoma típico. En la imagen se demuestra una adecuada medición de la densidad lesional, con una región de interés (ROI) que abarca al menos dos tercios de ésta.
Figura 10. Adenoma suprarrenal derecho. Lesión suprarrenal derecha, cuya densidad es consistente con un adenoma típico. En la imagen se demuestra una adecuada medición de la densidad lesional, con una región de interés (ROI) que abarca al menos dos tercios de ésta. 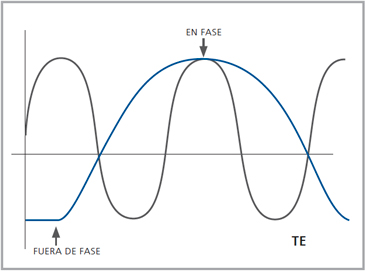 Figura 11. En el diagrama se grafican las distintas frecuencias de resonancia de los protones de agua (en azul) y grasa (en rojo). Dependiendo del tiempo de eco (TE) ambas señales pueden sumarse ("en fase") o restarse ("fuera de fase").
Figura 11. En el diagrama se grafican las distintas frecuencias de resonancia de los protones de agua (en azul) y grasa (en rojo). Dependiendo del tiempo de eco (TE) ambas señales pueden sumarse ("en fase") o restarse ("fuera de fase").
En RM el contenido lipídico intracitoplasmático puede determinarse mediante la técnica de "chemical shift", siendo éste el método más sensible para diferenciar los adenomas ricos en lípidos de las metástasis que no contienen lípidos. Esta técnica se basa en la distinta frecuencia de resonancia que tienen los protones ubicados en las moléculas de agua que los ubicados en moléculas lipídicas; el ambiente químico de un protón de agua es diferente al de un protón en lípidos dado la proximidad de sus electrones con los átomos de oxígeno e hidrógeno. Los protones de grasa están más cubiertos por electrones que los protones de agua, por lo que estarían menos expuestos a un campo magnético externo, lo que determina una menor frecuencia de resonancia. Esta diferencia en la frecuencia de resonancia que se produce hace que en tiempo predeterminado (en milisegundos) los protones de agua y de grasa estén en la misma fase y su señal se suma, y en otro tiempo predeterminado estos se encuentran en una fase opuesta y su señal se resta (Figura 11).
Este principio físico explicaría la cancelación de la señal cuando los protones de agua y lípido se encuentran en un mismo volumen (voxel, abreviación de volumen element) en la matriz de la imagen; por lo tanto los tejidos que contienen ambos elementos en proporciones similares (agua y grasa microscópica) presentan caída de su señal en secuencia fuera de fase, a diferencia de la secuencia en fase cuando ambas señales se suman (Figura 12 a y b).
 A
A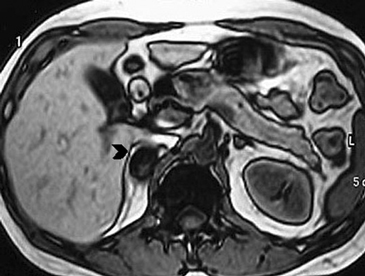 B
B
La secuencia gradiente fuera de fase se reconoce porque existe pérdida de señal en la periferia de los órganos en donde contactan con el tejido adiposo, produciéndose un halo negro que rodea a los órganos como si estuvieran dibujados con "tinta china", lo que es evidente en las glándulas suprarrenales, debido a que están inmersas en tejido adiposo y es esa interfase entre la glándula y el tejido adiposo que la rodea que produce este artefacto de cancelación (Figura 13).
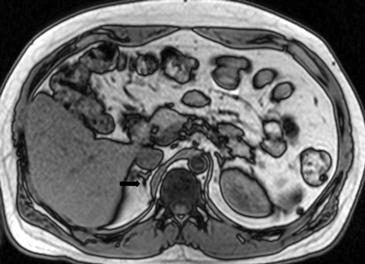 Figura 13. Glándula suprarrenal derecha normal. Corte axial de RM ponderada en T1 "fuera de fase", donde se demuestra un halo hipointenso en el margen de la glándula suprarrenal, el característico artefacto en "tinta china".
Figura 13. Glándula suprarrenal derecha normal. Corte axial de RM ponderada en T1 "fuera de fase", donde se demuestra un halo hipointenso en el margen de la glándula suprarrenal, el característico artefacto en "tinta china". Se ha estimado que existiría una relación lineal inversa entre la caída de señal y el contenido lipídico intracitoplasmático. Sin embargo la intensidad de la caída de señal también depende de la relación grasa-líquido dentro del voxel, puesto que en un voxel que sólo contenga grasa (como en el caso de los mielolipomas que sólo tienen grasa macroscópica) no se demostraría caída de señal en secuencia fuera de fase pues no existen protones de agua que cancelen la señal. Sin embargo hay que señalar que existen adenomas pobres en lípidos y estos muestran un comportamiento similar al de una lesión partes blandas de manera que hay escasa caída de señal en secuencia fuera de fase, por lo que no es posible su diferenciación con esta técnica.
La caída de la señal puede determinarse de manera cuantitativa; una de ellas es mediante la relación en la caída de señal suprarrenal/bazo, que se calcula dividiendo la intensidad de señal de la lesión con la intensidad de la señal en el bazo en secuencia en fase y luego este valor dividirlo por la misma relación en la secuencia fuera de fase. Si el valor obtenido es menor a 0,71 es diagnóstico de un adenoma rico en lípidos. Sin embargo, en la práctica habitual la determinación de caída de señal se evalúa de manera cualitativa, utilizando un órgano de referencia interna como el bazo o el músculo. La certeza reportada de este método es de aproximadamente un 96 a 100%8.
c) Comportamiento de la lesión con el uso de medio de contraste endovenoso
Luego de la administración de contraste endovenoso los adenomas aumentan su densidad debido a que son vascularizados, lo que se puede objetivar midiendo directamente el valor de atenuación en UH, pero tiene una particularidad en que, el lavado de contraste es más rápido que el de las lesiones no adenomas incluidas las malignas. Las lesiones malignas tienen una red capilar de mayor densidad, con flujo más lento, y los capilares de neoformación son más porosos, por lo que el medio de contraste difunde con facilidad al espacio extravascular. Así, el medio contraste tiende a acumularse en el tejido y a lavarse lentamente, a diferencia de lesiones benignas en que el lavado contraste es rápido porque al estar la red capilar intacta el medio de contraste se queda intravascular. Dado que el valor de atenuación absoluto depende de la dosis de contraste, flujo y gasto cardiaco entre otros factores, se ha considerado de mayor utilidad realizar una comparación relativa porcentual, comparando la densidad de la lesión en la fase contrastada con la densidad de la lesión en fase tardía y así estimar el lavado de la lesión. Muchos exámenes de TAC abdominal en que no se sospecha una lesión suprarrenal, se realizan con medio de contaste ev sin contar con una fase no contrastada, por lo que no se dispone del valor de atenuación original de la lesión. En estos casos si se detecta una lesión suprarrenal incidental, se obtiene una fase tardía a los 15 minutos después de la administración del contraste ev para poder estimar el porcentaje de lavado en la lesión. Si se dispone del valor de atenuación en fase no contrastada se puede calcular el porcentaje de lavado absoluto y si solo se dispone de fase contrastada se calcula el porcentaje de lavado relativo (Tabla 1).
Tabla 1. Comportamiento de la lesión con el uso y medio de contraste endovenoso
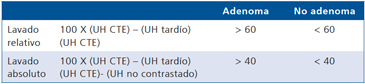
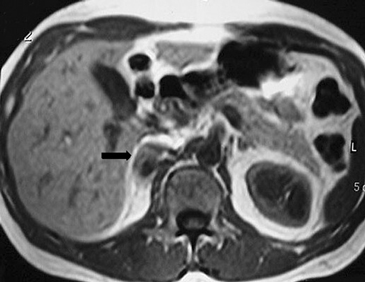
Los valores más utilizados son un 40% de lavado relativo de en fase tardía realizada a los 15 minutos y un lavado absoluto de 60%. De este modo cualquier lesión que muestre un lavado relativo mayor al 40% o absoluto mayor al 60% es consistente con un adenoma, con una sensibilidad y especificidad cercana al 100% (Figura 14 a, b y c). Dado la rapidez con que se obtiene un TAC de abdomen en la actualidad, algunos trabajos han recomendado utilizar cortes tardíos realizados a los 10 minutos, con el fin de optimizar el tiempo de examen, y utilizar un valor relativo de corte más conservador del 50%9.
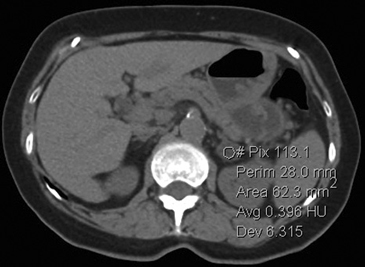 A
A 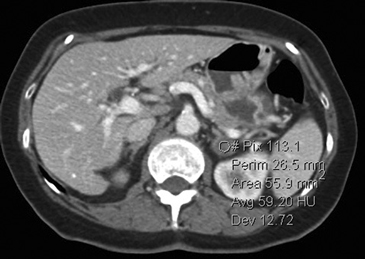 B
B 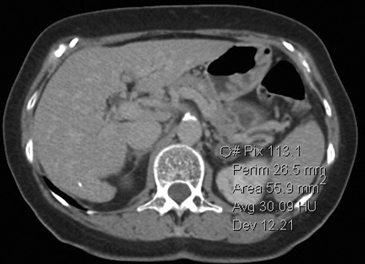 C
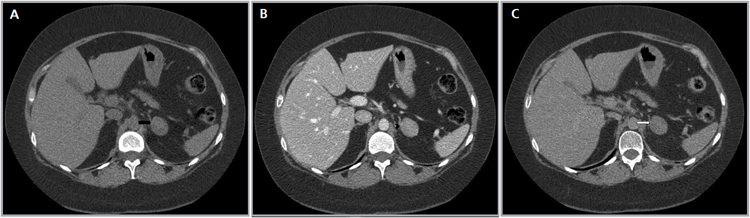
C Figura 14. Tomografía computada de un adenoma suprarrenal izquierdo típico. Se ha colocado un circulo que representa la región de interés en la lesión de la glándula suprarrenal izquierda, obteniendo una medición promedio (Avg) expresada en unidades Hounsfield (UH). En fase precontraste (a) su densidad es de 0 UH, (flecha), en fase protovenosa (b) alcanza una densidad de 59 UH (cabeza de flecha), y en fase tardía (c) su lavado es de aproximadamente un 50%, llegando a una densidad de 30 UH.
d) Evaluación de la actividad metabólica de la lesión mediante PET
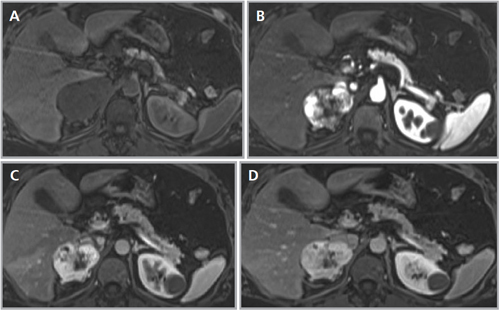
La gran mayoría de las lesiones malignas de la glándula suprarrenal presentan aumento en la captación del FDG (análogo de la glucosa) dado su mayor metabolismo glucídico; de modo contrario las masas benignas, no inflamatorias, no muestran captación significativa de este radiotrazador, como es el caso de los adenomas (Figura 15 a, b, c y d). Algunos estudios recientes reportan que el PET con FDG tiene una sensibilidad cercana al 100% y especificidad de aproximadamente un 80 a 100% en la diferenciación de lesiones benignas y malignas. La presencia de necrosis o hemorragia en una lesión maligna suprarrenal puede resultar en un falso negativo, así como también existe una baja sensibilidad en lesiones menores a 1 cm. En relación a los falsos positivos se ha reportado que un 5% de los adenomas y las lesiones de carácter inflamatorio-infeccioso pueden presentar leve captación del FDG.
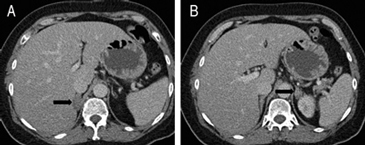
El uso del PET incluido en un equipo de TC (PET-CT) ofrece claras ventajas con respecto al uso del PET en forma aislada, puesto que permite una mejor localización anatómica de las alteraciones metabólicas observadas, así como también puede incorporar la densitometría y las características de lavado ya descritas para la TC, lo que haría que tres de las técnicas más efectivas en la caracterización de las lesiones suprarrenales puedan combinarse en un solo estudio; bajo estas condiciones la sensibilidad y especificidad serían cercanas al 100%.
Otros radioisótopos utilizados en la caracterización de las lesiones suprarrenales son el NP-59 yodometilnorcolesterol y la metayodobenzilguanidina (MIBG). El primero tendría un alto valor predictivo positivo en el diagnóstico de adenomas, pero no se utiliza en la práctica clínica rutinaria.
El MIBG presta utilidad en la evaluación de los feocromocitomas, especialmente en los casos metastásicos o extraadrenales.
e) Biopsia percutánea guiada por TAC
En la actualidad su uso es excepcional y su indicación esta reservada para casos en que las técnicas no invasivas no son diagnosticas y en casos en que se sospecha un linfoma y es necesario tipificarlo. En el lado derecho si la masa es pequeña se prefiere el abordaje transhepático (Figura 16 a) y en el lado izquierdo la vía dorsal posterior (Figura 16 b).
La vía transhepática sólo se realiza con aguja fina, de manera que si en el lado derecho es necesario obtener mayor cantidad de tejido, la biopsia se realiza con una aguja de tipo trucut pero el acceso tiene que ser por vía dorsal posterior.
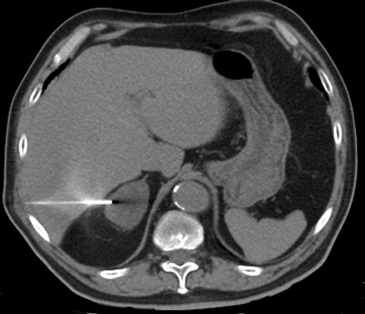 A
A 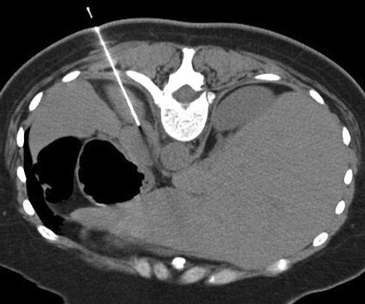 B
B
5. Lesiones suprarrenales frecuentes y su caracterización
a) Adenomas
Los adenomas corresponden a la lesión suprarrenal más frecuente y usualmente son lesiones no funcionantes. Los adenomas hiperfuncionantes (a pesar de su baja frecuencia) son responsables de desórdenes endocrinos relevantes; corresponden a un 80% de los casos de hiperaldosteronismo (síndrome de Conn) y a un 20% de los casos de síndrome de Cushing. La presencia de atrofia de la glándula contralateral sugiere una lesión hiperfuncionante, dado que la secreción de ACTH se suprime al elevarse los niveles de cortisol.
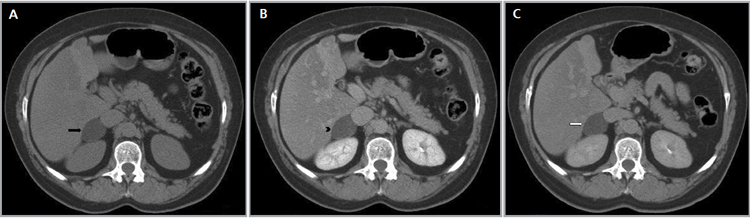
El diámetro promedio de estas lesiones alcanza los 2 a 2,5 cm. En TC sus características más habituales son los márgenes bien definidos y una atenuación homogénea. Tal y como se mencionó previamente la característica fundamental de los adenomas es la presencia de lípido intracelular, sin embargo, entre un 10 a 40% de ellos son pobres en lípidos. Los valores de atenuación precontraste dependen por tanto de su contenido lipídico, con valores promedio de entre -2 y 16 UH en lesiones ricas en lípidos (Figura 17 a, b y c) y valores de atenuación mayores en las lesiones pobres en lípidos (Figura 18 a, b y c). Según lo descrito por Caoili et al10, independiente del contenido lipídico, los adenomas en TC demuestran lavado rápido tras el uso de contraste endovenoso , definido como un porcentaje de lavado absoluto en cortes tardíos mayor a un 60% o un lavado relativo mayor a 40%.
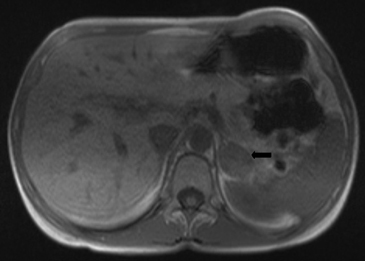
En RM estas lesiones aparecen homogéneas en todas las secuencias. Su refuerzo con el uso de contraste es leve, tienen igual o menor señal que el hígado en secuencias T2 y pueden tener una menor intensidad de señal que el resto de la glándula suprarrenal. La técnica de "chemical shift" es altamente confiable en el diagnóstico de los adenomas al demostrar caída de señal en secuencia fuera de fase por la presencia de lípido intracelular (Figura 19 a y b).
 A
A 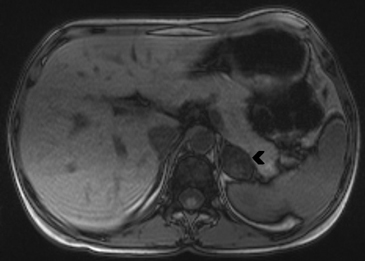 B
B
Se ha reportado que una caída de señal mayor a un 20% sería diagnóstico de estas lesiones. De manera poco frecuente los adenomas pueden presentar focos de hemorragia, cuya señal varia en las distintas secuencias de RM dependiendo de su fase evolutiva.
Si con las técnicas mencionadas no se logra un diagnóstico concluyente sería razonable realizar un seguimiento en 6 meses para documentar su estabilidad, siempre y cuando no exista antecedente de una enfermedad maligna; de modo contrario se hace indispensable el diagnóstico histológico mediante biopsia, lo que es excepcional.
Los adenomas generalmente no muestran captación anormal de FDG en estudios PET; sin embargo, existen algunos reportes de captación moderada. La razón de ello no se ha demostrado claramente, pero se ha sugerido que el estado funcional del adenoma sería un factor relevante.
b) Metástasis
Virtualmente cualquier neoplasia primaria puede presentar diseminación hacia las glándulas suprarrenales; es el cuarto sitio más frecuente de enfermedad metastásica luego del pulmón, hígado y hueso. Se han reportado en un 3% de las autopsias, siendo bilaterales en un 49% de los casos.
Un 90% de las metástasis suprarrenales son carcinomas (pulmón, gástrico, esofágico, hepatobiliar, páncreas, colon, renal, mama). De estas lesiones un 56% son adenocarcinoma, 15% carcinomas escamosos y el porcentaje restante incluye linfoma, sarcoma y melanomas11,12. Las metástasis de tumores hipervasculares, particularmente las de origen renal, pueden realzar de manera similar a un feocromocitoma, por lo que son parte del diagnóstico diferencial.
Otros hallazgos que son sospechosos de malignidad, además de los criterios morfológicos ya descritos, son metástasis concomitantes en otro sitio anatómico, heterogeneidad de su estructura, y lavado pobre del contraste en fase tardía. A menudo tienen un lavado lento, menor a un 75% luego de los 15 minutos. No es infrecuente la presencia de necrosis central y hemorragia. En TC se pueden observar como una masa de partes blandas ovoidea o redondeada, o menos frecuentemente como un aumento de tamaño difuso de la glándula suprarrenal. En fase no contrastada la mayoría de las metástasis tienen valores de atenuación mayores a 10 UH, pero existen excepciones como es el caso de las metástasis de melanoma en que los valores de atenuación pueden ser menores, cercanos a los de un adenoma típico. Utilizando estos criterios, la sensibilidad y especificidad para diferenciar mediante TC una metástasis de un adenoma es de 98 y 97%, respectivamente13.
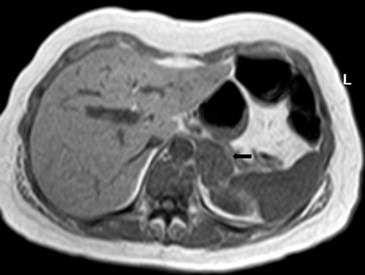
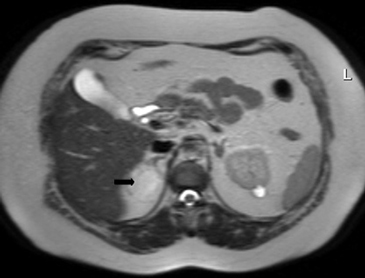
En RM típicamente son hipointensas en secuencias ponderadas en T1 e hiperintensos en T2. La mayoría de las metástasis no muestran caída de señal en secuencias fuera de fase (Figura 20 a y b), porque no contiene lípidos intracelulares. Infrecuentemente las metástasis pueden contener lípido intracelular, como es el caso raro de metástasis de tumores de células renales.
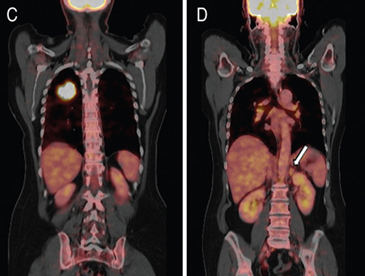
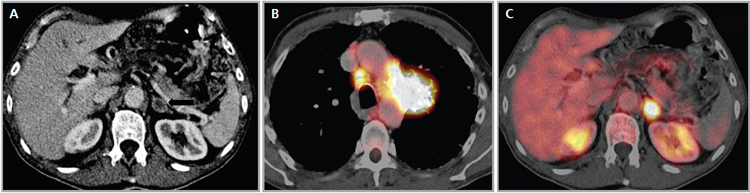
El PET-CT presenta utilidad en demostrar enfermedad oculta y enfermedad residual hipermetabólica cuando los hallazgos morfológicos son equívocos14. Esto cobra especial relevancia en casos en que la glándula suprarrenal es el único sitio de metástasis sospechado (Figura 21 a, b y c).
 A
A 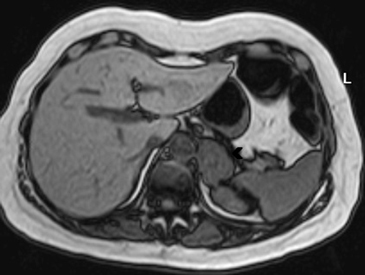 B
B
c) Carcinoma adrenocortical
El carcinoma primario de la glándula suprarrenal es una lesión infrecuente, con una incidencia estimada de 0,6 a 2 casos por millón de habitantes. Representan un 5% de los incidentalomas y ya presentan metástasis a distancia al momento del diagnóstico en un 20 a 50% de los casos. Su distribución etaria es bimodal, con "peaks" de incidencia en la primera y quinta décadas de la vida.
Puede manifestarse como una masa hiperfuncionante en aproximadamente un 55% de los casos, causando con mayor frecuencia síndrome de Cushing, virilización y en un menor numero de pacientes un hiperaldosteronismo. Por lo general el tamaño de la lesión al momento del diagnostico es mayor a 6 cm, alcanzando diámetros incluso de hasta 20 cm.
Los síntomas más habituales incluyen baja de peso, vómitos, nauseas, distensión abdominal severa y mialgias. La presentación como dolor abdominal asociado a un tumor palpable a menudo indica enfermedad ya avanzada. La cirugía radical constituye el único tratamiento efectivo tanto para la enfermedad local como a distancia, con un pronóstico habitualmente ominoso y sobrevida promedio de 18 meses.
En TC sin contraste por lo general se observa una masa heterogénea, especialmente en caso de lesiones de mayor tamaño por la presencia de necrosis. Entre un 19 a 33% de los casos se identifican calcificaciones. Luego de la administración de contraste su refuerzo es heterogéneo y su patrón de lavado es consistente con una enfermedad maligna (Figura 22).
Los sitios más habituales de metástasis son hígado, pulmón, además de la invasión de las estructuras vasculares adyacentes, especialmente de la vena cava inferior, hallazgo que constituye una consideración fundamental al momento de planificar el abordaje quirúrgico (Figura 23 a y b).
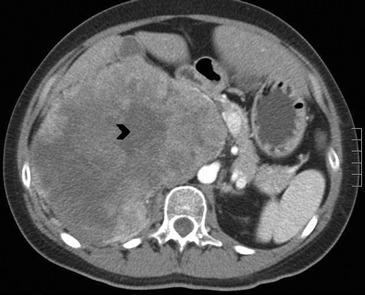
Figura 22. Carcinoma suprarrenal derecho. Cortes axiales de TC en fase portovenosa, donde se demuestra una gran lesión suprarrenal derecha, que realza en forma significativa con el uso de medio de contraste endovenoso y presenta áreas de necrosis central (cabeza de flecha).
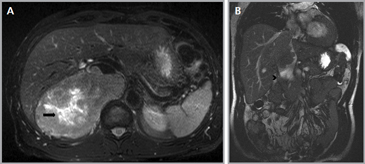 Figura 23. Carcinoma suprarrenal derecho. Corte axial de resonancia magnética ponderado en T2 con saturación grasa (a) en que se demuestra una masa suprarrenal derecha con áreas hiperintensas en su espesor probablemente determinadas por necrosis (flecha) y corte coronal en secuencia TRUFISP (b) en que se observa un trombo tumoral que expande el lumen de la vena cava inferior (cabeza de flecha).
Figura 23. Carcinoma suprarrenal derecho. Corte axial de resonancia magnética ponderado en T2 con saturación grasa (a) en que se demuestra una masa suprarrenal derecha con áreas hiperintensas en su espesor probablemente determinadas por necrosis (flecha) y corte coronal en secuencia TRUFISP (b) en que se observa un trombo tumoral que expande el lumen de la vena cava inferior (cabeza de flecha).Puede también presentar invasión directa de otras estructuras vecinas, como riñón, páncreas, bazo y diafragma.
En RM15 estas lesiones presentan intensidad de señal variable tanto en secuencias ponderadas en T1 como T2, dependiendo de la presencia de componentes necróticos y hemorrágicos, que como ya se mencionó es un hallazgo frecuente. Las áreas de necrosis suelen aparecer hipointensas en T1 e hiperintensas en T2, y las áreas de hemorragia si es en fase subaguda, vale decir aproximadamente una a siete semanas, se observara hiperintensidad de la lesión tanto en secuencia T1 y T2. En fase crónica (a partir de las 7 semanas en adelante) producto del deposito de hemosiderina y la presencia de una capsula fibrosa, las imágenes demuestran un anillo hipointenso tanto en secuencias T1 como T2. Con la administración de gadolinio ev se observa refuerzo de las porciones viables de tumor, con lo que se intensifica la señal.
En la evaluación PET los carcinomas adrenocorticales muestran captación ávida de FDG. Como se trata de una técnica extremadamente sensible para la detección de lesiones hipermetabólicas, se ha observado que en hasta un 30% de los casos pueden detectarse con esta técnica otras lesiones que pasan inadvertidas en las otras modalidades de imagen, lo que influye en el manejo de estos pacientes en hasta un 20% de los casos.
d) Feocromocitomas
Los feocromocitomas son neoplasias secretoras de catecolaminas, derivadas de las células cromafines localizadas en la médula suprarrenal. Ocurren con igual frecuencia en ambos sexos y se presentan mas comúnmente entre la tercera y cuarta décadas de la vida.
Aunque la hipertensión es una de las formas de presentación más habitual, frecuentemente referida como paroxística, refractaria a tratamiento habitual o de reciente comienzo, los feocromocitomas son la causa de hipertensión en menos de un 1% de los pacientes. Entre los casos que se diagnostican de manera incidental, un 53% tienen hipertensión. También pueden manifestarse con palpitaciones, cefalea, diaforesis y flushing. En estas neoplasias se puede aplicar la regla del 10%, porque 10% pueden ser extrasuprarrenales, 10% bilaterales, 10% malignas, 10% extrabdominales, 10% familiares, 10% en niños, 10% asintomáticos y 10% tienen transmisión autosómica dominante. Existe asociación con a algunos síndromes, entre los que se incluye la esclerosis tuberosa, neoplasia endocrina múltiple tipo 2, síndrome de von Hippel– Lindau, neurofibromatosis y síndrome de Sturge-Weber.
El diagnóstico de feocromocitoma se basa en la identificación de una masa suprarrenal asociada fundamentalmente a la confirmación clínica y bioquímica, de elevación en la excreción de catecolaminas libres (norepinefrina y epinefrina) o de sus metabolitos (ácido vanililmandelico) en orina de 24 horas16.
En TC la mayoría de las lesiones son redondeadas, homogéneas y de contornos bien definidos, con atenuación similar a la del parénquima hepático en fase no contrastada, similar al de un adenoma pobre en lípidos, pero hipervascularizados en las fases contrastadas (Figura 24 a, b y c).
 Figura 24. Feocromocitma suprarrenal izquierdo. En cortes axiales de TC en fase no contrastada (a), portovenosa (b) y tardía (c) se demuestra una lesión redondeada, de márgenes bien definidos, con realce hipervascular y áreas quísticas centrales.
Figura 24. Feocromocitma suprarrenal izquierdo. En cortes axiales de TC en fase no contrastada (a), portovenosa (b) y tardía (c) se demuestra una lesión redondeada, de márgenes bien definidos, con realce hipervascular y áreas quísticas centrales.
También de manera infrecuente pueden presentar tejido adiposo microscópico. Las calcificaciones están presentes en aproximadamente un 10%-30% de los casos.
Las lesiones de mayor tamaño con frecuencia presentan componentes quísticos debido a necrosis central o hemorragia antigua (Figura 25 a, b, c y d).
Debido a su hipervascularización los feocromocitomas presentan refuerzo intenso con el uso de medio de contraste endovenoso, tanto en la fase arterial como en la fase porto-venosa (Figura 26 a, b y c).
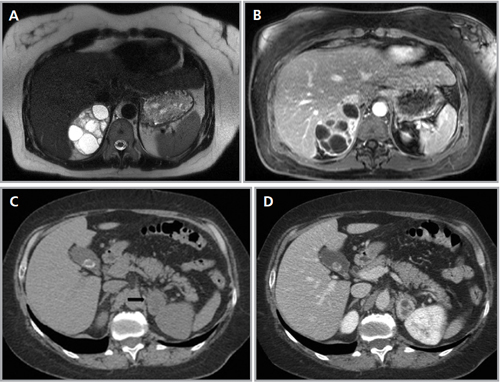
Figura 25. Feocromocitoma quístico. Cortes axiales de resonancia magnética (a) ponderado en T2 secuencia HASTE y (b) ponderado en T1 con saturación grasa y uso de contraste ev. Se identifica una lesión sólido-quística suprarrenal derecha, marcadamente hiperintensa en secuencias ponderadas en T2 y con significativo refuerzo de sus septos con el uso de contraste. Otro caso (c) y (d) cortes axiales de TC donde se demuestra una lesión suprarrenal izquierda (flecha), que también presenta áreas hipodensas centrales determinadas por focos de degeneración quística.
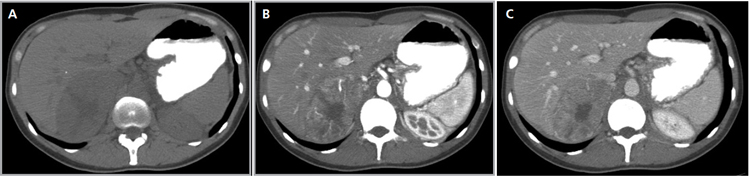 Figura 26. Feocromocitoma. Cortes axiales de tomografía computada en fase no contrastada (a) arterial (b) y tardía (c), donde se identifica una masa suprarrenal derecha que presenta significativo realce con el uso de medio de contraste.
Figura 26. Feocromocitoma. Cortes axiales de tomografía computada en fase no contrastada (a) arterial (b) y tardía (c), donde se identifica una masa suprarrenal derecha que presenta significativo realce con el uso de medio de contraste.
Su patrón de lavado es variable y pueden por tanto confundirse tanto con adenomas como con metástasis. Este patrón inconstante refleja la variedad de degeneración patológica que determina una red capilar alterada, que varia de igual modo tanto su patrón de impregnación como de lavado17.
Un subgrupo de lesiones (3% a 19%) presenta atenuación baja cercana a líquido, observando una masa quística con paredes gruesas que refuerzan con el contraste. Se ha reportado que estas lesiones quísticas son con menor probabilidad sintomáticas debido a una menor prevalencia de marcadores bioquímicos.
Las sensibilidades reportadas de la TC en la detección del feocromocitoma varia entre un 93-100%, sin embargo, hasta en un tercio de los casos su apariencia es inespecífica y puede superponerse a los de un carcinoma adrenocortical o un adenoma.
Se ha reportado que el uso de medio de contraste yodado pudiese precipitar una crisis hipertensiva en pacientes con feocromocitoma. Sin embargo, múltiples reportes han documentado que el uso de contraste yodado no iónico no determina un incremento del riesgo en este tipo de pacientes y puede ser utilizado de manera segura.
En RM clásicamente se describen como lesiones hipointensas en secuencias T1 y marcadamente hiperintensas en secuencia T2, sin embargo, su intensidad de señal es variable en un 30% de los casos, especialmente si son mayores a 5 cm debido a necrosis, hemorragia o calcificaciones. También presentan ávido refuerzo con el uso de gadolinio endovenoso.
El cintigrama con metayodobenzylguanidina (MIBG) marcado con yodo-131 ó 123 es útil en caso de alta sospecha clínica o bioquímica de feocromocitoma en que no se logre documentar mediante imágenes una lesión; también presenta utilidad en confirmar lesiones extraadrenales o metastásicas de un feocromocitoma maligno. Esta técnica tiene una alta especificidad, sin embargo, la sensibilidad es variable y su captación también se ve influenciada por la administración concomitante de otros medicamentos.
Las metástasis son el único criterio confiable en el diagnóstico de un feocromocitoma maligno, el tamaño tumoral, la tasa mitótica y la invasión capsular no son características discriminatorias suficientes para permitir su diferenciación.
La mayoría de los feocromoticomas, independiente de su localización extraadrenal o de su benignidad presentan hipermetabolismo al estudio PET; por lo tanto, esta modalidad es útil cuando los otros métodos resultan indeterminados. Otros radiotrazadores utilizados con menor frecuencia en la evaluación PET son el carbon 11 hidroxiefedrina y la fluoro-L-dopa.
e) Mielolipomas
Es un tumor muy infrecuente, sin potencial maligno, compuesto de tejido hematopoyético y adiposo, y a menudo se descubre de manera incidental, usualmente entre la quinta y séptima década de la vida.
Se ha reportado una incidencia de 60% en mujeres, y hasta un 12% serian bilaterales. Si existen síntomas son generalmente secundarios a efecto de masa, necrosis tumoral o hemorragia, que suele ocurrir en tumores de gran tamaño mayores de 5-10 cm.
En TC típicamente son lesiones de márgenes bien definidos, con contenido graso macroscópico, calcificaciones en un 20% de los casos y presentan un patrón de realce variable (Figura 27).
La cantidad de tejido graso macroscópico varia desde un 100% a ausencia completa (Figura 28), sin embargo, la presencia de incluso pequeñas cantidades de grasa macroscópica13 indica que la lesión corresponde a un mielolipoma (Figura 5 a).
El componente adiposo de estas lesiones es hiperintenso en secuencias T1 sin supresión grasa, lo que es inespecífico y puede observarse también en cualquier lesión con componente hemorrágico. Sin embargo, el hallazgo mas especifico es la perdida de la señal en secuencias con supresión grasa. (Figura 29 a y b).
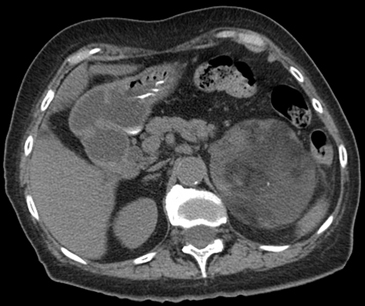
Figura 27. Mielolipoma. Corte axial de tomografía computada sin uso de medio de contraste, donde se observa una lesión suprarrenal izquierda heterogénea, con contenido graso macroscópico y una pequeña calcificación puntiforme central.
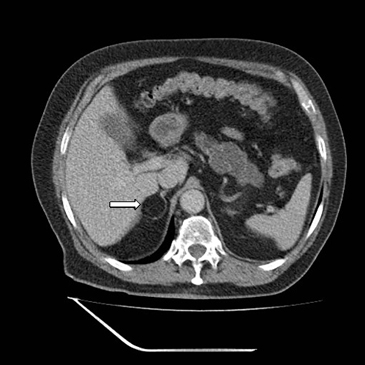
Figura 28. Mielolipoma. Tomografía computada en fase portovenosa, donde se demuestra un nódulo suprarrenal derecho conformado casi en su totalidad por tejido graso macroscópico (flecha blanca).
 A
A 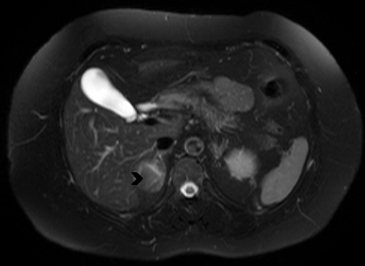 B
B
En función a la relación entre el tejido adiposo y el componente hematopoyético estas lesiones pueden ser homogéneamente hiperintensas en T1 con señal intermedia en secuencia T2, lo que sugiere que la lesión es predominantemente adiposa; una lesión heterogénea con focos de intensidad de señal grasa entremezclados con focos de alta intensidad de señal en T2 y refuerzo de estas áreas con el uso de contraste, hallazgos indicativos de un componente tanto mieloide como adiposo, o bien nódulos hipointensos en T1 e hiperintensos en T2 que refuerzan de manera homogénea con el uso de Gadolinio, determinado por una masa compuesta casi en su totalidad por componente mieloide, el cual al ser altamente vascularizado refuerza ávidamente con el uso de contraste.
En el PET CT estas neoplasias característicamente no demuestran captación de FDG. Sin embargo se han reportado casos raros en que se obtuvo captación hetrerogénea dado el hipermetabolismo del componente hematopoyético.
Dentro del diagnóstico diferencial de estas lesiones deben incluirse otros tumores que pueden desarrollar focos de tejido adiposo macroscópico, tales como el carcinoma adrenocortical, adenomas, feocromocitoma, y adenocarcinoma metastático, así como tumores de origen retroperitoneal como el liposarcoma.
f) Linfomas
El linfoma puede comprometer la glándula suprarrenal en forma secundaria generalmente en asociación a compromiso extenso del retroperitoneo, reportándose en un 4% de los pacientes con linfoma no Hodgkin (LNH) y siendo este compromiso en 43-50% de los casos bilateral.
También puede originarse como una neoplasia primaria, lo cual es extremadamente infrecuente. Esta entidad muestra predilección por pacientes ancianos y de sexo masculino (2:1), más de dos tercios de los casos son bilaterales y dos tercios de los pacientes presentan además síntomas de insuficiencia suprarrenal debido a la destrucción de la corteza suprarrenal mayor a un 90%.
En TC el compromiso puede manifestarse como un aumento de tamaño difuso de la glándula18 con valores de atenuación variables dependiendo del grado hemorragia o necrosis, pero la presencia de calificaciones es muy infrecuente. En etapas mas avanzadas puede existir un engrosamiento nodular o bien masas francas, pudiendo también observar una gran masa retroperitoneal que rodea y envuelve a la glándula suprarrenal y que puede dificultar su visualización.
La apariencia en RM es inespecífica, presentando con mayor frecuencia hipointensidad con respecto al parénquima hepático en secuencias T1, hiperintensidad heterogénea en secuencias ponderadas en T2 y ausencia de caída de señal en secuencias fuera de fase, con escaso refuerzo progresivo tras el uso de Gadolinio endovenoso (Figuras 30 a y b).
 A
A 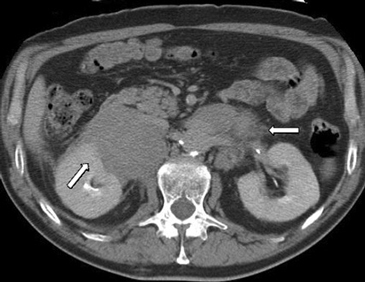 B
B
Sin embargo, la apariencia tanto en CT como en RM es inespecífico, y generalmente se presenta en contexto de pacientes con el diagnostico de linfoma conocido al momento del estudio, de todos modos el diagnostico definitivo se establece mediante el estudio histológico. Puesto que no es infrecuente el compromiso bilateral, el diagnostico diferencial debe incluirse en casos de pacientes que se presenten como una enfermedad de Addison.
En PET-CT el grado de captación de las glándulas suprarrenales comprometidas tiende a ser paralelo al compromiso extraadrenal, y la captación rápidamente decrece luego de quimioterapia adecuada.
g) Tumores raros
Los tumores de colisión son neoplasias extremadamente infrecuentes y se definen como dos lesiones de origen patológico diferente que coexisten sin mezcla significativa de sus componentes, y que en general presentan caracteres morfológicos atípicos. Ambos tumores pueden ser malignos o benignos, o uno de ellos maligno y el otro benigno. Se han reportado con mayor frecuencia en contexto de adenomas18.
En TC es muy difícil poder realizar el diagnóstico, sin embargo, en RM puede sospecharse si en una masa suprarrenal se identifica caída en la intensidad de señal focal en secuencia fuera de fase (Figura 31 a y b), aunque cabe mencionar que esta morfología puede identificarse ocasionalmente en algunos adenomas.
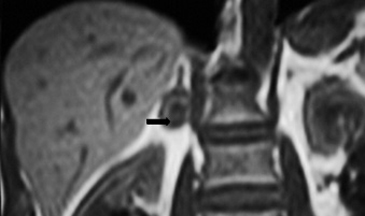 A
A 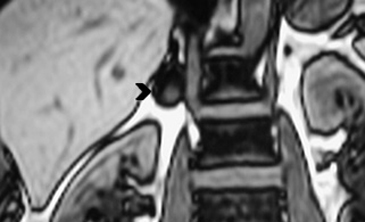 B
B
La posibilidad de la presencia de una de estas lesiones debe considerarse especialmente en pacientes con una neoplasia primaria conocida; en este contexto el uso del PET CT representa una ventaja en determinar la presencia áreas de captación anormal de FDG.
Otro tumor raro es el tumor fibroso de la glándula suprarrenal (Figura 32 a,b c y d). Estos tumores habitualmente se originan de la cavidad pleural, sin embargo, lesiones extrapleurales se han reportado en variadas localizaciones, incluyendo la glándula suprarrenal. Constituyen un grupo de neoplasias de origen mesenquimático, con una mezcla variable de fibroblastos o miofibroblastos, acompañados de estructuras vasculares de paredes delgadas y fibrosis. Generalmente, son lesiones asintomáticas, pudiendo manifestarse como hipoglicemia, hallazgo reportado en un 5 % de los pacientes. En las imágenes presentan caracteres inespecíficos, con grados variables de realce, y focos de necrosis y hemorragia.
h) Neuroblastoma
Es la segunda masa abdominal más frecuente en pacientes de edad pediátrica, representando entre un 5 a un 15% de los tumores en este grupo etario. Se originan a partir de células de la cresta neural localizadas en la medula suprarrenal o a lo largo de la cadena simpática. En general son clínicamente asintomáticos hasta que determinan compresión o invasión de estructuras vecinas, dan metastasis o determinan síndromes paraneoplásicos.
La mayoría tiene forma irregular, lobulados, con frecuencia presentan calcificaciones en su interior y su densidad es heterogénea por necrosis, hemorragia o degeneración quística. Es frecuente la extensión a linfonodos adyacentes o la presencia de metástasis a hígado.
La RM es la modalidad de elección de este tipo de lesiones, puesto que demuestra la extensión intraespinal y las localizaciones secundarias hepáticas; su intensidad de señal es hipointensa en T1 y de alta señal en T2, generalmente heterogéneos por la presencia ya descrita de hemorragia y necrosis.
Pueden desarrollarse de manera muy ocasional en adultos, en estos casos calcifican con menor frecuencia pero presentan un mayor porcentaje de metástasis al momento del diagnóstico. Sin embargo, su diferenciación de otras lesiones es difícil, por lo que el diagnostico final es histológico.
i) Lesiones quísticas
Los quistes suprarrenales son lesiones poco frecuentes, con una incidencia reportada en la literatura de entre 0,06 a un 0,18% en series de autopsias. Por lo general se detectan de manera incidental, sin embargo, pueden manifestarse como una masa palpable, o por dolor en relación a compresión de estructuras vecinas, hemorragia, ruptura o infección.
Pueden presentarse en cualquier grupo etario, con un "peak" de incidencia entre la tercera y sexta décadas de la vida, con una relación mujer/hombre de 3:1. Su tamaño es altamente variable, pueden ser uniloculares o multiloculados, e incluso bilaterales en hasta un 15% de los casos8.
De acuerdo a sus características histopatológicas pueden clasificarse en endoteliales, epiteliales, pseudoquistes y parasitarios.
Los quistes endoteliales, también denominados quistes simples, son el subtipo patológico más frecuente, representando aproximadamente un 45% de los casos. Estos a su vez pueden subdividirse en dos tipos, linfangiomatosos (42%) o hemangiomatosos (3%).
En TC se manifiestan como una lesión hipodensa, con valores de atenuación menores a 20 UH, de paredes finas, y en un 15% presentan calcificaciones parietales punteadas o curvilíneas. No demuestran refuerzo intralesional, sin embargo puede identificarse fino refuerzo anular determinado por segmentos de la glándula suprarrenal normal que se encuentran adyacentes a la lesión.
En RM son hipointensos en T1, hiperintensos en T2, sin componente de partes blandas ni refuerzo interno.
Los pseudoquistes son la lesión quística suprarrenal de segunda mayor frecuencia, dando cuenta de un aproximadamente 30% de las lesiones quísticas suprarrenales. Usualmente son secundarios a un episodio de hemorragia o infarto, y no contienen cubierta epitelial si no que una pared fibrosa. Tienen una mayor probabilidad que los quistes simples de volverse sintomáticos y en su gran mayoría son unilaterales.
En TC generalmente se manifiestan como una lesión oval o redondeada, de contornos bien definidos y densidad líquida (Figura 33), pero presentan con mayor frecuencia septos, contenido hemático, niveles liquido-liquido o algún componente de partes blandas. Las calcificaciones parietales se observan hasta en un 20% de los casos.
En RM igualmente pueden presentarse con septos, productos hemáticos o componente de partes blandas secundario a hemorragia o trombo hialinizado.
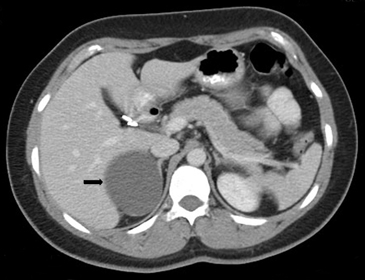
Figura 33. Pseudoquiste. Corte axial de tomografía computada en fase portovenosa, que muestra una lesión quística suprarrenal derecha, de paredes imperceptibles, sin calcificaciones ni componente sólido (flecha).
Los quistes epiteliales y parasitarios son muy infrecuentes, siendo un 9 y 7% de las lesiones quísticas, respectivamente. Los quistes parasitarios usualmente son de tipo hidatídico, y su característica clásica es la presencia de vesículas hijas y membranas intraparasitarias en el lumen, sin embargo, su aspecto puede variar desde un quiste simple a una lesión con múltiples septos y calcificaciones tanto de los septos como parietales.
Los quistes epiteliales son difíciles de diferenciar de las restantes lesiones mencionadas debido a que no presentan características específicas.
El linfangioma quístico de la glándula suprarrenal es una lesión extremadamente infrecuente y asintomática, cuyas características se asemejan a los linfangiomas en otras localizaciones, visualizándose como una lesión quística de paredes finas y sin refuerzo interno significativo.
Dentro del diagnóstico diferencial de las lesiones quísticas descritas cabe mencionar el feocromocitoma, neuroblastoma, compromiso metastático de tumor mamario y linfoma (Figura 34 a y b) los cuales pueden presentarse como lesiones quísticas. Algunas características orientadoras a una etiología maligna son la presencia de paredes gruesas mayor a 5 mm, altos valores de atenuación (mayor a 30 UH), un anillo calcificado grueso y calcificaciones punteadas centrales, hallazgos que deben hacer considerar la resección quirúrgica.
 A
A 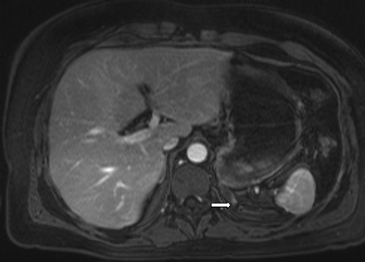 B
B
j) Hemorragia
Los hematomas suprarrenales pueden ser secundarios a causas traumáticas o no traumáticas. La causa traumática corresponde aproximadamente a un 80% de los casos y usualmente son unilaterales, con afectación mas frecuente de la glándula derecha, probablemente relacionado al tipo de drenaje venoso, en que la vena suprarrenal es corta y desemboca directamente a la vena cava inferior.
En relación a las etiologías no traumáticas, que se presentan usualmente en forma bilateral, cabe mencionar coagulopatías (uso de anticoagulantes, trombocitopenia), sepsis, especialmente secundaria a una infección meningocócica, quemaduras y una lesión tumoral subyacente, ya sea maligna o benigna, especialmente si ésta se produce de manera espontánea. El tumor que con mayor frecuencia se presenta como una hemorragia masiva es el feocromocitoma16.
En TC, en la etapa aguda se manifiesta como una masa suprarrenal mal definida, espontáneamente densa (aproximadamente 50 a 60 UH en fase no contrastada) y que no presenta realce tras el uso de medio de contraste (Figura 35 a y b). En su evolución, la densidad y tamaño de la lesión disminuye en forma progresiva, y si no se produce reabsorción total del hematoma, puede observarse una lesión quística de paredes calcificadas o bien una glándula disminuida de tamaño y densamente calcificada.
 A
A 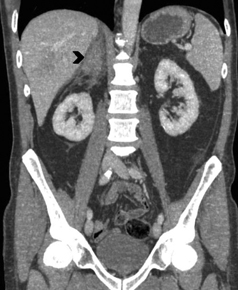 A
A
La RM es útil en determinar la temporalidad del hematoma, puesto que en fase subaguda, vale decir aproximadamente una a siete semanas, se observara hiperintensidad de la lesión tanto en secuencia T1 y T2. En fase crónica (a partir de las 7 semanas en adelante) producto del deposito de hemosiderina y la presencia de una capsula fibrosa, las imágenes demuestran un anillo hipointenso tanto en secuencias T1 como T2. Los hematomas pueden ser multiloculados, y cada uno de los lóbulos puede presentar distinta intensidad de señal, dependiendo del grado de oxidación de la hemoglobina.
En caso de existir sospecha de una causa tumoral subyacente el PET CT presenta utilidad en confirmar un compromiso neoplásico subyacente, especialmente en contexto de una lesión primaria conocida en el cual el estudio con TC no es concluyente.
k) Infección granulomatosa
Las infecciones granulomatosas, especialmente la tuberculosis, constituyen la segunda causa de insuficiencia suprarrenal luego de la enfermedad de Addison de causa idiopática.
La apariencia de estas infecciones depende del tiempo de evolución y de la actividad del proceso inflamatorio, en etapa aguda se observa aumento de tamaño generalmente bilateral y asimétrico, con áreas de necrosis central y refuerzo periférico19. En etapa crónica las glándulas suprarrenales se vuelven atróficas y pueden calcificar o desarrollar áreas quísticas.
En RM se observan lesiones sin contenido graso, con baja intensidad de señal de las áreas sólidas en secuencias T2 y lavado rápido con el uso de contraste. Las áreas de necrosis presentan alta intensidad de señal en imagines ponderadas en T2.
Referencias
- Elsayes KM, Mukundan G, Narra VR, et al. 2004. Adrenal Masses: MR Imaging Features with Pathologic Correlation. Radio Graphics 24: S73-S86.
- Barwick TD, Malhotra A, Webb JA, et al. 2005. Embryology of the adrenal glands and its relevance to diagnostic Imaging. Clinical Radiology 60: 953-959.
- Mansmann G, Lau J, et al. 2004. The Clinically Inapparent Adrenal Mass: Update in Diagnosis and Management. Endocr Rev 25 (2): 309-340.
- Boland G, Blake M, et al. 2008. Incidental Adrenal Lesions: Principles, Techniques, and Algorithms for Imaging Characterization. Radiology 249 (3): 756-775.
- Young WF Jr. 2007. The incidentally discovered adrenal mass. N Engl J Med; 356: 601-610.
- Lee MJ, Hahn PF, Papanicolau N, et al. 1991. Benign and malignant adrenal masses: CT distinction with attenuation coefficients, size, and observer analysis. Radiology; 17: 415-418.
- Boland GW, Lee MJ, Gazelle GS, et al. 1998. Characterization of adrenal masses using unenhanced CT: an analysis of the CT literature. AJR Am J Roentgenol 171: 201-204.
- Renken N, Krestin G. 2005. Magnetic Resonance Imaging of the Adrenal Glands. Semin Ultrasound CT MRI 26: 162-171.
- Pena CS, Boland GW, Hahn PF, et al. 2000. Characterization of indeterminate (lipid-poor) adrenal masses: use of washout characteristics at contrast-enhanced CT. Radiology 217: 798-802.
- Caoili EM, Korobkin M, Francis IR, et al. 2002 Adrenal masses: characterization with combined unenhanced and delayed enhanced CT. Radiology 222: 629-633.
- Lam KY, Lo CY. 2002. Metastatic tumours of the adrenal glands: a 30-year experience in a teaching hospital. Clin Endocrinol (Oxf) 56 (1): 95-101.
- Johnson P, Horton K, Fishman E. 2009. Adrenal Mass Imaging with Multidetector CT: Pathologic Conditions, Pearls, and Pitfalls. RadioGraphics; 29: 1333-1351.
- Blake M, Holalkere N, et al. 2008. Imaging Techniques for Adrenal Lesion Characterization. Radiol Clin N Am; 46: 65-78.
- Elaini AB, Shetty SK, Chapman VM, et al. Improved detection and characterization of adrenal disease with PET-CT. RadioGraphics 2007; 27: 755-767.
- Hussain H, Korobkin M. 2004. MR imaging of the adrenal glands. Magn Reson Imaging Clin N Am 12: 515-544.
- Rockal AG, Sahdev A. 2002. Functional adrenal pathology. Imaging; 14: 122-136.
- Boland GW. 2011. From Addison to Algorithms. Radiol Clin N Am; 49: 511-528.
- Otal P, Escourru G, Mazerolles C, Dóthee B, Mezgbani S, Musso S, et al. 1999. Imaging features of uncommon adrenal masses with histopathologic correlation. RadioGraphics 19:
569-581. - Mayo-Smith WW, Boland GW, Noto RB, Lee MJ. 2011. State-of-the-Art Adrenal Imaging. RadioGraphics; 21: 955-1012.