Tendencia de la nutrición de yodo durante las últimas décadas en escolares chilenos y sus consecuencias
Santiago Muzzo B.1
Trend of iodine nutrition in recent decades and its consequences in Chilean schoolchildren
Director. Dirección de Investigación, Facultad de Medicina, Universidad Diego Portales, Santiago, Chile.
Correspondencia a:
Dr. Santiago Muzzo Benavides
Grajales # 1746
Fono: 6768702
E-mail: santiago.muzzo@udp.cl
Recibido: 15 de Julio de 2011
Aceptado: 10 de Agosto de 2011
The endemic goiter, nutritional collective problem due to iodine deficience, constitutes a chronic disease with easy prevention and control, nevertheless still it constitutes a serious problem of public world health, being thought that about 650 million persons have goiter, 43 millions suffer from endemic cretinism and 1570 millions are in risk of suffering this disease for living in areas that present a deficit of iodine. Both patterns, deficit and the excess of iodine can conducted to a thyroid disease. The relation between the ingestion of iodine and the risk of disease corresponds to a U curve, where both, the low one and high ingestion of iodine it is associate to high risk of thyroid disease. To have a program of iodine suplementación, it should imply a constant vigilance of iodine nutrition to see its effect on the goiter prevalence in the population, to control his degree of fulfillment, to avoid a possible excess of ingestion of iodine it might help to correct any precocious alteration. Endemic goiter is not longer a problem in Chile. Salt iodination is in agreement with present legislation, but it is very important to have a continuous surveillance of iodine nutrition in Chile to contro if salt fortification is appropiate.
Key words: Endemic, goiter, iodine nutrition.
El bocio endémico, problema nutricional colectivo debido a déficit de yodo, constituye la enfermedad crónica de mas fácil prevención y control, sin embargo aún constituye un serio problema de salud pública mundial, estimándose que alrededor de 650 millones de personas tienen bocio, 43 millones padecen de cretinismo endémico y 1.570 millones están en riesgo de padecer esta enfermedad por vivir en áreas que presentan un déficit de yodo1.
La recomendación de ingesta de yodo es de 150 μg por día de los 11 años de edad en adelante. La ingesta óptima de yodo se estima entre 120 y 220 μg en 24 horas, siendo su excreción urinaria (yoduria) el 90% de la ingesta. De estas cifras se puede deducir que la medición de la excreción urinaria de yodo es un buen indicador de su ingesta.
Chile tomó la decisión de erradicar el bocio endémico al promulgar en 1960 una ley que indicó que toda sal de consumo humano debía estar yodada en una concentración de una parte de yodato de sodio o potasio por cada 10.000 partes de sal (100 ppm). Sin embargo, esta medida sólo se implementó en 1979, fecha en la que el Ministerio de Salud dictó un decreto de obligatoriedad de yodación de la sal a todos los salineros.
Antes de iniciar la yodación de la sal en Chile, sólo existían publicaciones parcelares sobre la prevalencia de bocio en el país, las que indicaban que existía un problema moderado de bocio endémico, sin haberse descrito casos de cretinismo endémico. En 1955 se detectó un 11% de bocio en algunos escolares de Santiago2 y 19% en Coquimbo y Linares3; en 1958 un 33% en Linares y 24% en Ñuble4; un 61% y 31% en grupos cerrados de Pedregoso y Lonquimay respectivamente5; y en 1974 Domínguez y colaboradores encontraron un 25% en la zona de Puente Alto, Pirque y San José de Maipo6.
En 1982, Muzzo y cols detectaron una prevalencia de bocio de 18,8% en una muestra representativa de escolares de educación básica de la XIII Región (Metropolitana) de Chile, la que reunía alrededor del 45% de los educandos de Chile7 (Tabla 1). Esta prevalencia fue mayor en escolares de sexo femenino, aumentaba en ambos sexos con la edad del escolar, era mayor a menor calidad del estado nutricional medido según la adecuación del peso para la talla, mayor a menor adecuación de la estatura del escolar y mayor en las zonas rurales y cordilleranas de la Región Metropolitana7.
Tabla 1. Prevalencia de bocio según tipo de escuela en escolares de la Región Metropolitana (1982)
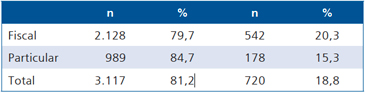
x2 = 13,9; 1 g.l; p < 0,001.
Por haberse detectado que el bocio endémico presentaba una distribución geográfica (mayor en zona rural y cordillerana) y para dar mayor representatividad a los estudios de escolares decidimos agregar zonas censorias en la zona norte (Calama), centro (Santiago), sur (Temuco) y extremo sur (Punta Arenas) del país.
En 1986, la prevalencia de bocio había descendido a 7,6% en escolares de educación básica de 2 zonas censorias del país (Santiago y Temuco)8-10. Durante 1991 se repitió el diagnóstico en escolares de 3 zonas censorias; Santiago, Temuco y Calama, detectándose una prevalencia de 11%, discretamente mayor en Santiago y Temuco que en Calama. En Calama se encontró que el 12% de la sal de consumo humana expendida en locales comerciales tenía una concentración menor de 60 ppm de yodo, el 27% en Santiago y el 87% en Temuco11. Las determinaciones de yodo en orina de estos escolares mostraron que en promedio fue 876 μg I/g de creatinina en Calama, 752 en Santiago y 505 en Temuco. A pesar que el promedio de estas yodurias estaban sobre la recomendación vigente en ese momento, existía un porcentaje que se encontraba bajo 100 μg I/g de creatinina, el que fue mayor (10,6%) en la ciudad de Temuco12.
En 1992 por encargo de la Organización Panamericana de la Salud (OPS) detectamos en 3 zonas censoras (Calama, Santiago y Temuco) que el bocio endémico se mantenía bajo el 10% y que la concentración de yodo de las sales obtenidas en locales de expendio de las zonas encuestadas eran normales, salvo en la zona de Temuco que eran bajas.
Desde 1993 el Instituto de Nutrición y Tecnología de los Alimentos de la Universidad de Chile, certifica la adecuación de la yodación de la sal de la Salinera Punta de Lobos, la que produce cerca del 90% de la sal de consumo humano en Chile. Al inicio de este control se encontró que de las 5 plantas que tenía esta empresa en ese entonces, sólo la de Talcahuano tenía disminuida la concentración de yodo en la sal, planta que distribuye habitualmente su producción especialmente en la zona, llegando su distribución hasta Temuco. Esta deficiencia local se corrigió en los primeros 2 meses de marcha blanca de la certificación, para posteriormente estar de acuerdo a la legislación vigente.
En el 1994 por encargo de la UNICEF efectuamos un nuevo estudio de la nutrición de yodo en escolares de las 4 zonas censorias (Calama, Santiago, Temuco y Punta Arenas) anteriormente encuestadas, detectando que la prevalencia de bocio estaba en 9,4%, la yodación de la sal era 90 ppm, aceptable para la legislación vigente del momento, sin embargo las yodurias de los escolares se encontraron muy altas (en promedio 747 y 790 μg I/g creatinina para niños y niñas respectivamente); siendo 1.849 y 1.746 en Calama; 680 y 732 en Santiago; 638 y 427 en Temuco; 563 y 545 μg I/g creatinina en Punta Arenas, respectivamente)13 (Tabla 2).
Tabla 2. Excreción de yodo en orina según localidad y sexo (1994)
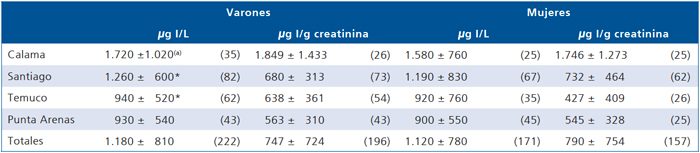
(a)X ± DE (número de casos). Significancia según prueba F = 12,78; p = 0,01; *Significancia de acuerdo a la localidad según t Student < 0,05.
En este tiempo se inició un convenio entre el Servicio de Salud del Ambiente de la Región Metropolitana (SESMA) y Soquimich Yodo S.A. (SQM IODO) con la finalidad de estudiar un dosificador de yodo para agua de bebida de pequeños poblados con la finalidad de mejorar su calidad bacteriológica. Estos dosificadores entregaban alrededor de 500 μg I/lt de agua. En este tiempo ya se habían instalado 27 dosificadores en diferentes poblados del país. Por encargo del Ministerio de Salud, en 1997 analizamos la nutrición de yodo en escolares de zonas con dosificador de yodo en agua de bebida. Se tomó una muestra en Quepe (IX Región) y otra en Pirque (Región Metropolitana) detectando que el bocio estaba bajo el 10%, sin embargo, el promedio de las yodurias de estos escolares eran en promedio de 1.200 μg I/g creatinina.
En 1998 coordinamos la pasada por Chile de un furgón del Laboratorio Farmacéutico Merck traído desde Alemania (ThyroidMobil), el que contaba con un médico que determinó por ecografía de alta resolución el tamaño tiroideo de los escolares y una enfermera que recolectó muestras de sal y de orinas de los escolares para la medición de yodo. Estas mediciones fueron efectuadas en 10 ciudades de Chile localizadas entre Arica y Puerto Montt. El Thyromobil fue traído por el ICIDD (International Comitte for Iodine Deficience Disorders) para ver la nutrición de yodo en escolares de latino-américa. Se encontró que la prevalencia de bocio en escolares chilenos de ambos sexos determinada por ecografía era 5,3% (Tabla 3), la yodación de las sales de consumo humano de acuerdo a lo exigido por la reglamentación vigente y que las yodurias eran las mas altas de la región y en niveles similares a las descritos en los estudios anteriormente señalados14 (Tabla 4).
Tabla 3. Prevalencia de bocio en escolares chilenos detectada por el Thyroidmobil (noviembre 1998)
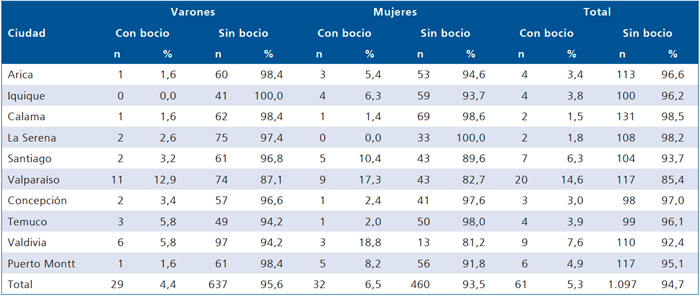
Endoc J 2000; 47: 228.
Tabla 4. Distribución de las yodurias en 11 países latino-americanos determinadas por el Thyroidmobil
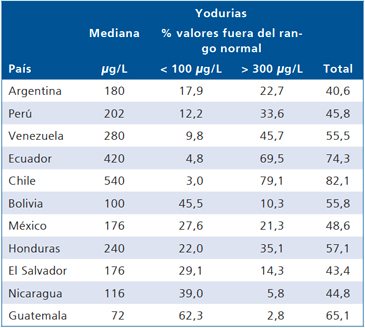
Endoc J 2000; 47: 228.
Toda esta información se entregó al Ministerio de Salud, con el cual se estudió la factibilidad de disminuir la exigencia de la yodación de la sal de consumo humano de ese momento de 100 ppm a un promedio de 40 ppm, con un rango de 20 a 60 ppm. Esta modificación se concretó con su aparición en el nuevo Reglamento Sanitario de los Alimentos (RSA) de enero de 2000.
El año 2001 nuevamente nos interesó verificar la adecuación de la nutrición de yodo del escolar chileno, un año y medio posterior al cambio de la legislación. Si bien encontramos que el contenido de yodo de la sal estaba de acuerdo al cambio del reglamento, que la prevalencia de bocio continuaba baja, la excreción urinaria de yodo sólo se había normalizado en Punta Arenas, se había mantenido en Temuco y había subido en Santiago y Calama, lo que nos hizo sospechar una posible contaminación de alimentos15,16 (Tabla 5). Interpretamos esta alza, que si bien hacía un año se había cambiado la exigencia del RSA, las entidades controladoras permitieron a las salineras mantener la concentración de yodo hasta que les agotaran las etiquetas que indicaban una concentración de yodo de 100 ppm, al tiempo que tomó consumir los acopios de sal yodada en las salineras y a los stock en los supermercados y en los hogares. De esta manera pensamos que había sido poco el tiempo que se dio a este análisis para que estuviera actuando el cambio del nuevo RSA.
Tabla 5. Excreción de yodo en orina, según localidad y sexo (2001)
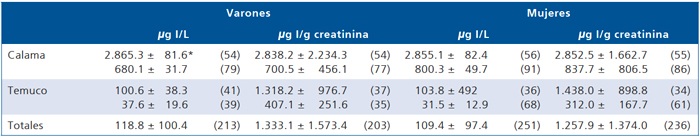
*promedio ± D.E. (número de casos). Yoduria varones (m g l/dL), prueba F= 221.26; p < 0,001. Yoduria mujeres (m g l/dL), prueba F= 196.58; p < 0,001. Yoduria varones (m g l/g creatinina), prueba F= 37,60; p < 0,001. Yoduria mujeres (m g l/g creatinina), prueba F= 68,70; p < 0,001. Yoduria varones (m g l/dL) t Student; (a) (b) (a) (c) (a) (d) (b) (c) (b) (d) (c) (d) p < 0,001. Yoduria varones (m g l/g creatinina) según t Student; (a) (b) (a) (c) (a) (d) (b) (c) (b) (d) (c) (< 0,001). Yoduria mujeres (m g l/dL) según t Student; (b) (c) p < 0,01; (a) (b) (a) (c) (a) (d) (b) (d) (c) (d) p < 0,001. Yoduria mujeres (m g l/g creatinina) según t Student (b) (c) p < 0,0025; (a) (b) (a) (c) (a) (d) (b) (d); (c) (d) p < 0,001.
El año 2003 estudiamos nuevamente la nutrición de yodo de escolares de Calama (la zona con la mayor excreción de yodo por orina) y los comparamos con escolares de Punta Arenas. Detectamos que en ambas ciudades el contenido de yodo en la sal y la prevalencia de bocio se mantenían normales, la excreción urinaria de yodo se mantenía normal en Punta Arenas y había bajado notoriamente en Calama (450 μgI/g creatinina), pero aun estaba elevada y significativamente mas alta que en Punta Arenas (250 μgI/g creatinina). La función tiroidea de los escolares medida por TSH, T3 y T4 era normal; sin embargo la presencia de anticuerpos antitiroideos era significativamente mayor en escolares con bocio de Calama al compararlos con escolares de Punta Arenas los que ya habían normalizado sus yodurias. Estos resultados nos hicieron pensar que un proceso tiroideo autoinmune se estaba desencadenando en sujetos susceptibles por el alto y crónico consumo de yodo al que estuvieron expuestos17 (Tabla 6).
Tabla 6. Anticuerpos antiroideos en escolares con bocio de una zona con alta ingesta de yodo (2003)
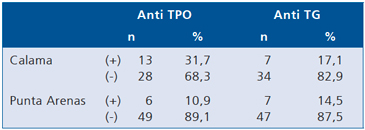
X2 = 6,4; 1 g.l. p < 0,01. X2 = 0.1; 1 g.l. p = n.s.
Tabla 7. Parámetros de la nutrición de yodo en Calama (2003)
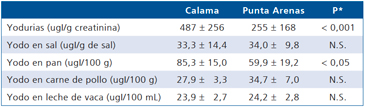
*Significancia según t Student. NS = no significativo.
Con la finalidad de descartar una posible contaminación de alimentos en la ciudad de Calama, determinamos el contenido de yodo en diferentes alimentos. No detectamos yodo en el agua del río Loa, ni en el agua potable de la ciudad, ni en las bebidas de fantasía, ni en las carnes, ni en la leche. Sin embargo el pan tenía un contenido de yodo significativamente mayor que el que contenía una zona que había normalizado sus yodurias (Punta Arenas) (Tabla 7). Detectamos que el pan tenía un contenido de yodo 10 veces mayor que lo descrito en el pan en Inglaterra (datos por publicar). Esto nos hizo sospechar que el exceso de yodo consumido en Calama se podría deber más bien a una sumatoria de consumo de varios productos con contenido aumentado de yodo, que en una fuente única de contaminación. Sin embargo, al sumar las posibles ingestas de yodo de alimentos con el mayor contenido de yodo (pan y sal yodada), no nos explicaban totalmente las elevadísimas cifras detectadas en un momento en Calama.
Es interesante destacar que la disminución de las yodurias en la ciudad de Calama coincidió con el traslado de la población de Chuquicamata a la ciudad de Calama, dado que las montañas de ripio que se eliminaban del anfiteatro de extracción de cobre, empezaron a sepultar la ciudad. Esta coincidencia nos hizo sospechar, sin haberlo podido confirmar, que una fuente inhalatoria de yodo podría también haber contribuido a las altas yodurias que presentaron los escolares de esta ciudad18.
El año 2004 salimos nuevamente a determinar la adecuación de la función tiroidea en escolares de Calama los que aún presentaban cifras elevadas de yodurias, y los comparamos con escolares de Santiago los que habían normalizado sus yodurias. Detectamos que si bien los valores se encontraban dentro del rango de normalidad, los escolares de Calama tenían cifras significativamente más altas de TSH y más bajas de T3 y T4. Además los escolares de Calama tenían cifras significativamente más altas de anticuerpos anti TPO. Este estudio nos hizo sospechar que los escolares de Calama empezaban a presentar una disminución de su función tiroidea (datos por publicar) (Tabla 8).
Tabla 8. Yodurias, hormonas tiroideas y autoanticuerpos en escolares (2004)
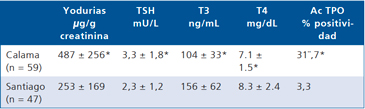
*X ± DE. p < 0,05 por t test o x2.
Ingesta de yodo y tiroiditis autoinmune
Se ha demostrado que poblaciones con una ingesta crónicamente deficiente en yodo padecen bocio endémico y si es severa, presentan casos de cretinismo endémico. A la vez poblaciones crónicamente deficientes en yodo pueden desarrollar un hipertiroidismo transitorio, llamado Job-Bassedow, al iniciar la suplementación con este mineral. La causa sería un aumento de la síntesis de hormonas tiroideas en nódulos tiroideos autónomos, desarrollados durante el período de déficit de yodo, problema que se observa en los primeros años de yodación, especialmente en mujeres adultas con bocios nodulares. La ingesta aguda de altas cantidades de yodo puede producir la enfermedad de Wolff-Chiakoff, debida al bloqueo de la organificación del yodo en las células tiroideas que puede inducir hipotiroidismo. Por último el consumo elevado de yodo en forma crónica puede inducir bocio por tiroiditis autoinmune19.
Tanto el déficit como el exceso de yodo pueden conducir a una enfermedad tiroidea. La relación entre la ingesta de yodo y el riesgo de enfermedad corresponde a una curva en U; tanto una baja como alta ingesta de yodo se asocian a mayor riesgo de enfermedad tiroidea20.
Una función importante del sistema inmune es discriminar entre lo que es propio y lo que no es propio y tal vez entre peligro y no peligro. A veces, el sistema erróneamente establece una reacción inmune hacia antígenos propios durante condiciones que no son de peligro. Estas reacciones pueden ser tan aberrantes y vigorosas que inflingan un daño, al constituir una enfermedad autoinmune.
Las enfermedades tiroideas autoinmunes (ETAI) son enfermedades poligénicas, en las cuales la penetrancia está influenciada fuertemente por factores ambientales. Se caracterizan por infiltración del tiroides por células T y B reactivas a los antígenos tiroideos, produciendo anticuerpos antitiroideos. La evidencia de un componente genético proviene de estudios de agregación familiar, y que los mellizos homozigóticos tienen una cifra de concordancia de la enfermedad mayor que los dizigóticos. La cifra de concordancia es sólo del 50%, lo que enfatiza que los factores ambientales también juegan un rol, como la ingestión crónica excesiva de yodo e infecciones por Yersinia enterocólica, virus Coxsakie B, Retrovirus, Helicobacter pylori y virus de la hepatitis C. Los genes inmuno-moduladores identificados hasta el momento son: HLA-DR, CTLA-4, CD40 y PTPN22. Genes específicos del tiroides son el de tiroglobulina y del receptor del TSH que representan los blancos principales de la respuesta inmune en las ETAI21.
Un alto consumo de yodo puede provenir de fuentes naturales; se ha descrito en Japón por alto consumo de algas, en China por consumo de agua con alto contenido de yodo, en Islandia por el uso de pescado para la alimentación de ganado que produce un alto contenido de yodo en la carne y derivados lácteos22. Otra causa es una suplementación de yodo excesiva y químicos que contienen yodo usados para la preparación de comidas (acondicionadores de los panaderos y algunos medicamentos. El exceso moderado de yodo lo toleran mal las personas con problemas tiroideos, no así las personas sanas.
En la costa de Hokkaido, en Japón, pescadores que tenían una dieta rica en algas y que presentaban bocio, sus yodurias eran muy elevadas. En algunas áreas el 14% tenía bocio, el que disminuyó al bajar la ingesta de yodo. En China se compararon niños de 2 poblaciones; una con una ingesta de yodo en el agua potable de 54 con otra de 462 μg/L, las yodurias eran de 428 y 1235 μg/g creatinina respectivamente. El área con la mayor ingesta era una área con bocio endémico, donde la TSH se encontró elevada (en promedio 7,8 mU/L)22.
En animales que reciben altas dosis de yodo, este se oxida rápidamente en los tirocitos generando compuestos reactivos que dañan las membranas celulares, lo que se agrava si hay una deficiencia de selenio23-25. Un alto nivel de yodo plasmático inhibe la captación tiroidea de yodo y la entrega de hormonas por parte de las células foliculares. Posiblemente se trata de un mecanismo de protección contra la hipersecreción hormonal25.
Se efectuó un estudio comparativo de 2 poblaciones, Jutlandia con ingesta baja de yodo (entre 40 y 70 μg I/día) e Islandia con alta (300 μg /día) para ver la incidencia y prevalencia de hipo e hipertiroidismo, poblaciones que tenían un nivel socioeconómico y antecedentes genéticos similares. Se encontró que en Islandia el hipertiroidismo era 3 veces mas frecuente que en Jutlandia en jóvenes y en personas de edad media, sin embargo era mas frecuente en los ancianos en Jutlandia. Se vio que el hipertiroidismo en Jutlandia era mas común que el hipotiroidismo en todas las edades a excepción del recién nacido. Se encontró alta prevalencia de hipertiroidismo en Jutlandia y baja en Islandia, mientras que el patrón de hipotiroidismo fue alto en Islandia y bajo en Jutlandia26.
La progresión de la secreción hormonal tiroidea autónoma puede variar. A través de los años algunos progresan a hipertiroidismo y otros permanecen eutiroideos. Una sobrecarga de yodo podría inducir hipertiroidismo transitorio aumentando la disponibilidad de substrato para la síntesis hormonal. Una posible causa podría ser una diferencia en la respuesta del TSH a diferentes receptores de TSH mutados que se han encontrado en nódulos hiperactivos. Los receptores mutados responden más a la TSH. Por lo tanto la hiperactividad en zonas de deficiencia moderada de yodo está ligada al desarrollo de funciones autónomas multifocales de la glándula.
Al introducir en USA yodato en la industria del pan, se produjo durante un tiempo una alta ingesta de yodo en la población la que varió entre 500 a 1.000 μg/día. Se comunicó que durante la ingestión baja de yodo tenían una incidencia alta de hipertiroidismo no autoinmune aun hasta 20 años después de elevar la ingesta de yodo. Los niveles altos de TSH se daban más con ingesta alta de yodo.
Dos mecanismos podrían estar involucrados en el hipotiroidismo; una hipofunción tiroidea por tiroiditis autoinmune y el efecto inhibitorio del yodo en varios procesos tiroideos de la síntesis y secreción de hormonas tiroideas. En modelos animales se ha demostrado que el paso de una baja a alta ingesta de yodo produce tiroiditis27. En humanos se ha demostrado en biopsias de tiroides, un aumento histológico de la tiroiditis al subir el yodo.
Se ha visto en una población japonesa normal, que no más de 2% tiene anticuerpos antitiroideos positivos. En 35 niños normales chilenos detectamos que ninguno presentaba anticuerpos antitiroideos positivos (por publicar). En Grecia se detectó que en áreas con excreción urinaria de yodo de 200 μg/lt un 16% de los pacientes con bocio tenían anticuerpos antitiroideos positivos, lo que era negativo en pacientes con bocio de áreas con baja ingesta (74 μg/lt)28,29. Además, al fortificar la sal con yodo entre el año 1994 y el 2001 y llegar a yodurias de 200 μg/lt, estos escolares bajaron su prevalencia de bocio de 21 a 5%, pero aumentaron las tiroiditis autoinmunes de 3,3 a 9,6%30 (Tabla 9). Otro grupo de investigadores griegos encontraron que adultos con bocio no tóxico que recibieron 480 mg de aceite yodado intramuscular, sus yodurias subieron de 142 a 859 μg/g a los 3 meses para luego descender, pero con un aumento significativo de los anticuerpos antitiroideos, concluyendo que induce o por lo menos facilita la expresión de una enfermedad autoinmune en individuos susceptibles31.
Tabla 9. Yodurias y tiroiditis autoinmune en escolares griegos entre 1994 y 2001
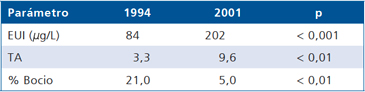
EUI: Excreción urinaria de yodo. TA: Tiroiditis autoinmune. Zois et al. Thyroid 2003; 13: 485-9.
Es importante que en Chile, que estuvo expuesto durante 22 años a una ingesta excesiva de yodo, se conozcan las consecuencias de una alta ingestión crónica de yodo. De esta manera, las autoridades de salud y los profesionales de la salud podrán contar con una información actualizada de la nutrición de yodo en el país, para tomar las medidas necesarias para un adecuado control de los pacientes con tiroiditis autoinmune y para mantener un adecuado control de la aporte de yodo poblacional a través de la fortificación de la sal.
El contar con un programa de suplementación con yodo, debería implicar una vigilancia continua de la nutrición de yodo para ver su efecto sobre la prevalencia de bocio poblacional, controlar su grado de cumplimiento, evitar un posible exceso de ingestión de yodo por parte de la población y de esta manera corregir rápidamente cualquiera alteración que se pudiera detectar.
Me parece indispensable efectuar una vigilancia continua de la nutrición de yodo en Chile, para estar alerta que no se produzca ni una ingesta excesiva que puede ocasionar un aumento de las tiroiditis autoinmunes, ni un déficit en la ingesta que podría significar que reaparezca el bocio endémico, el cual por el momento se encuentra controlado. Dado que hemos observado una clara tendencia a normalizar la excreción de yodo en orina por parte de escolares chilenos de diferentes zonas del país durante esta última década, se pronostica que el riesgo de presentar enfermedades por alteración en la nutrición de yodo debería ir disminuyendo.
Referencias
- ICCIDD/UNICEF/WHO. Global prevalence of iodine deficiency disorders. MDIS Working paper #1. Micronutrient Information System, Ginebra, Organización Mundial de la Salud. 1993.
- Donoso F, Jadresic A, López E, García de los Ríos M, Concha J, Espejo M, González H, Valenzuela J, Wainstein E. 1955. Encuesta de bocio en escolares de la provincia de Santiago y consideraciones sobre el problema de bocio endémico. Rev Med Chile; 83 (Suppl).
- Donoso F, Jadresic A, López E, García RM, Atria P. 1955. Encuesta de bocio de las escuelas de Mellipilla. Rev Med Chile 83: 246-249.
- Donoso F, Lennon H, Canessa M, Vallejos J, Aldunate G. 1959. Encuesta de bocio en escolares de la provincia de Linares y Ñuble. Rev Med Chile 87: 717.
- Nagel R, Etcheverry R, Guzmán C, Hille A, Barzelatto J, Covarrubias E. 1962. Encuesta de bocio endémico en la población Mapuche y en algunos colegios de primera enseñanza de las provincias de Cautín y Malleco. Rev Med Chile 90: 616-618.
- Domínguez M, Quesney F, Michaud P, Maggiolo G, Ugarte JM. 1974. La prevalencia del bocio en escolares de las comunas de Puente Alto, Pirque, y San José de Maipo: estudio clínico epidemiológico. Rev Med Chile 102: 633.
- Muzzo S, Leiva L, Zvaighaft A. 1985. Características del bocio endémico en el escolar de la Región Metropolitana de Chile. Rev Chil Nutr 13: 143-147.
- Muzzo S, Leiva L. 1986. Endemic goiter and cretinism and their control in Chile. En: Towards the eradication of endemic goiter, cretinism, and iodine deficiency. Editado por Dunn JT. OPS/OMS, Scientific Publication Nº 502, p. 276-279.
- Muzzo S, Pozo M, Zvaighaft A, Rodewald AM, Biolley E, Leiva L. 1989. Características actuales del bocio endémico en escolares de dos zonas censoras de Chile. Rev Chil Nutr 17: 60-65.
- Pozo MM, Rodewald AM, Biolley E, Zvaighaft A, Leiva L, Muzzo S. 1989. Prevalencia de bocio endémico en escolares del centro y sur de Chile. Rev Chil Pediatr; 60: 359-362.
- Leiva L, Pozo M, Biolley E. Muzzo S. 1992. Excreción de yodo urinario y función tiroidea de escolares de Santiago y Temuco. Rev Chil Nutr 20:38-42.
- Pozo M, Rodewald A.M, Biolley E, Zvaighaft A, Leiva L, Muzzo S. 1989. Prevalencia de bocio endémico en escolares del centro y sur de Chile. Rev Chil Ped 60: 359-362.
- Muzzo S, Burgueño M, Carvajal F, Moreno R, Leiva L. 1994. Características actuales del bocio endémico en 3 zonas censorias de Chile. Arch Latinoam Nutr 44: 82-86.
- Pretell EA, Delange F, Hostalek U, Corigliano S, Barreda L, Muzzo S, et al. 2004. Iodine nutrition improves in Latin America. Thyroid 14: 590-599.
- Muzzo S, Burgueño M, Carvajal F, Biolley E, Avendaño M, Vargas A, et al. 1997. Nutrición de yodo en escolares de 4 zonas censoras de Chile. Rev Med Chile 125: 1299-1304.
- Muzzo S, Ramírez I, Carvajal F, Biolley E, Leiva L. 2001. Nutrición de yodo en escolares de cuatro zonas de Chile en el año. Rev Med Chile 2003; 131: 1391-1398.
- Muzzo S, Leiva L, Ramírez I, Carvajal F, Biolley E. 2005 Nutrición de yodo en escolares de una zona con alta ingesta de yodo (Calama) comparada con zona de ingesta normal (Punta Arenas). Rev Chil Nutr 32: 28-35.
- Harvey RP, Hamby DM, Palmer TS. 2004 A modified ICRP 66 iodine gas uptake model and its parametric uncertainty. Health Phys 87 (5): 490-506.
- Lavin N. 1994. Thyroid Disorders in Children. En Lavin L., Manual of Endocrinology and Metabolism. De Little Brown and Comp. Boston USA, 2ed., pp 415-416.
- Mahoney PC. 1987. Differential Diagnosis of Goiter. Pediatr Clin North Am 34: 891-900.
- Studer H, Gerb H. 1991. Pathogenesis of non toxic diffuse and nodular goiter. En Werner and Inglar's The Thyroid. Edit. L. Braverman R, Utiger JB. Lippincot Co.
- Teng W, Shan Z, Teng X, Guan H, et al. 2006. Effect of iodine intake on thyroid diseases in China. N England J Med 354: 2783-2793.
- Toulis KA, Anastasilakis AD, Tzellos TG, Goulis DG, Kouvelas D. 2010 Selenium supplementation in the treatment of Hashimoto´s thyroiditis: a systematic review and a meta-analysis. Thyroid 20 (10): 1163-1173.
- Kohrle J, Jakob F, Contempré B, Dumont JE. 2005. Selenium, the thyroid, and the endocrine system. Endocrine Rev 26: 944-984.
- Nekano A, Watanabe M, Lida T, Kuroda S, et al. 2007. Apoptosis-induced decrease of intrathyroidal CD4+CD25+ regulatory T cells in autoimmune thyroid diseases. Thyroid 17: 25-31.
- Lauberg P, Pedersen KM, Vestergaard H, Sigurdsoson G. 1991. High incidence of multinodular toxic goiter in elderly population in low iodine intake area vs. high incidence of Grave`s disease in the young in high iodine intake area: comparative surveys of thyrotoxicosis epidemiology in East-Jutland Denmark and Iceland. Intern Med 229: 415-420.
- Ruwhof C, Drexha HA. 2001. Iodine and thyroid autoimmune disease in animal models. Thyroid 11: 427-436.
- Tsatsoulis A, Johnson EO, Andricula M, Kalogera C, Svarna E, Spyroy P, et al. 1999. Thyroid autoimmunity is associated with higher urinary iodine concentrations in an iodine-deficient area of Northwestern Greece. Thyroid 9: 279-283.
- Kondrashova A, Viskari H, Haapala AM, Seiskari T, et al. 2008. Serological evidence of thyroid autoimmunity among schoolchildren in two different socioeconomic enviroments. J Clin Endocrinol Metab 93: 729-734.
- Cappa M, Bizarri C, Crea F. 2011. Autoimmune thyroid diseases en children. J Thyroid Res 2011: 675703
- Papanastasiou L, Vatalas IA, Koutras DA, Mastorakos G. 2007. Thyroid autoimmunity in the current iodine environment. Thyroid 17: 729-739.