Motivos de consulta y cuadros clínicos causantes de hipogonadismo masculino. Elevada frecuencia del hipogonadismo hipogonadotropo funcional del adulto
Enzo Devoto C.1, Lucía Aravena C.1 y Marcia Madariaga A.2
Clinical picture and causes of male hypogonadism in a specialized andrology clinic
1Unidad de Endocrinología, División de Pediatría,
Facultad de Medicina, Pontificia Universidad Católica de
Chile, Santiago, Chile.
2Unidad de Endocrinología, Servicio de Pediatría,
Hospital Guillermo Grant Benavente, Concepción, Chile
3Departamento de Endocrinología, Facultad de
Medicina, Pontificia Universidad Católica de Chile,
Santiago, Chile.
Correspondencia:
Dr. Alejandro Martínez- Aguayo
División de Pediatría,
Escuela de Medicina,
Pontificia Universidad Católica de Chile
Lira 85, piso 5, Santiago, Chile.
Código postal: 8330074
Teléfono: (56-2) 354-3095
Fax: (56-2) 638-5675
E-mail: alemarti@med.puc.cl
Recibido: 14 de Junio de 2012
Aceptado: 19 de Junio de 2012
Background: Congenital hypo gonadotrophic hypogonadism (HH), Klinefelter syndrome and pituitary tumors are the causes of male hypogonadism or testosterone deficiency most commonly referred to endocrinologists. Functional HH, hyperprolactinemia caused by pituitary micro adenomas and aging associated hypogonadism are seldom referred to the specialist. Aim: To report the causes and clinical picture of male hypogonadism cases attended in a special clinic devoted to andrology. Material and Methods: Review of medical records of patients consulting for male hypogonadism in an andrology clinic between 1990 and 2010. We reviewed 237 patients aged 16 to 84 years, referred for sexual dysfunction, male infertility, gynecomastia or suspicion of male hypogonadism. Hypogonadism was confirmed with two serum testosterone values below normal. The cause of consultation was registered and the causing condition was classified according to Swerdlof algorithm. Results: Fifty five percent of the 208 patients aged 20 years or more consulted for sexual dysfunction, whereas 76% of the 29 patients aged less than 20 years consulted for a delayed puberal development. On physical examination, 40% of patients had cryptorchism and 14% had micro orchidism. The causes of hypogonadism were HH in 71.8% of patients (functional HH in 61%, congenital HH in 20%, hyperprolactinemia in 6.5%, non prolactinoma pituitary tumors in 6.5% and aging associated hypogonadism in 5.9%). Twenty eight percent of patients had a hyper gonadotrophic hypogonadism (Klinefelter syndrome in 50.7%, oncologic therapy in 16.4%, idiopathic post pubertal hypogonadism in 13% and others in 19.5%). Congenital HH predominated in patients aged less than 20 years (48.3%) and functional HH predominated in patients aged 20 years or more. Conclusions: There are a high percentage of patients with functional HH in this series of patients consulting a specialized andrology clinic.
Key words: Male hypogonadism, male functional hypogonadotropic hypogonadism, male sexual dysfunction.
Hipogonadismo (H) masculino es la insuficiencia de testosterona (T) y/o de espermatogénesis, su clínica varía según la etapa de la vida del varón. El eugonadismo depende del funcionamiento integrado de los niveles del eje hipotálamo hipófisis testicular (HHT).
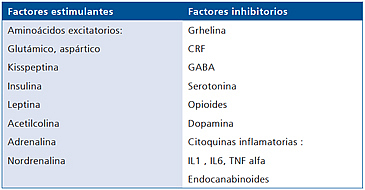
- Nivel hipotalámico: una red neuronal produce hormona liberadora de gonadotrofinas (GnRH), liberada en cantidad y frecuencia horaria (pulsatilidad); modulada por neurotransmisores, neuropéptidos, esteroides, leptina, ghrelina, kisspeptina (Tabla 1).
- Nivel hipofisiario: los gonadotropos estimulados por GnRH sintetizan y liberan en forma pulsátil FSH y LH.
- Nivel testicular: I) intersticial (célula de Leydig): secreción de T estimulada por LH y modulada por insulina, leptina, interleukinas, etc. y II) tubular: espermatogénesis estimulada por FSH y altas concentraciones de T intratesticular; célula de Sertoli: secretora de inhibina y hormona inhibidora mülleriana1. El daño testicular determina H primario (hipergonadotropo) y en hipotálamo y/o hipófisis, H secundario (hipogonadotropo).
Tabla 1. Modulación del GnRH hipotalámico
Existen tipos de H fácilmente reconocibles y habitualmente referidos al endocrinólogo: H congénito con alteración fenotípica genital y ausencia o desarrollo puberal incompleto, o de causa tumoral hipotalámica hipofisiaria que produce notoria sintomatología,
Hay otros tipos de H como el H hipogonadotropo funcional (HHF), algún tipo de hiperprolactinemia y el H asociado al envejecimiento, con menor expresión fenotípica, determinando subdiagnóstico y postergando referencia al especialista.
Para aumentar el diagnóstico de H a nivel hospitalario implementamos un policlínico de andrología (1990-2002), donde además de pacientes con evidente clínica de H, fueran referidos consultantes por espermiograma alterado, disfunción sexual o ginecomastia. Complementamos este universo con pacientes atendidos por los mismos motivos en la consulta privada de los autores (1990-2010).
Objetivos
En una cohorte de H reclutado por un sistema que amplió su detección y estudiados con similar metodología, investigamos en forma retrospectiva el motivo de consulta y el cuadro clínico causante de H.
Pacientes y Método
Durante el período 1990-2010 cumplieron con los criterios exigidos para este estudio 237 pacientes (rango de edad: 16-84 años) 29 menores de 20 años y 208 de 20 años y más. Cien pacientes (42%) fueron referidos desde atención primaria por sospecha de H, y del Instituto de Desarrollo Materno Infantil de la Universidad de Chile (IDIMI) por espermiograma alterado. En la consulta privada atendimos a 137 pacientes (58%) por los mismos motivos que el grupo hospitalario.
Criterio de inclusión: clínica de H con 2 mediciones de T plasmática matutina bajo el límite inferior normal2. Solicitamos LH y FSH conjuntamente con la primera determinación de T ante déficit de virilización, microrquia o si el paciente ya disponía de una T previa disminuida.
Criterio de exclusión
- H normotestosteronémico con alteración exclusiva de la espermatogénesis.
- Diagnóstico de otra endocrinopatía o enfermedad sistémica en cuyo estudio se encontró hipotestosteronemia.
- Resistencia periférica a andrógenos.
Realizamos anamnesis enfocada en desarrollo puberal, genital, vida sexual, fertilidad y síntomas generales de hipoandrogenísmo (fatigabilidad, menor energía, somnolencia, etc); examen físico general y genital: desarrollo de vello pubiano y pene (micropene: < de 2,5 cm de longitud), palpación y medición de volumen testicular con orquidómetro de Prader (volumen normal 15-30 ml)3.
En menores de 20 años consideramos ausencia de desarrollo puberal la no aparición de caracteres sexuales secundarios después de los 18 años, y detención puberal a la aparición de algún carácter sexual secundario sin progresión posterior. En 20 años o más llamamos déficit de virilización total a aquellos sin desarrollo puberal y, déficit parcial a aquellos con algún desarrollo sin evolución posterior.
La consulta por disfunción sexual (DS) incluyó deseo sexual hipoactivo (DSH): ausencia persistente de fantasía y deseo de actividad sexual; disfunción eréctil (DE): incapacidad persistente de lograr y mantener una erección suficiente para una actividad sexual satisfactoria (DSM IV)3.
Laboratorio
RIA de T, LH y FSH realizado en IDIMI y en laboratorio privado que utilizaba las mismas técnicas según programa OMS. Excepcionalmente solicitamos SHBG (globulina transportadora de andrógenos).
Diagnosticamos los cuadros causantes de H aplicando el algoritmo de Swerdloff4 modificado por nosotros (Figura 1).
Consideramos HHF al H sin causa orgánica hipotálamo hipofisiaria, normoprolactinémico, debido a: 1) enfermedad general y fármacos; 2) a endocrinopatía diagnosticada en el curso del estudio del H y 3) idiopático: H sin causa demostrable hasta los 59 años y de duración mayor de 6 meses.
Diagnosticamos H asociado al envejecimiento o “late onset hypogonadism” (LOH), al H hipo o hipergonadotropo en varones sanos de 60 años y más5,6.
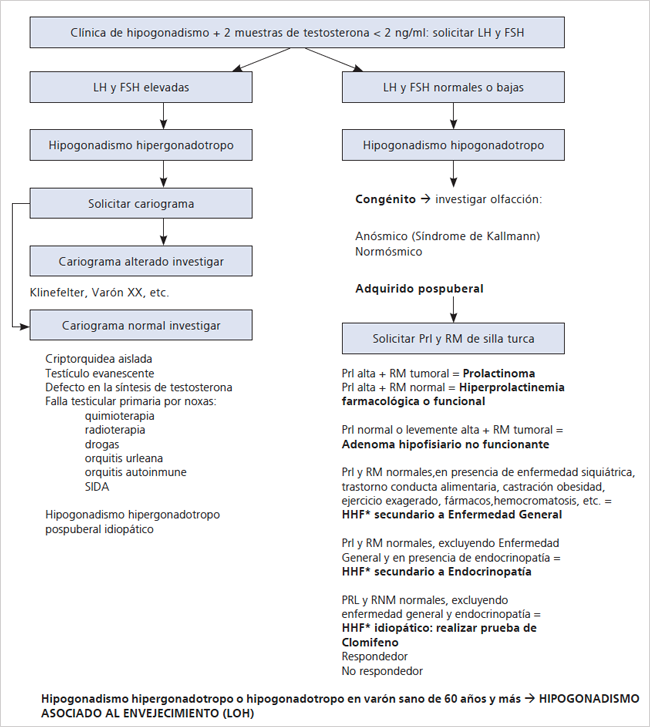
Figura 1. Algoritmo de estudio en hipogonadismo masculino. *HHF: hipogonadismo hipogonadotropo funcional.
Pruebas funcionales
a) prueba de gonadotrofina coriónica (HCG): T basal y a las 72 horas de una dosis de 5.000 U im de HCG (VN alza de 100% de T basal)7, utilizada para diferenciar criptorquidea de anorquia, en H hipogonadotropo sin respuesta al clomifeno y ante sospecha de H mixto (daño hipofisiario y testicular, ejemplo Hemocromatosis); b) prueba de clomifeno: T basal y al día siguiente de 10 días con 100 mg diarios de clomifeno (VN: alza > del 60% de T basal alcanzando el rango normal), que en HHF distinguió aquellos con respuesta normal de los sin respuesta8-10.
No realizamos prueba aguda ni estimulación prolongada con GnRH.
Prueba estadística
Test de t para comparación de medias de una cola y para muestras con igual y diferente varianza según corresponda, test F de Fisher para verificar igualdad de varianza.
Resultados
El motivo mayoritario de consulta en H menor de 20 años fue ausencia del desarrollo puberal y en H de 20 años y más, disfunción sexual (Tabla 2).
Criptorquidea como motivo de consulta, antecedente o hallazgo se presentó en 8,4% (20/237). De estos 20 casos, 12 ocurrieron en menores de 20 años (5 hallazgo de examen físico, 6 antecedente quirúrgico y 1 motivo de consulta) y 8 en los de 20 años y más (3 hallazgo de examen físico, 4 operados y 1 motivo de consulta). Criptorquidea fue hallazgo de examen físico en el 40% (8/20).
Microrquia se presentó en el 14,3% (34/237); en menores de 20 años (n = 8) todas hallazgo de examen. En los de 20 años y más (n = 26): 9 motivo de consulta y 17 hallazgo de exámen físico.
Predominó el HHF sobre otros tipos de H hiper o hipogonadotropo, excepto en menores de 20 años donde lo supera el HHC (Tablas 3 y 4). La causa tumoral (prolactinoma y no prolactinoma) representa el 7,2% (17/237) de esta casuística, rango etáreo: 23-79 años, siendo 47% (8/17) mayores de 50 años.
El HHF idiopático provenía mayoritariamente 50/53 (94,3%) de la consulta privada, correspondiendo a pacientes de mejor nivel socioeconómico con responsabilidades ejecutivas o empresariales. El 29,3 % (12/41) de los respondedores al clomifeno (Tabla 5) presentó eventos vitales significativos (stress laboral, separación, etc.) relacionados con el inicio del cuadro vs el 8,3% (1/12) de los no respondedores (p < 0,01). Ambos grupos tuvieron similar volumen testicular (promedio 25 ml) e IMC (promedio 26 k/m2).
Cuando el motivo de consulta fue alteración del espermiograma, predominó el H hipergonadotropo (Tabla 6).
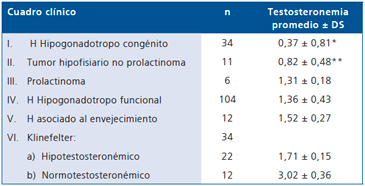
Encontramos mayor hipotestosteronemia en HHC y tumor no prolactinoma. Observamos valores de T sobre 1 ng/ ml (disminución menor del 50% del valor inferior normal) en 3/11 tumor no prolactinoma y en 5/6 prolactinoma (Tabla 7).
Tabla 2. Motivo de consulta según edad en 237 varones con hipogonadismo
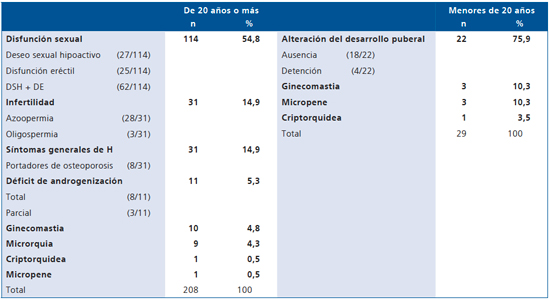
Tabla 3. Cuadros clínicos causantes de hipogonadísmo según nivel de gonadotrofinas en 237 varones
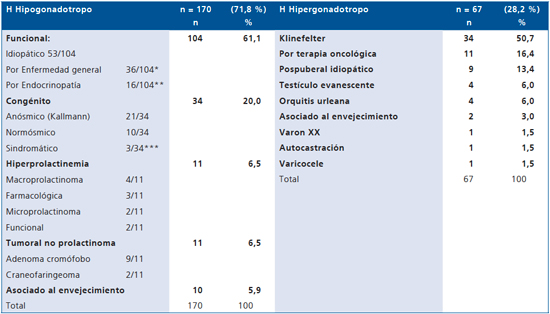
Tabla 4. Clasificación de cuadros clínicos causantes de hipogonadismo (H) según edad en 237 varones
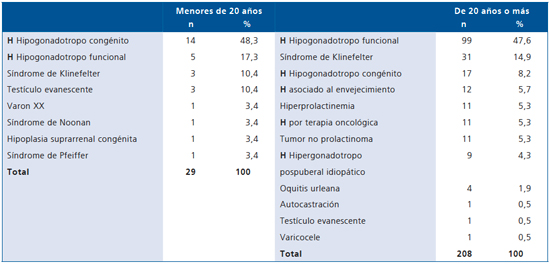
Tabla 5. Clínica y laboratorio del hipogonadismo hipogonadotropo funcional idiopático y respuesta a la prueba de clomifeno
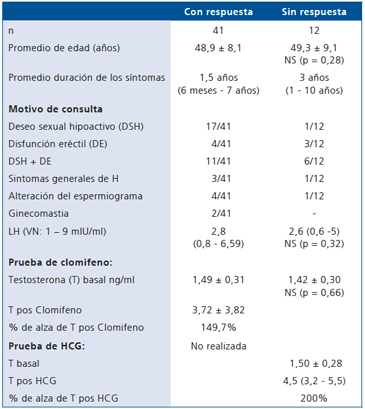
Tabla 6. Alteración del espermiograma y cuadro causante en 31 pacientes cuya consulta por infertilidad condujo
al
diagnóstico de hipogonadismo

Tabla 7. Testosteronemia de los principales cuadros clinicos causantes de hipogonadismo (H)
Discusión
Las normas de la Endocrine Society (ES) del 2006 y 2010 recomiendan 2 mediciones de T bajo el rango normal para diagnóstico de H, ya que la segunda muestra resulta normal en el 30%2. Con ambas T bajas solicitamos LH y FSH, con la excepción señalada en pacientes y método. Seguimos a la ES utilizando la T total como diagnóstico de H, midiendo SHBG solamente ante cuadros asociados con su disminución (hipotiroidismo, obesidad, hipercortisolismo, etc.) o aumento (envejecimiento, hepatopatía, hipertiroidismo, etc.)2,11.
El alto porcentaje de consulta por DS en H de 20 años y más, se debe al déficit del rol activador de T en núcleos cerebrales relacionados con el deseo sexual (área media preóptica, etc.) produciendo DSH, y/o a alteración del mecanismo central de la erección. Fisiológicamente T estimula la secreción de dopamina que libera ocitocina del núcleo hipotalámico paraventricular, la que activa el centro erector sacro. El estímulo neurológico vía nervios cavernosos, induce síntesis de óxido nítrico y cGMP relajándose vasos sanguíneos y sinusoides peneanos desencadenando la erección. La mayor frecuencia encontrada de DSH concomitante con DE se explica por la alteración de este efecto dual de T en libido y erección3,12,13.
La consulta por infertilidad permitió diagnosticar causas tratables como H hipogonadotropo e hiperprolactinemia y en síndrome de Klinefelter, indicar reemplazo con T y sugerir recuperación espermática testicular.
Los síntomas generales de hipoandrogenismo, aunque inespecíficos, condujeron al diagnóstico de un porcentaje significativo de pacientes con H y sospechar la etiología secundaria de osteoporosis presente en algunos de ellos.
Sorprende el alto porcentaje de hallazgo al examen de criptorquidea, coincidente con el 43% que encontramos en un estudio de infertilidad masculina14; hecho similar ocurrió con microrquia. Ambos signos ignorados por el paciente reflejan desconocimiento de su genitalidad normal y/o probable omisión de examen testicular en anteriores consultas médicas.
Ginecomastia fue un signo que permitió sospechar H; en otro trabajo investigando etiología de ginecomastia encontramos H en el 50% de ginecomastia patológica15.
Para diferenciar alteración hipotalámica de hipofisiaria en H hipogonadotropo se ha usado la prueba de GnRH aguda; actualmente no recomendable por no ser diagnóstica16, siendo útil la infusión pulsátil con bomba de GnRH por varios días, con repetidas mediciones de LH y T7. No la realizamos por no disponer en nuestro medio de GnRH, sumado al elevado costo de determinaciones seriadas de hormonas. La recomendación de la ES11 no incluye realizar esta prueba, concordando con lo señalado por otros autores17-19.
En HHC encontramos mayoría del anósmico (síndrome de Kallmann) sobre el normósmico. El primero ocurre en 1/10.000 varones por alteración del gen KAL1 o del FGFR1 (fibroblast growth factor receptor 1)20. La etiología del HHC normósmico es idiopática, habiéndose identificado en algunos casos, alteraciones de genes como los del receptor del GnRH21 y kisspeptina (GPR54)22. Llama la atención que pacientes con HHC consulten después de los 20 años de edad. ¿Dependerá también de factores culturales del paciente y/o ausencia de semiología gonadal en la atención médica?
En H hipogonadotropo adquirido normo o hiperprolactinémico descartamos tumor hipofisiario por RM de acuerdo al algoritmo; algunos sugieren sólo solicitarla bajo los 50 años de edad ya que el tumor sería poco frecuente sobre esa edad23, indicándola solamente ante clínica neurológica y severa hipotestosteronemia (T bajo el 50% del rango inferior normal)11. Encontramos un porcentaje importante de tumor hipofisiario en mayores de 50 años y en otros la T no alcanzó el 50 % de descenso, por lo cual pese a la recomendación anterior realizamos estudio de imagen en todo H hipogonadotropo.
El tumor hipofisiario no prolactinoma causante de H hipogonadotropo adquirido fue de baja frecuencia (4,6%) comparado con 7,8% de Rhoden24 y 12% de Citron25.
El macroprolactinoma es la causa más frecuente de hiperprolactinemia en el varón, existiendo un porcentaje de microprolactinoma, hiperprolactinemia farmacológica, por hipotiroidismo e hiperprolactinemia funcional idiopática, diagnóstico de exclusión de las anteriores.
La hiperprolactinemia tumoral y no tumoral altera la frecuencia de pulsos de GnRH, LH y T, además el prolactinoma puede comprimir gonadotropos y tallo hipofisiario. En el varón se manifiesta por DSH, DE e infertilidad26. La DS se debe a la hipotestosteronemia y a un efecto inhibidor de la Prl en centros cerebrales vinculados a líbido y erección; sugiriéndose además un efecto directo antierectivo peneano de Prl27.
La mayoría del H hipogonadotropo adquirido correspondió a HHF28. En el HHF por enfermedad general y fármacos se altera la regulación del GnRH (Tabla 1) debido a stress, cambios en el tejido adiposo, balance energético, citoquinas inflamatorias y desbalance de neurotransmisores1,29-32. En el HHF por endocrinopatía, el exceso o déficit hormonal (Ej. hormona tiroidea, cortisol, etc.) alteran al eje HHT, transporte y metabolismo de T33-35. Por síndrome metabólico, resistencia insulínica y diabetes mellitus se altera la pulsatilidad del GnRH o se inhibe directamente la secreción Leydigiana36 determinando un HHF; a su vez los efectos metabólicos de la deficiencia androgénica podrían agravar el síndrome metabólico, aumentando grasa visceral, disminuyendo sensibilidad insulínica, etc.
Recientemente se ha descrito el HHF idiopático, constituyente del mayor porcentaje del HHF de nuestra casuística. Aparece en adultos previamente sanos, en quienes se excluye toda otra causa de H; por ejemplo, el HHF por obesidad o diabetes mellitus tipo 2 son HHF secundarios a estos cuadros sistémicos, por lo cual no pueden ser denominados idiopáticos.
En HHF idiopático existe una forma reversible y otra de evolución crónica no reversible llamada por Crowley AHH (adult onset idiopathic hypogonadotropic hypogonadism)37,38. Para diferenciar ambas formas de HHF idiopático creemos que la prueba de clomifeno permite identificar al:
a) Respondedor: Sugiere una disfunción del GnRH potencialmente reversible. En otra publicación describimos la evolución de este grupo de pacientes y su respuesta a terapia con clomifeno10; esta utilidad diagnóstica y terapéutica del clomifeno también ha sido comunicada por otros39-41.
La mayor frecuencia de eventos vitales significativos al inicio del cuadro del grupo respondedor sugiere una génesis psiconeuroendocrina, alterándose factores señalados en la Tabla 1, que al regularse explicarían la reversibilidad.
b) No respondedor: Indistinguible clínicamente y por laboratorio del grupo respondedor. Corresponderían al AHH debido a insuficiencia de la secreción del GnRH, tratable con bomba de GnRH y gonadotrofinas37.
Un porcentaje del varón de 60 años o más, puede presentar LOH por falla primaria testicular (células de Leydig) y/o central neuroendocrina; esta última impide el alza de gonadotrofinas esperable por el déficit Leydigiano42. En nuestra casuística la mayor frecuencia de H hipogonadotropo en LOH se explicaría por predominio del defecto neuroendocrino6.
Existe un problema diagnóstico ante un varón sano sin otra causa de H cercano a los 60 años con defecto neuroendocrino que produce H hipogonadotropo, ¿corresponderá a un LOH hipogonadotropo o a la evolución de un HHF idiopático? Nos parece que separarlos en entidades diferentes sólo por un límite arbitrario de edad debería perfeccionarse.
En H hipergonadotropo la causa principal fue síndrome de Klinefelter presente en el 1% de la población general, 3,1% de la infértil y 8% en una publicación de infertilidad masculina de nuestro grupo14. La mayoría consultó después de los 20 años, seguramente diagnosticable más tempranamente de realizarse de rutina examen testicular. El daño Leydigiano y tubular es evolutivo, lo que explica que más del 50% de nuestros pacientes presentaran gonadotrofinas elevadas con T normal (insuficiencia Leydigiana compensada) al momento del diagnóstico43.
El efecto gonadotóxico (radio y quimioterapia) y quirúrgico del tratamiento oncológico fue la segunda causa del H hipergonadotropo; la mayoría consultó espontáneamente, siendo deseable que hubiesen sido referidos44.
El H hipergonadotropo pospuberal idiopático puede ser autoinmune y presentarse aisladamente como en falla ovárica prematura45 o formando parte del síndrome poliglandular autoinmune, asociación ausente en esta serie y en una publicación anterior46.
Que el HHF fuese la principal causa de H de nuestra casuística, creemos que resultó de la investigación de H en pacientes con poca o ninguna alteración fenotípica y síntomas generalmente no referidos al endocrinólogo.
Los resultados sugieren la ventaja de ampliar el espectro de pacientes en quienes se debe investigar H. Confirmado el H, diagnosticar cuadro causante para indicar si procede terapia específica previa al reemplazo con T.
Una limitación de esta publicación es el perfeccionamiento de las técnicas diagnósticas de laboratorio y de imagen utilizadas en 20 años de estudio que creemos no afecta significativamente los resultados.
Agradecimientos
Los autores agradecen a la Sra. María Luisa Aravena Santolaya, bioestadística Pontificia Universidad Católica de Chile, su contribución en el análisis estadístico de los resultados y al Dr. Patricio Contreras por facilitarnos la última edición del Andrology Male Reproductive Health and Dysfunction.
Referencias
- Weinbauer GF, Luetjens CM, Simoni M, Nieschlag E. 2010. Physiology of testicular function. In Nieschlag E, Behre H, Nieschlag S, ed. Andrology. Male Reproductive Health and Dysfunction. Springer Verlag Berlin Heidelberg 3th ed, 11-54.
- Bhasin S, Cunningham G, Hayes FJ, Matsumoto A, Snyder P, Swerdloff RS, Montori V. 2006. Testosterone therapy in adult men with androgen deficiency syndromes : an endocrine society clinical practice guideline. J Clin Endocrinol Metab 91: 1995-2010.
- Kandeel FR, Koussa VKT, Swerdlof RS. 2001. Male sexual function and its disorders : physiology, pathophysiology, clinical investigation and treatment. Endocrin Rev 22: 342-388.
- Swerdloff RS, Boyers SP. 1982. Evaluation of the male partner of and infertile couple: and algorithmic approach. JAMA 2247: 2418.
- Wang C, Nieschag E, Swerdloff RS, Behre H, Hellstrom W, Gooren L, et al. 2009. Investigation, treatment and monitoring of late-onset hypogonadism in males: ISAM, EAU, EAA, and ASA recommendations. Eur Urol 55: 121-130.
- Devoto E. Aravena L. 2004. Hipogonadismo asociado a la senilidad en el varón (climaterio masculino –andropausia– ADAM). Rev Chil Obstet Ginecol 69: 392-398.
- Simoni M, Niechslag E. 2010. Endocrine laboratory. In Nieschlag E, Behre H, Nieschlag S, ed. Andrology. Male Reproductive Health and Dysfunction. Springer Verlag Berlin Heidelberg 3th ed, 111.
- Bardin CW, Ross GT, Lipsett MB. 1967. Site of action of clomiphene citrate in men : a study of the pituitary-Leydig cell axis. J Clin Endocrinol Metab 27: 1558-1563.
- Tenover JS, Matsumoto AM, Plymate SR, Bremmer WJ. 1987. The effects of aging in normal men on bioavailable testosterone and luteinizing hormone secretion : response to clomiphene citrate. J Clin Endocrinol Metab 65: 1118-1126.
- Devoto E, Aravena ML. 2008. Hipogonadismo hipogonadotropo funcional hipotalámico idiopático pospuberal en el varón. Rev Int Androl 6: 89-96.
- Bhasin S, Cunningham G, Hayes FJ, Matsumoto A, Snyder P, Swerdloff RS, et al. 2010. Testosterone therapy in adult men with androgen deficiency syndromes: an endocrine society clinical practice guideline. J Clin Endocrinol Metab 95: 2536-2559.
- Soran H, Wu F CW. 2005. Endocrine causes of erectile dysfunction. Int J Androl 28 : 28-34.
- Traish AM, Guay AT. 2006. Are androgens critical for penile erections in humans?. Examining the clinical and preclinical evidence. J Sex Med 3: 382-407.
- Devoto E, Madariaga M, Lioi X. 2000. Factores causales de infertilidad masculina. Contribución del factor endocrino. Rev Med Chile 128: 184-192.
- Devoto E, Madariaga M, Aravena ML, Lioi X. 2007. Etiología de la ginecomastia. Importancia de no subdiagnosticar una ginecomastia patológica. Rev Med Chile 135: 189-197.
- Crowley WF. 1985. Pulsatil LHRH therapy of the male. In Wagner TOF, ed. TM Verlag-Hamelig, 58.
- Griffin JE, Wilson JD. 2009. Capitulo Testículo. In Kronenberg H M, Reed L P, Melmed Sch, Polonsky K S. Williams Tratado de Endocrinología Vol I. Elsevier Esp SA Madrid 11a ed, 793.
- Bhasin S, Basaria S. 2011. Diagnosis and treatment of hypogonadism in men. Best Pract Res Clin Endocrinol Metab 25: 251-276.
- Young J. 2012. Approach to the male with congenital hypogonadotropic hypogonadism. J Clin Endocrinol Metab 97: 707-718.
- Cadman M, Kim S H, Hu Y, González-Martínez S, Bouloux PM. 2007. Molecular pathogenesis of Kallmann Syndrome. Horm Res 67: 231-242.
- Beranova M, Oliviera LMB, Bedecarrats GY, Schipani E, Vallejo M, Ammini AC, et al. 2001. Prevalence, phenotypic spectrum and modes of inheritance of gonadotropin-releasing hormone receptor mutation in idiophatic hypogonadotropic hypogonadism. J Clin Endocrinol Metab 86: 1590-1596.
- De Roux N. 2006. Receptor and GPR54 inactivation in isolated gonadotropic deficiency. Best Pract Res Clin Endocrinol Metab 20: 515-528.
- Korenman SG. 1998. Therapeutic perspective. Issues in testosterone replacement in older men. J Clin Endocrinol Metab 83: 3435-3443.
- Rhoden EL, Estrada C, Levine L, Morgentaler A. 2003. The value of pituitary magnetic resonante imaging in men with hypogonadism. J Urol 170: 795-798.
- Citron JT, Ettinger B, Rubinoff H, Ettinger VM, Minkoff J, Hom F, et al. 1996. Prevalence of hypothalamic-pituitary imaging abnormalities in impotent men with secondary hypogonadism. J Urol 155: 529-534.
- Danila DC, Klibanski A. 2001. Prolactin secreting pituitary tumors in men. The Endocrinologist 11: 105-111.
- Buvat J. 2003. Hyperprolactinemia and sexual function in men : a short review. Int J Impot Res 15: 373-377.
- Santen RJ. 1999. The testis: function and dysfunction. In Yen SSC, Jaffe RB, Barbieri RL, eds. Reproductive Endocrinology 4th edition, W B Saunders Company Philadelphia, 632-668.
- Casanueva FF, Dieguez C. 1999. Neuroendocrine regulation and actions of leptin. Front Neuroendocrinol 20: 317-363.
- Tena-Sempere M. 2005. Ghrelin: novel regulator of gonadal function.J Endocrinol Invest 28: 26-29.
- Tena-Sempere M. 2006. KISS-1 and reproduction: focus on its role in the metabolic regulation of fertility. Neuroendocrinology 83: 275-281.
- Wolf P, Hamill R, Mc Donald J, Lee L, Nelly M. 1985. Transient Hypogonadotropic Hypogonadism Caused by Critical Illness. J Clin Endocrinol Metab 60: 444-450.
- Donnelly P, White C. 2000. Testicular dysfunction in men with primary hypothyroidism; reversal of hypogonadotrophic hypogonadism with replacement thyroxine. Clinical Endocrinol 52: 197-201.
- Luton J. 1977. Reversible gonadotropyn deficiency in male Cushing disease. J Clin Endocrinol Metab 45: 488-501.
- Veldhuis JD, Sowers JR, Rogol AD, Dufau ML. 1985. Pathophysiology of male hypogonadism associated with endogenous hyperestrogenism: evidence for dual defects in the gonadal axis. N Engl J Med 312: 1371-1375.
- Shabsigh R, Arver S, Channer K S, Eardley I, Fabbri A, Gooren L, et al. 2008. The triad of erectile dysfunction, hypogonadism and the metabolic syndrome. Int J Clin Pract 62: 791-798.
- Nachtigall LB, Boepple PA, Pralong FP, Crowley WF. 1997. Adult-onset idiopathic hypogonadotropic hypogonadism- a treatable form of male infertility. N Engl J Med 336: 410-415.
- Dwyer AA, Hayes FJ, Plummer L, Pitteloud M, Crowley WF. 2010. The long-term clinical follow-up and natural history of men with adul-onset idiophatic hypogonatropic hypogonadism. J Clin Endocrinol Metab 95: 4235-4243.
- Guay AT, Jacobson J, Pérez JB, Hodge MB, Velásquez E. 2003. Clomiphene increases free testosterone levels in men with both secondary hypogonadism and erectile dysfunction: who does and does not benefit?. Int J Impot Res 15: 156.
- Whitten SJ, Nangia AK, Kolettis PN. 2006. Select patients with hypogonadotropic hypogonadism may respond to treatment with clomiphene citrate. Fertil Steril 86: 1664-1668.
- Silicani Ribeiro R, Abucham J. 2009. Recovery of persistent hypogonadism by clomiphene in males with prolactinomas under dopamine agonist treatment. Eur J Endocrinol 161: 163-169.
- Morales A, Lunenfeld B. 2002. Investigation, treatment and monitoring of late-onset hypogonadism in males. Official recommendations of ISSAM. The Aging Male 5: 74-86.
- Lanfranco F, Kamisschke A, Zitzmann M, Nieschlag E. 2004. Klinefelter syndrome. Lancet 364: 273-283.
- Lackner JF, Mark I, Schatzl G, Marberger M, Kratzig C. 2007. Hypogonadism and androgen deficiency symptoms in testicular cancer survivors. Urology 69: 754-758.
- Betterle C, Zanchetta R. 2003. Update on autoimmune polyendocrine syndromes (APS). Acta Bio Medica 74: 9-33.
- Devoto E, Aravena L, Corvalan L, Lioi X, Munizaga F, Soto N, et al 1990. Síndrome poliglandular autoimmune. Experiencia clínica en 21 casos. Rev Med Chile 118: 635-642.