Síndrome de Cushing por ACTH ectópica. Revisión a propósito de dos casos clínicos
Daniela Eisen J.1, Paulina Silva A.2, Soledad Hidalgo V.2 y Néstor Soto I.2
Cushing syndrome caused by ectopic ACTH secretion. Report of two cases
1Residente Medicina Interna, Hospital Clínico San Borja Arriarán, Universidad de Chile-Campus Centro.
2Unidad Endocrinología y Diabetes, Hospital Clínico San Borja Arriarán.
Correspondencia:
Dra. Daniela Eisen J.
Servicio Medicina Interna, Hospital Clínico San Borja Arriarán.
Teléfono: 562-2-5748601.
E-mail: eisendaniela@gmail.com
Recibido: 31 de agosto de 2013
Aceptado: 16 de septiembre de 2013
Twelve percent of Cushing syndromes (CS) are caused by ectopic ACTH secretion. We report two cases of the condition. A 57 years old woman with an ectopic CS caused by a bronchial carcinoid tumor. After the tumor excision, the patient had a favorable evolution. A 63 years old woman consulting for cough, dyspnea and weight loss causes by a small cell lung cancer. The patient presented hyperglycemia, hypokalemia and metabolic alcalosis. The laboratory showed a severe hypercortisolism with elevated ACTH levels. The metabolic condition did not subside after the first course of chemotherapy and the patient died due to an infectious complication.
Key words: Cushing syndrome, ectopic ACTH, small cell lung cancer.
El síndrome de Cushing (SC) originado por secreción ectópica, no hipofisiaria, de ACTH (SCAE) es infrecuente, representando aproximadamente el 12% de los SC1. Cerca de la mitad de los SCAE corresponden a tumores pulmonares, tales como el carcinoma pulmonar de células pequeñas (CPCP) y el carcinoide bronquial2,3. Otras fuentes incluyen el carcinoide tímico y pancreático, feocromocitoma, gastrinoma, cáncer medular de tiroides y otros tumores neuroendocrinos4.
A continuación presentamos dos casos clínicos de tumores pulmonares productores de ACTH, de distinto tipo histológico, que presentaron un cuadro clínico y evolución diferentes. Se discuten los elementos de diagnóstico y opciones de tratamiento.
Paciente mujer de 57 años, con antecedentes de diabetes mellitus 2 de difícil manejo, diagnosticada 8 años previos, cardiopatía coronaria, hipertensión arterial, dislipidemia mixta, obesidad y esteatosis hepática no alcohólica. Presentaba historia de 8 años de aumento de peso progresivo e hirsutismo.
Fue derivada desde el Hospital de Punta Arenas con los siguientes exámenes: Cortisol plasmático AM: 14,97 μg/dl (5-25), Cortisol PM: 16,53 μg/dl (5-25), Cortisol libre urinario en 24 h: 890 μg/24 h (20-90), Cortisol post-dexametasona 1 mg: 11,8 μg/dl, ACTH: 39,6 pg/ml (< 46), PRL, TSH y T4 libre dentro de rangos normales. Radiografía de columna lumbar con fractura por aplastamiento de L1-L2. Tomografía computada (TC) de abdomen y de silla turca sin hallazgos patológicos.
Al ingreso destacaba PA: 150/90, IMC 35 kg/m2, facies cushingoide, hirsutismo de predominio facial, dorso de búfalo, cifosis dorsal y atrofia muscular generalizada. Laboratorio: colesterol total 241 mg/dl, triglicéridos 687 mg/dl, glicemia 320 mg/dl, cortisol plasmático matinal 18 μg/dl, ACTH basal: 58 pg/ml (10-46) y prueba de supresión con 8 mg de dexametasona: 19,1 μg/dl. Resonancia nuclear magnética (RNM) de silla turca y TC de abdomen no muestran hallazgos patológicos. La TC de tórax describe en el segmento lingular inferior del lóbulo superior izquierdo, a nivel periférico, una imagen nodular de 15 mm, bien delimitado que realza heterogéneamente el contraste (Figura 1). En la fibrobroncoscopía no se evidenciaron lesiones y la citología resultó negativa para células neoplásicas.
Durante la hospitalización requirió altas dosis de insulina NPH 200 U/día más refuerzos pre-prandiales de insulina regular, alcanzando 4 U/kg/día. Además presentó hipertrigliceridemia de difícil control.
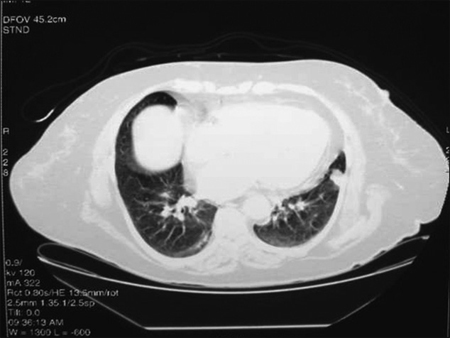 Figura 1
Figura 1
Se derivó al Instituto Nacional del Tórax, realizándose una toracotomía exploradora que evidenció nódulo de 15 mm sin compromiso del parénquima adyacente. La lesión se resecó completamente y el estudio anatomopatológico informó lesión compatible con tumor neuroendocrino, con cromagranina positiva en 30%, sinaptofisina positiva sobre el 90% y pancitoqueratina positiva en 70% de las células neoplásicas. Estos hallazgos morfológicos e inmunohistoquímicos apoyan el diagnóstico de tumor carcinoide.
Se produjo una regresión clínica y bioquímica del cuadro. La ACTH plasmática postoperatoria fue de 28,2 pg/ml y cortisol plasmático matinal de 5,2 μg/dl. La diabetes evolucionó favorablemente, con disminución progresiva del requerimiento de insulina hasta suspensión completa 4 días después de la resección tumoral.
Caso 2
Mujer de 63 años, con antecedentes de tabaquismo crónico (30 paquete/año), depresión mayor y enfermedad pulmonar obstructiva crónica diagnosticada dos meses previo al ingreso. Consultó por 3 meses de tos con estrías de sangre, disnea progresiva y baja de peso de 9 kilos. Además refería poliuria, polidipsia y polifagia. Al momento del ingreso se presentó con apremio respiratorio, taquipnea y uso de musculatura accesoria. En el examen físico destacaba disminución del murmullo pulmonar en la base del hemicampo izquierdo y sibilancias bilaterales. Exámenes de laboratorio iniciales: glicemia 382 mg/dl, kalemia 2,9 mEq/L y alcalosis metabólica no compensada, resto de exámenes normales. La radiografía de tórax mostraba una atelectasia masiva del pulmón izquierdo. En el TC de tórax se observó una lesión pulmonar de aspecto tumoral hiliar izquierda con una gran atelectasia postobstructiva y derrame pleural ipsilateral (Figura 2). La biopsia por fibrobroncoscopía informó un cáncer pulmonar de células pequeñas. Durante la hospitalización se logró un buen control de los síntomas respiratorios; sin embargo, la paciente evolucionó con severas alteraciones hidroelectrolíticas e hiperglicemia resistente al manejo con dosis crecientes de insulina. Se planteó la presencia de un síndrome de Cushing paraneoplásico, por lo que se midió cortisol plasmático matinal: 67 μg/dL (VN < 25), Cortisol libre urinario 24 h = 21.411 μg/24 h (VN = 9-110), ACTH = 100 pg/ml (20-60).
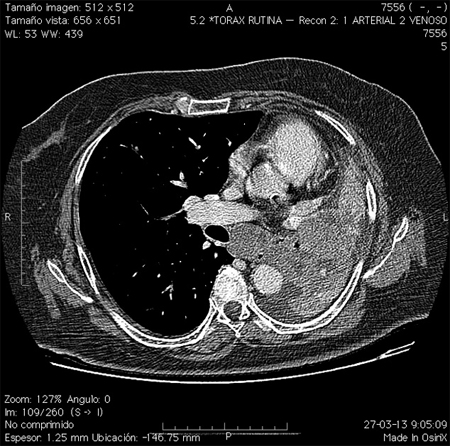 Figura 2
Figura 2
Se inició manejo con ketoconazol (200 mg c/8 h), espironolactona (50 mg c/8 h), insulina NPH hasta 100 U/día más refuerzos de insulina regularen dosis promedio 3 U/kg/día y cargas diarias de hasta 10 g de cloruro potasio asociado a sulfato de magnesio por vía venosa central. Con objetivos paliativos se decidió administrar un primer ciclo de quimioterapia con cisplatino 136 más etopósido 170. Sin embargo, paciente evolucionó con mala respuesta metabólica y posterior desarrollo de complicaciones infecciosas.
Se discutió el caso en el comité de ética y tras acuerdo con la paciente y familia se decide limitar el esfuerzo terapéutico, quedando con hospitalización domiciliaria para manejo del dolor. Falleció una semana posterior al alta.
Discusión
En Chile se han publicado dos series de pacientes con SC, con una frecuencia de 6 y 15% respectivamente, siendo el CPCP, carcinoide bronquial, carcinoide pancreático y carcinoma maligno de timo las etiologías reportadas. Lo que se asemeja a lo descrito en la literatura internacional5,6.
Las manifestaciones clínicas varían considerablemente según la etiología, tal como se evidencia en los casos presentados, en que el primero debutó como un clásico SC, mientras que el segundo se sospechó en el contexto de la severa hipokalemia asociada a diabetes mellitus. La severidad de la hipokalemia está determinada por el exceso de cortisol que provoca una sobresaturación de la enzima 11-betahidroxiesteroide deshidrogenasa II, que normalmente lo convierte en su metabolito inactivo, la cortisona7. Este fenómeno es más frecuente en el CPCP debido a que en estos casos los niveles de ACTH y cortisol tienden a ser mayores3.
El diagnóstico de hipercortisolismo dependiente de ACTH se hace mediante la medición del cortisol libre urinario en 24 h y ACTH plasmática. Si bien lo característico es que ambos se encuentren elevados, la ACTH puede, en algunos casos, ser normal2. Para diferenciar Enfermedad de Cushing de Cushing Ectópico (CE) se realiza el test de supresión con dosis altas de dexametasona (8 mg), teniendo un mejor resultado cuando se suma a otros métodos diagnósticos como el test de estimulación con CRH, ya que en ocasiones, especialmente en tumores carcionides, se puede observar una respuesta de supresión similar a la que se ve en la enfermedad de Cushing. Descartar la localización hipofisiaria con cateterización de los senos petrosos constituye el método más sensible y específico en la actualidad, sin embargo, su disponibilidad es limitada y sus resultados dependen del operador. En la serie del National Institute of Health (NIH), con 90 casos de SCAE, 21% tiene una respuesta de supresión con dexametasona o CRH y sólo hay un falso positivo con la CSP2.
Las imágenes radiológicas para localización de tumor primario deben ser utilizadas posteriores al estudio endocrinológico. Muchas veces es difícil ubicar el tumor, reportándose entre un 12,5 y un 18,8 de casos ocultos (Tabla 1). Frente a la sospecha de un CE el estudio debe iniciarse con una radiografía de tórax y completarse con una TC o RNM de tórax y/o abdomen, considerando que alrededor del 40% de los tumores se encuentra en el pulmón. El octreoscan (cintigrama marcado con octeotrido) es una alternativa de mayor costo, baja sensibilidad y que no ha demostrado identificar lesiones no diagnosticadas previamente con las técnicas de imágenes tradicionales2,3. La tomografía por emisión de positrones con análogos de somatostatina marcados con Ga68 puede ser de utilidad en el diagnóstico de localización8.
El pronóstico se correlaciona con el tipo de tumor subyacente. El CPCP, los carcinoides tímicos, el cáncer medular de tiroides y los gastrinomas se presentan generalmente diseminados al diagnóstico y se asocian a mayor mortalidad a corto plazo2. Carcinoides pulmonares, pancreáticos o apendiculares, así como tumores neuroendocrinos de localización mediastínica tienen una mayor sobrevida2. Complicaciones del hipercortisolismo como infecciones o tromboembolismo pueden empeorar el pronóstico.
Respecto al manejo, el tratamiento quirúrgico definitivo de la neoplasia constituye la alterativa de elección. En los casos en que esto no se logra y previo a la cirugía, el control de la secreción de cortisol puede obtenerse con medidas farmacológicas como el uso de ketoconazol, metopirona o mitotane. La adrenalectomía es una alternativa para pacientes con mala respuesta a la terapia farmacológica.
Conclusión
El SCAE es una entidad heterogénea cuyas manifestaciones clínicas y pronóstico dependen del tipo de tumor secretor de ACTH y de los efectos dados por el hipercortisolismo. Su diagnóstico se sospecha al confirmar un SC ACTH dependiente y diferenciarlo de Enfermedad de Cushing. La localización puede ser difícil e incluso en algunos casos no logra evidenciarse. El tratamiento debe ser quirúrgico pudiendo complementarse con medidas farmacológicas orientadas a disminuir los niveles de cortisol.
Referencias bibliográficas
- Porterfield JR, Thompson GB, Young WF Jr, Chow JT, Fryrear RS, van Heerden JA, et al. 2008. Surgery for Cushing’s syndrome: an historical review and recent ten-year experience. World J Surg May 32 (5): 659-677.
- Illias I, Torpy DJ, Pacak K, Mullen N, Weslwy RA, Nieman LK. 2005. Cushing´s syndrome dueto ectopic corticotropin secretion: twenty years experience at the National Institutes of Health. J Clin Endocrinol Metab 90: 4955-4962.
- Isidori AM, Kaltsas GA, Pozza C, et al. 2006. The ectopic adrenocorticotropin syndrome: clinical features, diagnosis, management and long-term follow-up. J Clin Endocrinol Metab 91: 371-377.
- Forga L, Anda E, Martínez de Esteban JP. 2005. Síndromes hormonales paraneoplásicos. An Sist Sanit Navar 28.
- Contreras P, Araya V. 1995. Cushing syndrome: review of a national caseload. Rev Med Chile; 123; 350-362.
- González G, Arteaga E, Rodríguez JA, López JM, Michaud P, Codner E. 1990. Cushing’s syndrome: the diagnostic and treatment problems in 27 cases. Rev Med Chile 118: 979-987.
- Arteaga E, Fardella C, Campusano C, Cárdenas I, Martínez P. 1999. Persistent hypokalemia after successful adrenalectomy in a patient with Cushing’s syndrome due to ectopic ACTH secretion: possible role of 11beta-hydroxysteroid dehydrogenase inhibition.
J Endocrinol Invest 22: 857-859. - Vucetich N, Carvajal D, Besa C, Jarufe N, Norero E, Fardella C. 2011. Utilidad del PET/CT con análogos de somatostatina marcados con Ga68 en el diagnóstico de síndrome de Cushing secundario a tumor neuroendocrino pancreático. Rev Chil Endocrinol Diabetes; 4: 201-204.