El papel de la microbiota intestinal en el desarrollo
de la obesidad y de la diabetes de tipo-2
Martin Gotteland, PhD.
The role of intestinal microbiota in the development of obesity and type-2 diabetes
Departamento de Nutrición, Facultad de Medicina, Universidad de Chile, Santiago, Chile.
Apoyo Proyecto Fondecyt: 1120290
Correspondencia:
Prof. Martin Gotteland
Dpto. de Nutrición, Facultad de Medicina, Independencia 1027, Universidad de Chile.
E-mail: mgottela@med.uchile.cl
The intestinal microbiota (IM) is a complex consortium including a great number of bacteria, fungi, yeasts, virus and phages. The harmonic crosstalk between the IM, the epithelia barrier and the local immune system determine gut homeostasis in the healthy subject. The IM plays a key role in regulating energy harvest, energy expenditure, fat storage and food intake in the host. Increasing evidence suggests that bacterial composition, functional genes and metabolic activities of the IM are altered in the subjects with obesity or type-2 diabetes (T2D). It appears that dietary fat is also an important factor which affects the IM composition as well as the gut barrier function and the plasma levels of LPS. This metabolic endotoxemia would contribute to the development of systemic low grade inflammation, insulin resistance and T2D. The development of dietary (prebiotics, probiotics) and therapeutic (antibiotics, microbiota transplantation) tools to reestablish the homeostasis of the IM constitute interesting new strategies for the prevention or management of obesity and T2D.
Key words: Microbiota, gut, probiotic, diabetes.
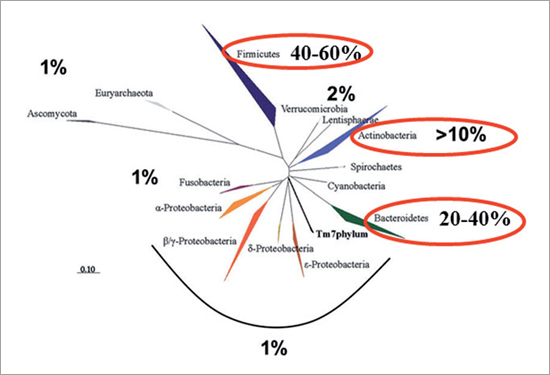
La microbiota intestinal (MI) es un consorcio complejo de más de 1.000 géneros/especies de bacterias además de un gran número de levaduras, virus y fagos aún poco estudiados1,2. Los principales filos bacterianos que entran en la composición de la MI son los Firmicutes y los Bacteroidetes que representan alrededor del 90% de las bacterias totales, y las Actinobacteria; otros filos sub-dominantes tales como las Proteobacteria, Fusobacteria y Verrucomicrobia también están presentes (Figura 1). Se estima que alrededor de 1014 microrganismos, en su gran mayoría (> 99,9%) anaeróbicos, están albergados en el tubo digestivo, principalmente en su parte terminal, el colon. El genoma colectivo de esta microbiota, denominado “microbioma”, tiene más de 5 millones de genes es decir 150 veces más que el propio genoma humano. La secuenciación de este metagenoma derivado de muestras fecales mediante técnicas de alto rendimiento se utiliza actualmente en forma regular para analizar la MI en remplazo de la caracterización individual de los microrganismos. La MI forma con su huésped humano una estrecha simbiosis que es producto de cientos de miles de años de evolución conjunta: ella ejerce funciones metabólicas, nutricionales y de defensa que son indispensables al ser humano mientras que este le entrega nutrientes y condiciones adecuadas para su desarrollo. A pesar de que la composición bacteriana de la MI varia de un sujeto sano a otro, el perfil de genes funcionales asociado a cada microbiota tiende a ser similar. Esto significa que una misma función (la fermentación de ciertos polisacáridos por ejemplo) puede ser desarrollada por poblaciones bacterianas distintas3. Esta redundancia funcional, que probablemente refleja la convergencia evolutiva de taxones no relacionados en el marco del ecosistema digestivo humano, torna muy difícil definir en que consiste una “microbiota saludable”. La MI influencia profundamente la expresión de genes en la mucosa intestinal, en particular aquellos implicados en la defensa del organismo, la regulación de la función intestinal de barrera, la vascularización de la mucosa, los procesos de digestión/absorción de nutrientes y la glicosilación de las proteínas y lípidos constituyentes de las membranas celulares de los enterocitos/colonocitos4. Se estima que la actividad metabólica de la MI es equivalente a la del hígado; esto esta ilustrado por el hecho que gran parte de los metabolitos encontrados a nivel circulante o en la orina son de origen bacteriano. Prácticamente todas las moléculas que llegan al colon, tanto las endógenas y dietarías como las xenobióticas pueden ser metabolizadas por la MI, debido a la gran heterogeneidad de actividades enzimáticas expresadas por las poblaciones bacterianas presentes2. Debido a su impacto fisiológico sobre el resto del cuerpo humano, la MI es actualmente reconocida como un órgano más del superorganismo humano y, como muchos otros órganos, puede ser trasplantada de un individuo a otro. En la actualidad, dichos trasplantes se realizan principalmente para el manejo de los pacientes con infección reiterativas por Clostridium difficile o en aquellos con enfermedades inflamatorias crónicas del intestino5.
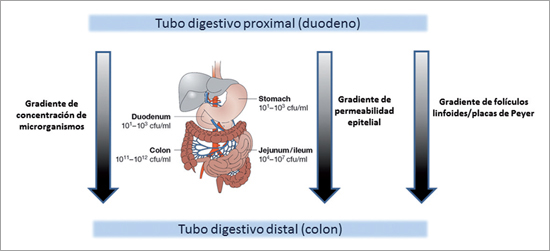
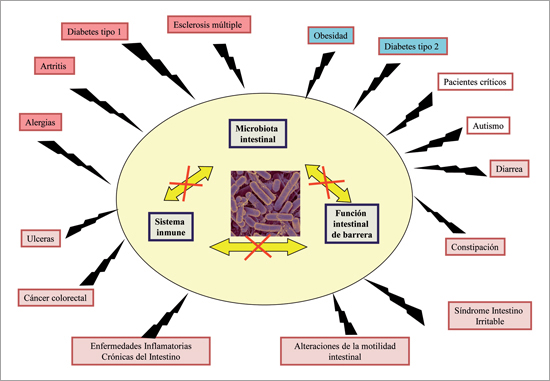
La distribución de la MI a lo largo del tubo digestivo no es homogénea sino que sigue una gradiente próximo-distal; las concentraciones de microrganismos, bajas en el duodeno, aumentan paulatinamente en el yeyuno y el íleo hasta alcanzar sus máximos en el colon (Figura 2). Paralelamente, existe también una gradiente de permeabilidad epitelial (un componente esencial de la función intestinal de barrera): el epitelio duodenal es muy permeable lo que contribuye al intercambio rápido de agua y electrolitos entre lumen y compartimento sistémico que ocurre durante el periodo post-prandial para restablecer la iso-osmolaridad del contenido luminal al plasma6. Sin embargo, esta permeabilidad epitelial disminuye progresivamente en el yeyuno e íleo (lo que significa que se incrementa la función intestinal de barrera) y llega a su mínimo en el colón, lo que le permite al epitelio colónico hacer frente a la alta densidad de microrganismos presentes a este nivel (Figura 2). Finalmente, existe también en el tubo digestivo una gradiente de inmunidad: la densidad y tamaño de los folículos linfoides y de las placas de Peyer, que agregan gran parte de las células inmunes presentes en la mucosa, aumentan desde el intestino proximal hasta el colon (Figura 2)6. La homeostasia del ecosistema digestivo está determinada por el equilibrio harmonioso entre estos tres componentes: microbiota, permeabilidad intestinal e inmunidad local. Cualquier factor o evento que afecte uno de estos componentes repercute sobre los demás e impacta negativamente sobre el organismo entero. Un gran número de enfermedades del sistema digestivo (diarrea, EICI, síndrome de intestino irritable), del sistema inmune (alergia, diabetes de tipo 1, esclerosis múltiple), del sistema nervioso central (autismo, esquizofrenia) o metabólicas (obesidad y DM2) están asociadas con alteraciones de la MI, de la función intestinal de barrera y de inmunidad local digestiva, aun si no se sabe con certeza si dichos cambios son causas o consecuencias de estas patologías (Figura 3). El concepto de prebiótico y probiótico ha sido desarrollado en el marco de la MI; ambos compuestos pueden ser considerados como herramientas nutricionales de interés para restablecer el equilibrio de la MI en los individuos cuya enfermedad está asociada con alteraciones de esta7.
Rescate de energía por la MI y producción de ácidos grasos volátiles
Una de las principales funciones de la MI es su capacidad de extraer la energía proveniente de la fibra dietética, es decir de los hidratos de carbono no digestibles en el intestino delgado (almidón resistente, poli- y oligosacáridos), volviéndola disponible para el organismo y evitando su pérdida en las deposiciones. La fermentación de estos sustratos por la MI libera ácidos grasos volátiles (AGVs), principalmente acetato, propionato y butirato, cuya concentración total puede alcanzar los 130mM en el colon proximal; estos AGVs luego son absorbidos, permitiendo el salvataje de energía8,9. La importancia de este fenómeno es ilustrada por los ratones axénicos que, al carecer de MI, deben consumir 30% más de alimento que los animales convencionales (con microbiota) para lograr un crecimiento comparable. En el ser humano se estima que 7 a 10% del aporte calórico diario proviene de este proceso10. El acetato, en particular, representa un substrato preferencial para la gluconeogénesis y la síntesis de colesterol y de triglicéridos. Además, de su papel en el rescate de energía, los AGVs pueden estimular receptores de ácidos grasos libres acoplados a proteína G: el acetato activa en forma preferencial el FFAR2 (GPR43) mientras que el propionato estimula tanto el FFAR2 como el FFAR3 (GPR41)11. Estos receptores están implicados en la regulación del apetito y del metabolismo energético. La estimulación de FFAR2 promueve el almacenamiento de energía mediante el aumento de la adipogenesis, la inhibición de la lipolisis en los adipocitos y la disminución del gasto energético. Los animales “knockout” para Gpr41 o Gpr43 tienen menor ganancia de peso, mayor sensibilidad a la insulina, menos triglicéridos hepáticos y colesterol plasmático cuando son alimentados con una dieta hipergrasa, comparado con los animales silvestres12. Por otra parte, la administración de una dieta suplementada con el prebiótico oligofructosa en ratas disminuye el consumo de alimentos y la masa grasa epididimal de los animales debido a la disminución de la liberación de grelina, y a la mayor liberación de GLP-1 y PYY por las células enteroendocrinas L del epitelio ileal y colónico13. La densidad de células enteroendocrinas L en el epitelio del colon proximal aumenta debido a la mayor expresión de los factores de diferenciación neurogenina-3 y NeuroD14 por acción de los AGVs provenientes de la fermentación de la oligofructosa14. El consumo de este prebiótico mejora también la glicemia e insulinemia en ayuno de ratas diabéticas e inhibe el apetito de animales alimentados con una dieta hiper-grasa15. Ensayos clínicos realizados en sujetos sanos han confirmado estos hallazgos, mostrando que el consumo de oligofructosa también modula las concentraciones plasmáticas de grelina, GLP-1 y PYY en el ser humano, disminuyendo los cambios post-prandiales de glicemia y la sensación de hambre en estos sujetos16,17. Estos resultados sugieren que la incorporación de prebióticos a la dieta puede ser una estrategia interesante para controlar el apetito mediante la modulación de la MI.
La MI como un factor favorecedor del almacenamiento de grasa
El papel de la MI como un factor favorecedor del almacenamiento de grasa en el organismo ha sido propuesto a partir de los estudios pioneros realizados el equipo de J. Gordon en ratones axénicos18, es decir animales criados desde varias generaciones en un aislador estéril y que no tienen MI. A pesar de consumir 30% más de alimento que los animales convencionales de la misma edad y peso, estos ratones axénicos tienen 42% menos grasa corporal. Su convencionalización (proceso de trasplante de la MI de ratones convencionales donantes a ratones axénicos recipientes) aumenta, en sólo 10 días, su grasa corporal total en un 57% y disminuye correlativamente su consumo de alimentos. Estos animales presentan también una elevación significativa de su glicemia, insulinemia y leptinemia y un incremento de 2,3 veces de su contenido hepático de triglicéridos, debido a la mayor expresión de la acetil-CoA carboxilasa y de la sintetasa de ácidos grasos. La vascularización de la mucosa intestinal de los animales se incrementa luego de la convencionalización, aumentando de dos veces el transporte intestinal y la captación hepática de monosacáridos, comparado con los axénicos19. A este fenómeno hay que agregar el rescate colónico de energía a partir de la fibra dietética que genera AGVs utilizados como substratos para la lipogenesis de novo a nivel hepático18. Los adipocitos de los animales convencionalizados son de mayor tamaño que aquellos de los ratones axénicos, debido a que la actividad de la lipoproteína lipasa (LPL) aumenta un 122% en el tejido adiposo y un 100% en el corazón de estos animales, comparados con los axénicos. La mayor actividad LPL se debe a la inhibición por la MI de la Fiaf (“Fasting-Induced Adipocyte Factor”), una hormona expresada constitutivamente en la mucosa intestinal de los ratones axénicos y que actúa como inhibidor circulante de la LPL18. La inhibición de la Fiaf por la MI sería una respuesta evolutivamente conservada puesto que también ha sido descrita durante la convencionalización del pez cebra. La Fiaf, por lo tanto, puede ser considerada como un factor clave en la capacidad de la MI de promover el almacenamiento de grasa en los adipocitos del huésped. La inhibición de la LPL por la Fiaf explica porque los niveles de triglicéridos circulantes bajan en los animales convencionales después de la administración intragástrica de aceite de oliva mientras permanecen elevados en los axénicos. En consecuencia, los ratones axénicos alimentados con una dieta hiper-grasa son más resistentes al desarrollo de la obesidad que los animales convencionales21,22; esto se debe además al hecho que tienen una mayor tasa de oxidación de ácidos grasos en su músculo esquelético. La importancia de la interrelación MI/Fiaf ha sido confirmada por el hecho que ratones axénicos “knock-out” para la Fiaf pierden su resistencia a la obesidad mientras que ratones convencionales transgénicos que hiper-expresan Fiaf son más resistentes a la obesidad.
Estos resultados sugieren que, en el marco de la co-evolución MI/huésped, la estimulación del almacenamiento de grasa pudo haber representado una ventaja selectiva para el ser humano en épocas ancestrales cuando era más difícil conseguir alimentos y las hambrunas eran más frecuentes. La MI podría, por lo tanto, ser otro factor asociado al fenotipo ahorrativo del ser humano.
La microbiota intestinal de los sujetos obesos o/y con DT2
Comparado con ratones normopeso, la MI de ratones obesos ob/ob muestra concentraciones de Firmicutes aumentadas en más de un 50% mientras que las de Bacteroidetes disminuyen correlativamente23. A pesar de que las concentraciones colónicas de AGVs sean mayores en los ratones obesos, la cantidad de energía excretada en sus deposiciones es menor, indicando que el proceso de extracción y absorción de energía a partir de los alimentos es más eficiente en el animal obeso que en el normopeso23. Tal situación podría deberse a que el número de genes bacterianos dedicados a la hidrólisis de polisacáridos es mayor en la MI de los animales obesos que en la de los normopeso. Cabe destacar que los ratones axénicos normopeso convencionalizados con MI de ratones obesos almacenan más grasa corporal y ganan más peso que aquellos convencionalizados con MI de ratones normopeso23. Estas observaciones indican que la mayor capacidad de extracción de energía y de almacenamiento de grasa es una característica transmisible en la cual participa la microbiota. La MI del ser humano obeso se comporta en forma similar a la del ratón obeso: el porcentaje de Firmicutes es mayor y el de Bacteroidetes menor, en comparación con los normopeso24. El seguimiento de la MI de voluntarios obesos quienes recibieron una dieta hipocalórica durante un año muestra que a medida que los sujetos pierden peso, la proporción de Firmicutes disminuye mientras que aumenta la de Bacteroidetes24. En sujetos normopeso alimentados con una dieta normo- o hipercalórica, se ha observado que un aumento del 20% de los Firmicutes y una disminución del mismo orden de los Bacteroidetes se asocia con un incremento diario del salvataje de energía equivalente a 150 kcal25. Estimulados por estas observaciones, numerosos estudios realizados en los últimos años han tratado de dilucidar la compleja interrelación entre MI y obesidad en el ser humano. Si bien estos estudios han confirmado la existencia de disbiosis (alteración de la MI) en los obesos, aún no existe un consenso acerca de las poblaciones bacterianas responsables del desarrollo de la obesidad1-3. En termino general la MI de los sujetos obesos presenta una menor biodiversidad que la de los sujetos normopeso. Aquellos individuos con menor biodiversidad tienden a presentar mayor adiposidad, resistencia insulínica, dislipidemia y un fenotipo inflamatorio más pronunciado comparado con aquellos con alta biodiversidad26. Algunos autores han propuesto que la presencia en la MI de concentraciones altas de Staphylococcus aureus y bajas de Bifidobacterium spp. en la infancia podría predecir la futura aparición de sobrepeso u obesidad27.
La presencia de disbiosis también ha sido descrita en animales y sujetos con DM2, los cuales en términos generales tenderían a tener menor abundancia de Bifidobacterium spp. y Faecalibacterium prausnitzii, conocidos por tener actividad anti-inflamatoria. En un estudio reciente combinando análisis metagenómico y clínico (Metagenome-Wide Association Study MGWAS), Karlsson et al, caracterizaron el metagenoma bacteriano fecal de 145 mujeres europeas sanas, pre-diabéticas o diabéticas utilizando una plataforma de secuenciación de alto rendimiento (“shotgun sequencing”) que generaba secuencias de ~100 nucleótidos28. Identificaron secuencias que actuaban como firma (“signature”) de grupos de genes correlacionados (metagenomic clusters) con funciones determinadas, y compararon la frecuencia de estas “signatures” en los sujetos sanos y con DM2. Encontraron que la menor abundancia de clostridia productoras de butirato (Roseburia intestinalis y Faecalibacterium prausnitzii) era altamente discriminante del DM2, en acuerdo con lo descrito por Qin et al. en un estudio metagenómico anterior realizado en China29. Sin embargo, varias asociaciones diferían entre ambos estudios como, por ejemplo en el caso de los sujetos con DM2, el enriquecimiento en L. gasseri y S. mutans observado solo en el estudio europeo y el enriquecimiento en Proteobacteria observado sólo en el estudio chino. En base a sus resultados, Karlsson et al desarrollaron un modelo matemático cuya capacidad predictiva permitió identificar con éxito aquellas mujeres pre-diabéticas. Sin embargo, la aplicación de dicho modelo predictivo a la cohorte china fue menos exitosa, probablemente debido a las diferencias en los clusters metagenómicos utilizados como “signatures” y que diferían entre poblaciones Europea y China a causa de sus diferencias genéticas y de hábitos de vida. Mas allá de su eventual interés predictivo, la importancia de este tipo de estudios reside en que la información que genera pueda facilitar la selección y/o el diseño de una microbiota cuya composición se acerque lo más posible a lo que podría ser una microbiota “sana”, y que luego pueda ser utilizada para “resetear” la MI de individuos en situaciones patológicas30. Este punto esta ilustrado por el reciente ensayo clínico de Vrieze et al.31, que mostró que el trasplante de MI de donantes normopeso sanos a recipientes con síndrome metabólico mediante sonda naso-duodenal mejora su sensibilidad a la insulina. Los autores asocian este mejoramiento al aumento de las concentraciones intestinales de bacterias productoras de butirato y de este AGV, el cual podría regular el metabolismo glucídico y lipídico estimulando el eje intestino-cerebro-hígado a través del sistema nervioso entérico.
Microbiota, dieta alta en grasa y estado inflamatorio
En oposición con la hipótesis que asocia obesidad y disbiosis, otros autores han propuesto que los cambios de MI observados en el sujeto obeso podrían no deberse a la obesidad per se sino que a la mayor cantidad de grasa consumida. Utilizando como modelo ratones “knockout” para RELM-ß (Resistin-like molecule-β), los cuales son más resistentes a la obesidad que los ratones silvestres cuando son alimentados con una dieta alta en grasa, Hildelbrandt et al32, mostraron que dicha dieta aumenta los Firmicutes y Proteobacteria en la MI de los animales mientras disminuye correlativamente los Bacteroidetes, independientemente del fenotipo obeso o no-obeso de los animales. Estos hallazgos indican que el contenido en grasa de la dieta, y no el fenotipo obeso del individuo, es el factor determinante en los cambios en la MI observados en el sujeto obeso. El impacto del contenido en grasa de la dieta sobre la MI y el desarrollo de inflamación de bajo grado ha sido estudiado en profundidad por Cani et al.33. Estos autores demostraron que la administración de una dieta alta en grasas a ratones por cuatro semanas altera su MI, aumentando las bacterias gram-negativas de su MI a expensas de las gram-positivas. Dicha dieta también afecta la función intestinal de barrera de los animales, inhibiendo la expresión de proteínas constitutivas de las uniones estrechas que unen a las células epiteliales intestinales entre si y aumentando la permeabilidad epitelial34,35. Este evento podría ser mediado por la estimulación del Receptor CB1 del sistema endocanabinoide por parte de determinadas poblaciones bacterianas36. Kim et al.37, han observado un aumento de las enterobacteria en la MI de ratones alimentados con una dieta hipergrasa; el LPS de estas bacterias gram-negativas tiene una actividad endotóxica más de 100 veces más intensa que la de los bacteroides, lo cual podría explicar porque, a pesar de estar en concentraciones más bajas que los bacteroides, las enterobacterias podrían tener un efecto pro-inflamatorio mayor en caso de ingresar a la circulación. Los autores observan también que este cambio de la MI se asocia con una mayor grado de fosforilación de Akt y FOXO3 en la mucosa colónica de los ratones, y además con un aumento de la expresión de citoquinas proinflamatorias, de la inducción del Toll-like receptor 4 (TR4), iNOS y COX-2, y de la activación de NF-kB. Estos distintos eventos causan una inflamación colónica y posteriormente la alteración de la función de barrera37, lo cual se traduce en el incremento en 2 a 3 veces en las concentraciones plasmáticas de lipopolisacárido (LPS), un evento denominado “endotoxinemia metabólica”. Es posible que este fenómeno sea también favorecido por la disminución de la actividad fosfatasa alcalina del epitelio intestinal en los sujetos obesos puesto que el papel de esta enzima es detoxificar el LPS que se une al epitelio; la fosfatasa alcalina puede ser inhibida tanto por la grasa dietaría como por la MI36. Los animales con endotoxemia metabólica muestran un incremento de su glicemia e insulinemia en ayunas y un aumento de su peso corporal y de su masa grasa y hepática mientras los niveles de citoquinas proinflamatorias (TNF-α, IL-6, IL-1β, MIP-1) y de marcadores de estrés oxidativo aumentan, tanto en el plasma como en los tejidos adiposo, hepático y muscular. Gran parte de estas alteraciones no son detectadas al administrar antibióticos a los animales, o al utilizar ratones “knockout” para el CD14 (el receptor de LPS), mientras son reproducidas por la infusión subcutánea crónica de LPS34,35. Estos hallazgos confirman, por lo tanto, el papel de la MI y en particular de las bacterias gram-negativas y de su LPS en el desarrollo del estado de inflamación y de resistencia insulínica. La administración dietaría de oligofructosa, que estimula el crecimiento de las poblaciones gram-positivas de Bifidobacterium y Lactobacillus en el colon, en ratones obesos ob/ob protege frente a la alteración de permeabilidad intestinal, disminuyendo la endotoxinemia y el subsecuente aumento de marcadores plasmáticos y tisulares de estrés oxidativo y de inflamación. El efecto protector sobre la función intestinal de barrera es probablemente mediado por la generación de AGVs en el colon durante la fermentación del prebiótico. Estos compuestos estimularían la liberación, por las células enteroendocrinas L del epitelio intestinal, de GLP-2, una hormona digestiva con actividad trófica para la mucosa intestinal38. Estos resultados sugieren que la disminución de los niveles plasmáticos de LPS podría ser una estrategia interesante para controlar los procesos inflamatorios asociados con las enfermedades metabólicas. Sin embargo, considerando los estudios previamente descritos, una limitación para su extrapolación al ser humano es la cantidad suprafisiológica de grasa presente en la dieta de los animales utilizados (70%), que es muy superior a aquella aportada por una dieta normal, aún en sujetos obesos. No obstante, los estudios de Erridge et al, realizados en voluntarios sanos han descrito que la administración de una comida con un alto contenido de grasa aumentaba las concentraciones plasmáticas de LPS, contribuyendo al desarrollo de un estado inflamatorio post-prandial y a la activación de las células endoteliales de los sujetos39. En forma similar, Amar et al, observaron una correlación entre endotoxinemia y el consumo de energía y de grasa en un estudio realizado en 200 varones40. Por otra parte, la alteración de la función intestinal de barrera como un eventual factor favorecedor del paso de LPS en el individuo obeso ha sido analizada en algunos estudios, pero con resultados contradictorios41-43. Los niveles de ARNr 16S en sangre, como un reflejo de la presencia de “bacteriemia metabólica”, han sido determinado en 3.280 sujetos en el marco de un estudio longitudinal sobre resistencia insulínica44. Las concentraciones de ARNr 16S detectadas al inicio del estudio, en su mayoría provenientes de Proteobacteria, eran mayores en aquellos sujetos con adiposidad abdominal que desarrollaron un DM2 durante el periodo de 9 años de seguimiento del estudio, indicando que este parámetro eventualmente podría ser utilizado como un nuevo biomarcador del riesgo de DM2.
Toll Like Receptors, microbiota intestinal y alteraciones metabólicas
Los Toll like receptors (TLR) son receptores del sistema inmune innato que reconocen patrones moleculares asociados a microrganismos patógenos o a comensales de la MI (MAMPs, Microbe-Associated Molecular Patterns), y que están ubicados en la membrana apical o el citoplasma de las células del epitelio intestinal. Su activación induce una repuesta, por ejemplo la liberación de péptidos antimicrobianos o el aumento de la expresión de citoquinas proinflamatorias y de quimioquinas, cuya calidad e intensidad puede variar considerablemente según el patrón molecular que la inició y si este proviene o no de un patógeno. Los TLRs, por lo tanto, son un factor clave en el dialogo entre la MI y el organismo y en la mantención del equilibrio de la MI, evitando el sobrecrecimiento de patógenos y su eventual translocación hacia el compartimento sistémico44. Su importancia para la homeostasia del ecosistema digestivo esta ilustrada por los animales “knockout” que han sido desarrollados para los distintos TLRs. En el caso de los ratones “knockout” para TLR5 (TLR5-/-) (un TLR que reconoce la flagelina de las bacteria), estos animales sufren de hiperfagia y desarrollan un síndrome metabólico con obesidad, hiperlipidemia, hipertensión y resistencia insulinica45. Si bien la restricción calórica disminuye su grado de obesidad, no mejora la resistencia insulinica, indicando que ambas alteraciones ocurren en forma independiente en estos animales. El hecho que el trasplante de MI desde animales TLR5 -/- hacia animales silvestres (TLR5+/+) axénicos reproduzca la hiperfagia y las alteraciones metabólicas en los animales recipientes sugería que los cambios que afectan la MI en los TLR5-/- no son un epifenómeno, sino que un factor contribuyente al desarrollo de las alteraciones metabólicas. En acuerdo con estos resultados, la administración de antibióticos a los animales TLR5 -/- normaliza su consumo de alimentos y mejora su síndrome metabólico. Resultados muy similares han sido descritos con ratones TLR2-/- (que reconoce entre otros el ácido lipoteicoico de las bacterias gram-positivas)46. En estos animales, el desequilibrio de la MI produce las mismas alteraciones metabólicas que en los animales TLR5 -/-, pero sin hiperfagia y con una obesidad más tardía, además de un aumento de la permeabilidad intestinal y de las concentraciones plasmáticas de LPS. Estas alteraciones pueden ser reproducidas en animales silvestres mediante el trasplante de MI.
Conclusiones
Durante los diez últimos años la caracterización y el conocimiento de la MI del ser humano han progresado en forma considerable. Actualmente, la MI es considerada como un actor importante en la regulación del metabolismo energético del organismo, en particular a través del rescate colónico de energía a partir de la fibra dietética y de la regulación del almacenamiento de grasa por los adipocitos. La MI de los obesos y de los pacientes con DM2 está alterada, comparada con aquella de los individuos sanos, y sería más eficiente en la extracción de energía a partir de los alimentos. El aporte de grasa dietaría también altera la composición de la MI, aumentando poblaciones bacterianas gram-negativas y alterando la función intestinal de barrera. Estos eventos conllevan al aumento de las concentraciones plasmáticas de LPS y el consiguiente desarrollo de un estado inflamatorio de bajo grado que facilita la aparición de resistencia insulínica y DM2.El trasplante de MI de sujetos sanos a pacientes con síndrome metabólico normaliza su resistencia insulínica, ilustrando la importancia de la MI en la regulación del metabolismo glucídico y lipídico.
Referencias bibliográficas
- Neish AS. Microbes in gastrointestinal health and disease. Gastroenterology 2009; 136: 65-80.
- Morales P, Brignardello J, Gotteland M. 2010. La microbiota intestinal: Un nuevo actor en el desarrollo de la obesidad. Rev Med Chile 138: 1020-1027.
- Shen J, Obin MS, Zhao L. 2013. The gut microbiota, obesity and insulin resistance Molec Aspects Med 34: 39-58.
- Hooper LV, Wong MH, Thelin A, Hansson L, Falk PG, Gordon JI. 2001. Molecular analysis of commensal host microbial relationships in the intestine. Science 291: 881-4.
- Smits LP, Bouter KE, de Vos WM, Borody TJ, Nieuwdorp M. 2013. Therapeutic potential of fecal microbiota transplantation. Gastroenterology 145: 946-53.
- Turner JR. 2009. Intestinal mucosal barrier function in health and disease. Nat Rev Immunol 9: 799-809.
- Brunser O, Gotteland M. Prebiotics and probiotics in human health: an overview. I: “Bioactive foods in health promotion: probiotics and prebiotic.” Watson R and Preedy V, Ed. Academic press, Kidlingto, UK. 2010.
- Cummings JH, Pomare EW, Branch WJ, Naylor CP, Macfarlane GT. 1987. Short chain fatty acids in human large intestine, portal, hepatic and venous blood. Gut 28: 1221-1227.
- Wong JMW, de Souza R, Kendall CW, Emam A, Jenkins DJA. 2006. Colonic health: fermentation and short chain fatty acids. J Clin Gastroenterol 40: 235-243.
- McNeil NI. 1984. The contribution of the large intestine to energy supplies in man. Am J Clin Nutr 39: 338-342.
- Brown AJ, Goldsworthy SM, Barnes AA, Eilert MM, Tcheang L. 2003. The Orphan G protein-coupled receptors GPR41 and GPR43 are activated by propionate and other short chain carboxylic acids. J Biol Chem 278: 11312-11319.
- Samuel BS, Shaito A, Motoike T, Rey FE, Backhed F. 2008. Effects of the gut microbiota on host adiposity are modulated by the short-chain fatty-acid binding G protein-coupled receptor, Gpr41. Proc Natl Acad Sci USA 105: 16767-16772.
- Delzenne NM, Cani PD, Daubioul C, Neyrinck AM. 2005. Impact of inulin and oligofructose on gastrointestinal peptides. Br J Nutr 93 Suppl 1: S157-S161.
- Cani PD, Hoste S, Guiot Y, Delzenne NM. 2007. Dietary nondigestible carbohydrates promote L-cell differentiation in the proximal colon of rats. Br J Nutr 98: 32-37.
- Cani PD, Neyrinck AM, Maton N, Delzenne NM. 2005. Oligofructose promotes satiety in rats fed a high-fat diet: involvement of Glucagon-Like Peptide-1. Obes Res 13: 1000-1007.
- Cani PD, Lecourt E, Dewulf EM, Sohet FM, Pachikian BD, Naslain D. 2009. Gut microbiota fermentation of prebiotics increases satietogenic and incretin gut peptide production with consequences for appetite sensation and glucose response after a meal. Am J Clin Nutr 90: 1236-1243.
- Parnell JA, Reimer RA. 2009. Weight loss during oligofructosa supplementation is associated with decreased ghrelin and increased peptide YY in overweight and obese adults. Am J Clin Nutr 89: 1751-1759.
- Backhed F, Ding H, Wang T, Hooper LV, Koh GY, Nagy A. 2004. The gut microbiota as an environmental factor that regulates fat storage. Proc Natl Acad Sci USA 101: 15718-15723.
- Stappenbeck TS, Hooper LV, Gordon JI. 2002. Developmental regulation of intestinal angiogenesis by indigenous microbes via Paneth cells. Proc Natl Acad Sci USA 99: 15451-15455.
- Velagapudi VR, Hezaveh R, Reigstad CS, Gopalacharyulu PV, Yetukuri L, Islam S. 2010. The gut microbiota modulates host energy and lipid metabolism in mice. J Lipid Res 51: 1101-1112.
- Backhed F, Manchester JK, Semenkovich CF, Gordon JI. 2007. Mechanisms underlying the resistance to diet induced obesity in germ-free mice. Proc Natl Acad Sci USA 104: 979-984.
- Ley RE, Backhed F, Turnbaugh P, Lozupone CA, Knight RD, Gordon JI. 2005. Obesity alters gut microbial ecology. Proc Natl Acad Sci USA 102: 11070-11075.
- Turnbaugh PJ, Ley RE, Mahowald MA, Magrini V, Mardis ER, Gordon JI. 2006. An obesity-associated gut microbiome with increased capacity for energy harvest. Nature 444: 1027-1031.
- Ley RE, Turnbaugh PJ, Klein K, Gordon JI. 2006. Human gut microbes associated with obesity. Nature 444: 21-28.
- Jumpertz R, Le DS, Turnbaugh PJ, Trinidad C, Bogardus C, Gordon JI, et al. 2011. Energy-balance studies reveal associations between gut microbes, caloric load, and nutrient absorption in humans. Am J Clin Nutr 94: 58-65.
- Le Chatelier E, Nielsen T, Qin J, Prifti E, Hildebrand F, Falony G. 2013. Richness of human gut microbiome correlates with metabolic markers. Nature 500: 541-546.
- Kalliomäki M, Collado MC, Salminen S, Isolauri E. 2008. Early differences in fecal microbiota composition in children may predict overweight. Am J Clin Nutr 87: 534-538.
- Karlsson FH, Tremaroli V, Nookaew I, Bergström G, Behre CJ, Fagerberg B, et al. 2013. Gut metagenome in European women with normal, impaired and diabetic glucose control. Nature 498: 99-103.
- Qin J, Li Y, Cai Z, Li S, Zhu J, Zhang F, Liang S. 2012. Metagenome-wide association study of gut microbiota in type 2 diabetes. Nature 490: 55-60.
- Kootte RS, Vrieze A, Holleman F, Dallinga-Thie GM, Zoetendal EG, de Vos WM. 2012. The therapeutic potential of manipulating gut microbiota in obesity and type 2 diabetes mellitus. Diabetes Obes Metab 14: 112-120.
- Vrieze A, Van Nood E, Holleman F, Salojärvi J, Kootte RS, Bartelsman JF. 2012. Transfer of intestinal microbiota from lean donors increases insulin sensitivity in individuals with metabolic syndrome. Gastroenterology 143: 913-916.
- Hildebrandt MA, Hoffmann C, Sherrill-Mix SA, Keilbaugh SA, Hamady M, Chen YY, et al. 2009. Highfat diet determines the composition of the murine gut microbiome independently of obesity. Gastroenterology 137: 1716-1724.
- Cani PD, Amar J, Iglesias MA, Poggi M, Knauf C, Bastelica D.2007. Metabolic endotoxemia initiates obesity and insulin resistance. Diabetes 56: 1761-1772.
- Cani PD, Bibiloni R, Knauf C, Waget A, Neyrinck AM, Delzenne1 NM. 2008. Changes in gut microbiota control metabolic endotoxemia-induced inflammation in highfat diet–induced obesity and diabetes in mice. Diabetes 57: 1470-1481.
- Cani PD, Neyrinck AM, Fava F, Knauf C, Burcelin RG, Tuohy KM. 2007. Selective increases of bifidobacteria in gut microflora improve high-fat-diet-induced diabetes in mice through a mechanism associated with endotoxinaemia. Diabetologia 50: 2374-2383.
- Everard A, Cani PD. 2013. Diabetes, obesity and gut microbiota. Best Pract Res Clin Gastroenterol 27: 73-83.
- Kim KA, Gu W, Lee IA, Joh EH, Kim DH. 2012. High fat diet-induced gut microbiota exacerbates inflammation and obesity in mice via the TLR4 signaling pathway. PlosOne 7: e47713.
- Cani PD, Possemiers S, Van de Wiele T, Guiot Y, Everard A, Rottier O. 2009. Changes in gut microbiota control inflammation in obese mice through a mechanism involving GLP-2 driven improvement of gut permeability. Gut 58: 1091-1103.
- Erridge C, Attina T, Spickett CM, Webb DJ. 2007. A high-fat meal induces low-grade endotoxemia: evidence of a novel mechanism of postprandial inflammation. Am J Clin Nutr 86: 1286-1292.
- Amar J, Burcelin R, Ruidavets JB, Cani PD, Fauvel J, Alessi MC. 2008. Energy intake is associated with endotoxemia in apparently healthy men. Am J Clin Nutr 87: 1219-1223.
- Brignardello J, Morales P, Díaz E, Romero J, Brunser O, Gotteland M. 2010. Pilot study: alterations of intestinal microbiota in obese humans are not associated with colonic inflammation or disturbances of barrier function. Aliment Pharmacol Ther 32: 1307-1314.
- Leber B, Tripolt NJ, Blattl D, Eder M, Wascher TC, Pieber TR, et al. 2012. The influence of probiotic supplementation on gut permeability in patients with metabolic syndrome: an open level, randomized pilot study. Eur J Clin Nutr 66: 1110-1115.
- Verdam FJ, Fuentes S, de Jonge C, Zoetendal EG, Erbil R, Greve JW, et al. 2013. Human intestinal microbiota composition is associated with local and systemic inflammation in obesity. In press in Obesity [doi: 10.1002/oby.20466].
- Amar J, Serino M, Lange C, Chabo C, Iacovoni J, Mondot S, Lepage P, et al. 2010. Involvement of tissue bacteria in the onset of diabetes in humans: evidence for a concept. Diabetologia 54: 3055-3061.
- Hooper LV, McPherson AJ. 2010. Immune adaptations that maintain homeostasis with the intestinal microbiota. Nat Rev Immunol 10: 159-169.
- Vijay-Kumar M, Aitken JD, Carvalho FA, Cullender TC, Mwangi S. 2010. Metabolic syndrome and altered gut microbiota in mice lacking Toll-like receptor 5. Science 328: 228-231.
- Caricilli AM, Picardi PK, de Abreu LL, Ueno M, Prada P, Ropelle ER. 2011.Gut microbiota is a key modulator of insulin resistance in TLR 2 knockout mice. Plos Biol 9: e1001212.