Evaluación de un ingrediente funcional para el control
glicémico en humanos
Diego Gallegos L.1, Miguel Arredondo O.2, Valeria Candia C.2, Hugo Núñez K.3, Amaya Oyarzún A.4 y Francisco Pérez B.1
Evaluation of a functional ingredient for glycemic control in human
1Laboratorio de Nutrigenómica.
Departamento de Nutrición.
Facultad de Medicina. Universidad
de Chile.
2Laboratorio de Microminerales.
Instituto de Nutrición y Tecnología
de los Alimentos (INTA). Universidad
de Chile.
3Departamento de Agroindustria
y Enología. Facultad de Ciencias
Agronómicas. Universidad de Chile
4Laboratorio de Inmunogenética.
Instituto de Nutrición y Tecnología
de los Alimentos (INTA). Universidad
de Chile.
Correspondencia a:
Dr. Francisco Pérez Bravo
Laboratorio de Nutrigenómica,
Departamento de Nutrición,
Facultad de Medicina,
Universidad de Chile.
Santiago, Chile.
Teléfono: 978 61 35
E-mail: fperez@med.uchile.cl
Recibido: 23-06-2014
Aceptado: 01-10-2014
Introduction: The prevalence of non-transmissible chronic diseases such as obesity, dyslipidemia and type 2 diabetes, among others, have increased worldwide. One way to prevent and/or control them is through bioactive food compounds that can be incorporated as functional ingredients (IF). The IF is a compound IF: apple pomace, opuntia palette, tomato pomace and rice bran. Objective: Assess the functional ingredient (IF) for glycemic control in humans. Subjects and Methods: 48 Subjects, both sexes, aged between 40 and 60. Divided into three groups: non-obese (NO), obese (OB) and diabetic (DM) with 16 subjects per group. Subjects consumed 600 g daily of nonfat yogurt with artificial sweetener. 50% of the subjects in each group received yogurt with IF and 50% without IF for 44 days. Metabolic control of capillary blood glucose was performed weekly, of nutrition every week, as well as basal metabolic control, 22 and 44 with: fasting blood glucose, lipid profile, tolerance test to glucose with 2 point sampling and calculation of HOMA-IR. All analyses were performed at the Institute of Nutrition and Food Technology (INTA), University of Chile. The statistical analysis included measures of central tendency and dispersion. They compared the effect of the intervention vs control using the Mann-Whitney U test for independent samples and the Chi2 test for categorical variables. Results: 15 subjects from the DM group, 16 from OB and 10 from NO completed the experiment. Significant differences were found between the intervention group and the placebo in the obese group, in the weight variation of the basal-22 days, 22-44 and basal-44 days with p = 0.007, p = 0.001 and p = 0.001 respectively, and significant differences in the NO group between the placebo and intervention groups in the variation basal-22 days for HOMA-IR (p = 0.010) and 44 -22 days for LDL (p = 0.045). Conclusion: In this study no significant differences were found for subjects stratified into diabetic, obese and non-obese groups, for the variables: glucose, total cholesterol, triglycerides, LDL, HDL, insulin, after-load glucose, after-load insulin, HOMA-IR and weight. It is necessary to increase the size of the sample, assess the duration of the experiment and improve the design of the IF.
Key words: Functional foods, ingredients, glycemic control, metabolism.
Actualmente, en Chile, la prevalencia de sobrepeso y
obesidad, en conjunto, alcanzan el 64,2%1. La obesidad
es una enfermedad crónica no transmisible
(ECNT)2 que está asociada con muerte prematura3. Determinadas
condiciones ambientales como la dieta más una predisposición
genética incrementan la resistencia a la insulina,
esto, asociado a un progresivo deterioro de la función de las
células beta del páncreas, incrementa los niveles de glicemia
a rangos menores que aquellos que permiten el diagnóstico
de la diabetes tipo 2 (DM2). Estas elevaciones se han denominado
glicemia de ayuno alterada (GAA) e intolerancia a la
glucosa (ITG), que se han asociado a una mayor incidencia
de factores de riesgo cardiovasculares pudiendo ocurrir tanto
en sujetos normales como en aquellos con sobrepeso u
obesidad. La transición de GAA o ITG a DM2 puede durar
años, pero se estima que el 70% de ellos progresarán a dicho
estado4. La obesidad predispone al desarrollo de DM2 y al
síndrome metabólico (SM), la primera, es una enfermedad crónica del metabolismo de los carbohidratos, de las grasas
y las proteínas, caracterizada por un aumento en los niveles
de glicemia de ayuno, la causa, puede ser debida a que las
células del cuerpo se hacen resistentes a la insulina y cerca
del 90% de todos los diabéticos padecen DM2. La IR por si
misma y todos los componentes del SM están asociados con
funciones alteradas en el endotelio y que en última instancia
conducen a enfermedades cardiovasculares (EC)5.
La alimentación juega un papel preponderante en la prevención,
desarrollo, y control de enfermedades crónicas no
transmisibles como: dislipidemias, obesidad, DM2, entre
otras, modulando especialmente los niveles de glicemia y lipemia.
A su vez, los alimentos presentan diversos compuestos
bioactivos que pueden potenciar este control, entre ellos
se encuentran: fitoesteroles, vitaminas, minerales, polifenoles,
proteínas bioactivas, prebióticos, probióticos y fitoquímicos
como: carotenoides, clorofila, curcuminoides, fibra y
fitoestrógenos6.
Los compuestos bioactivos dan origen a lo que se conoce como alimentos funcionales, su definición a nivel mundial es variada y va a depender de los organismos científicos o el consenso de científicos que se establecen en relación a ella. Un alimento funcional se puede obtener ya sea incrementando la concentración de compuestos bioactivos naturalmente presentes en el alimento, agregando un compuesto bioactivo que normalmente no se encuentra en el alimento, o reemplazando un componente del alimento que puede no ser saludable7-9.
Uno de los componentes más utilizados en la planificación dietética es la fibra dietaria la cual se define como polisacáridos, que no contienen almidón, provenientes de la pared celular de las plantas, que resisten la hidrólisis de las enzimas del sistema digestivo humano, los cuales, incluyen: celulosa, hemicelulosa, pectina, s-glucanos, gomas y lignina10. Además, se encuentran sustancias asociadas como: proteínas, cutina, suberina, oxalatos, fitatos, lignina y compuestos fenólicos. La relación entre fibra soluble (FDS) y fibra insoluble (FDI) es de gran importancia, tanto para evaluar sus propiedades funcionales, como para su uso como ingrediente alimentario, dado esto, se ha señalado como recomendable una relación FDS/FDI cercana a 1:2 .
Los principales efectos fisiológicos positivos de la fibra son: controlar la respuesta glicémica postprandial, disminución de los niveles de colesterol, en control de peso la fibra aumentaría la sensación de saciedad y disminuiría el consumo de energía11,12.
Diversos estudios muestran los beneficios de la fibra dietaria, tales como la disminución del riesgo de eventos coronarios en un 12% y muerte coronaria en un 19%13, mejora el perfil glicémico y lipídico y regula el peso corporal14-16. La ingesta de fibra dietética, en especial la de tipo soluble, reduce la concentración de glucosa en el plasma, reduce la hiperinsulinemia y la insulino-resistencia. Sujetos diabéticos que consumen entre 15 y 26 gramos de fibra dietaria/día, requieren menos insulina o menos dosis de hipoglicemiantes orales y tienen un mejor control de su glicemia17-19.
Este estudio analiza los efectos sobre la glicemia de un ingrediente funcional preparado a base de residuos agroindustriales. Estudios previos con la mezcla de componentes funcionales de este tipo no se han descrito. Existe en la literatura un estudio realizado con salvado (afrechillo) de arroz en sujetos diabéticos tipo 1 y 2, mostrando un descenso de los niveles de glicemia en ambos grupos después de su consumo por 7 días20. Nuestros datos previos realizados en modelos animales, (ratas Wistar obesas y no obesas) que consumieron este ingrediente funcional mostraron una disminución significativa de la glicemia y triglicéridos, por lo que podría tener un potencial efecto hipoglicémiante e hipolipémiante21. El objetivo de este estudio fue analizar el efecto del consumo del ingrediente funcional constituido por pomasa de manzana, harina de paleta de tuna, pomaza de tomate y afrechillo de arroz sobre el perfil glicémico en pacientes con DM2, sujetos obesos y controles.
Sujetos y Metodología
El estudio correspondió a un ensayo experimental, exploratorio,
en paralelo, aleatorizado, controlado, ciego. Para
el cálculo del tamaño muestral el cálculo se basó en estudios
previos en población control y diabética con un error alfa
de 0,05, un poder de 90% y se consideraron las variables:
glicemia, colesterol total, triglicéridos, IMC y HDL con una
reducción esperada de un 20 mg/dl, 30 mg/dl, 40 mg/dl, 4
kg/m2 y un aumento de 10 mg/dl respectivamente. El estudio
se realizó con un total de 48 sujetos, de 40 a 60 años. Los
voluntarios (sujetos), usuarios del Centro de Salud Familiar
(CESFAM) Dr. Félix de Amesti, comuna de Macul, fueron
reclutados por nutricionistas del CESFAM. El grupo de sujetos
no obesos estuvo formado por individuos de ambos sexos,
edad de 40 a 60 años, evaluados por IMC menor a 30
kg/m2, sin DM2, con actividad física sedentaria. El grupo de
obesos estuvo formado por: sujetos de ambos sexos, edad de
40 a 60 años, evaluados por IMC igual o mayor a 30 kg/m2,
sedentarios, en tratamiento dieto-terapéutico igual o mayor a
4 meses y controlados en CESFAM y el grupo de pacientes
con DM2 estuvo formado por sujetos de ambos sexos, edad
de 40 a 60 años, sedentarios, con diagnóstico validado por
ficha médica electrónica de CESFAM, en tratamiento dietoterapéutico
igual o mayor a 4 meses, hemoglobina glicosilada
A1c menor 7,0% con examen menor o igual a 3 meses o
glicemia capilar postprandial menor a 180 mg/dl y controlados
en el CESFAM.
Los criterios de exclusión utilizados fueron para el grupo con DM2: tratamiento con insulina, alteraciones gastrointestinales crónicas: intolerancia a la lactosa, síndrome de colon irritable con síntomas de diarrea, años de evolución de la diabetes tipo 2 mayor o igual a 4 años, uso de drogas hipolipemiantes y/o consumo de suplementos de omega-3: eicosapentanoico (EPA) y docosahexanoico (DHA), u otros como chía. En el grupo no obeso y obeso se utilizaron los siguientes criterios de exclusión: alteraciones gastrointestinales crónicas:intolerancia a la lactosa, síndrome de colon irritable con síntomas de diarrea, uso de fármacos hipolipemiantes y/o consumo de suplementos de omega-3: eicosapentanoico (EPA) y docosahexanoico (DHA), u otros como chía. Los 48 sujetos fueron divididos en tres grupos: no obesos 16 sujetos, obesos 16 sujetos y 16 sujetos con DM2. Cada uno de los tres grupos se subdividió en dos grupos y en forma aleatorizada y recibieron un yogurt o yogurt más el ingrediente funciona (IF), formando grupo no obesos de: 8 sujetos con yogurt y 8 sujetos con yogurt más IF, grupo obesos: 8 sujetos con yogurt y 8 con yogurt más IF, por último, el grupo de diabéticos: 8 sujetos con yogurt y 8 con yogurt más IF. La intervención tuvo una duración total de 44 días para cada sujeto. La dosis del ingrediente funcional fue de 250 mg de IF / kg peso corporal.
Ingrediente funcional (IF)
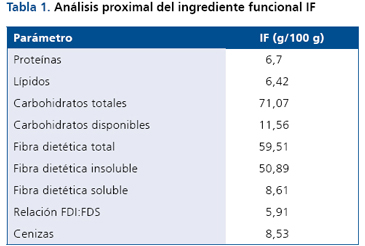
El ingrediente funcional IF utilizado corresponde a una mezcla de: pomaza de manzana (residuo de la elaboración del jugo de manzana, compuesto básicamente de restos fibrosos de la pulpa, cáscara y semilla), harina de paleta de tuna (residuo molido de la cosecha de la tuna, correspondiente a los tallos de la tuna), pomaza de tomate (residuo del procesamiento de tomate para la elaboración de pasta concentrada, constituido principalmente por la cáscara, restos de pulpa y semilla), afrechillo de arroz (residuo de la separación de las capas externas del grano y el germen, realizada en las operaciones de blanqueado y pulido), en una proporción 1:1:1:1. Su humedad corresponde a 7,28 g/100 g y en la Tabla 1 se muestra su análisis proximal, destacando su aporte de fibra dietaria.
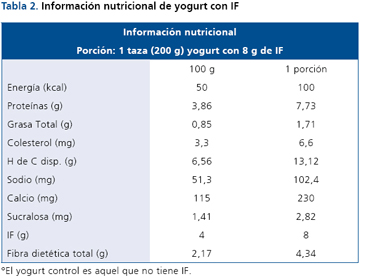
El IF se incorporó a un yogurt natural (vehículo) descremado, con sucralosa y esencia de limón (artificial). Los sujetos consumieron por vía oral 600 g de yogurt/día con IF (grupos de experimental) o sin el (grupos control), con un total de 24 g de IF/día. Distribuido en 200 g por tres veces o en porciones de menor cantidad según comodidad del sujeto en forma diaria, durante 44 días. La entrega del yogurt a los sujetos fue semanal. La Tabla 2, muestra la información nutricional donde se destaca el bajo aporte de hidratos de carbonos disponibles y la entrega de un aporte de fibra que el yogurt en forma normal no lo posee.
Los sujetos estuvieron ciegos en el producto a consumir. A todos los sujetos se les entregó los mismos: envases blancos con tapa, etiqueta de instrucciones, yogurt natural, sabor y aroma del yogurt. Los sujetos fueron agrupados según grupos: no obesos, obesos y diabéticos. A cada sujeto del grupo se le asignó un número de 1 al 16. Se utilizó el programa Decision Analyst STASTS versión 2.0 para generar números aleatorios según grupo. A priori se decidió que los primeros ocho números obtenidos de cada grupo (no obesos, obesos y diabético) corresponden a aquellos sujetos que consumirán el IF y resto de los números según grupo, no consumirán el IF.
Antropometría y datos clínicos
El peso, se determinó con balanza electrónica marca Tanita modelo 2001 W-B con precisión de 0,1 kg, el sujeto se dispuso con pies descalzos, sólo con ropa interior. La talla, se medió con tallímetro marca seca con un precisión de 0,1 cm, en piso llano y horizontal, el sujeto sin zapatos, de espaldas al instrumento con los pies en paralelo. A partir de la antropometría, peso (kg) y talla (m), se calculo IMC.
Todos los sujetos mantuvieron su alimentación habitual y reemplazaron el o los productos lácteos que consumen por el producto lácteo de la intervención, incorporándolo en los diferentes tiempos de comida y/o colación(es). Los voluntarios diabéticos y obesos, mantuvieron su régimen alimentario, según patología, establecido por nutricionistas del CESFAM según lo dictan las normas del Ministerio de Salud a través del programa de salud cardiovascular: manejo alimentario del adulto con sobrepeso u obesidad22, guía clínica de diabetes tipo 223 y norma técnica dislipidemia24. Todos los sujetos mantienen su consumo sus medicamentos: antihipertensivos,hipoglicemiantes orales.
Seguimiento y control de ingesta
Se realizó de dos maneras: contacto telefónico una vez cada dos semanas con pauta de preguntas y auto-registro de control de ingesta que realiza cada sujeto. Un tercer control se realizó durante el control nutricional. Cada tres semanas hubo control rutinario que incluyó: control de peso y de ingesta del yogurt. Al sujeto se le entregó auto-registro de ingesta de yogurt y se le dio nuevos auto-registros de ingesta para tres semanas más. Al final de la intervención los sujetos en estudio, completaron un cuestionario, donde registraron la presencia o ausencia de síntomas (variable cualitativa) que presentaron y mantuvieron durante el consumo de yogurt con o sin IF.
Control metabólico: capilar y de ayuno
A todos los sujetos se les realizó control metabólico cada semana en el CESFAM y/o INTA, mediante tiras reactivas para glicemia con el instrumento Accutrend Plus ®. La punción fue en el dedo anular o cuarto dedo. Se consideró para diabéticos glicemia capilares preprandiales normales a 80- 130 mg/dl y postprandial menor a 180 mg/dl medido dos horas después de iniciada la alimentación25 y preprandiales de 70-110 mg/dl y postprandiales menores a 140 mg/dl para sujetos sin diabetes.
A partir de sangre venosa de ayuno de 10-12 h se evalúo el control metabólico, en tres oportunidades: basal (inicio), 22 y 44 días y se analizaron los parámetros de: glicemia en ayunas (variable continua) mediante glucosa oxidasa, insulinemia (variable continua) mediante RIA, perfil lipídico: colesterol total (CT), triglicéridos (TG), colesterol-HDL (HDL-c), (variables continuas) mediante técnicas colorimétricas estándares y se calculó el colesterol LDL mediante formula de Fridewald, determinación de glicemia en la prueba de tolerancia a la glucosa con muestreo de dos puntos (excepto a grupo de diabéticos) 0 y 120 min posterior a unaingesta de 75 g de glucosa (variable continua). Todos los análisis fueron realizados en el INTA, de la Universidad de Chile. Se determinaron parámetros de insulina-resistencia mediante modelo homeostático de la glucosa (HOMA-IR) (variable continua)26.
Análisis estadístico
Las variables de tipo basal continuas: edad, peso, talla, IMC, se analizaron como estadísticos de medidas de tendencia central y dispersión, según la simetría de la distribución de las mismas. Para la comparación entre grupo intervenido y grupo control se usó la prueba de t-student para muestras independientes o pruebas no paramétricas en caso de no normalidad y heterocedasticidad. Las variables dicotómicas y nominales, se resumen a través de frecuencia y proporciones. Para la comparación entre grupos se usó la prueba c2 o test exacto de Fisher en caso de frecuencias menores a 5. Para evaluar el efecto de la intervención en comparación al grupo control se comparó la variación (delta de cambio) para glicemia de ayuno, insulina de ayuno, insulina postcarga, HOMA-IR, Colesterol total, TAG, HDL, LDL y peso a los tiempos T0, T1 y T2. A través de la prueba de t-student para muestras independientes o estadística no paramétrica. En caso de existir una distribución desbalanceada de las variables de línea de base entre grupo intervenido y control, se controló a través del ajuste de modelo de regresión lineal múltiple. Todos los análisis se realizaron por el principio de intención de tratar, estratificado para la población de diabética, obesa y no obesa. En todos los casos se consideró un valor de p < 0,05 como significativo. Los análisis estadísticos se realizaran con el software SPSS versión 11.5.
Resultados
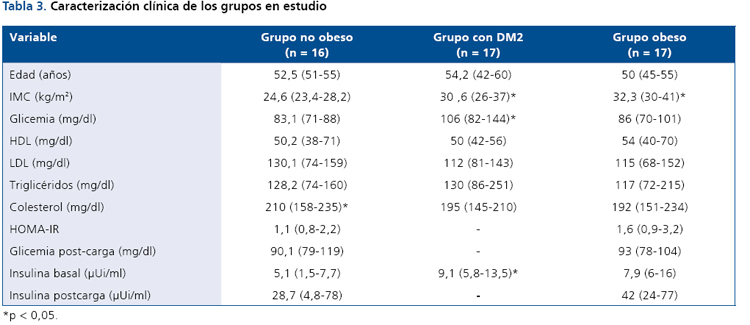
La Tabla 3 muestra la información de características clínicas generales de los tres grupos estudiados. Por diseño el grupo control (no obeso) mostró diferencias estadísticamente
significativas para IMC en relación a los otros grupos.
Además, la glicemia basal e insulinemia basal fue estadísticamente
distinta en el grupo con DM2 respecto a los otros
grupos experimentales.
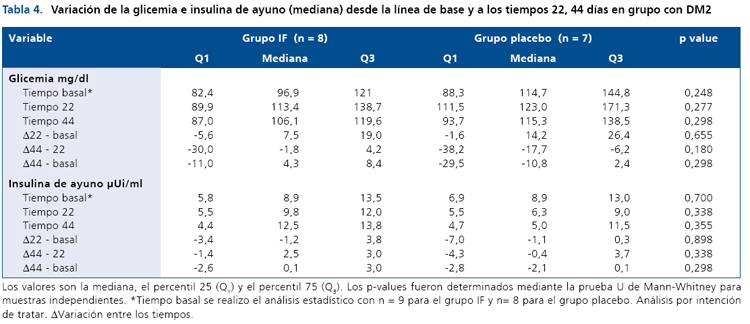
La Tabla 4 muestra la variación de la glicemia e insulinemia de ayuno en el grupo con DM2 que recibió el ingrediente funcional, y el grupo placebo, en el inicio del estudio y en ambos puntos de control (día 22 y día 44). No se observaron diferencias significativas para estas variables, ni para lípidos plasmáticos (dato no mostrado), en el grupo intervenido con el IF. La variable peso (Tabla 5) tampoco se vio afectada por la intervención.
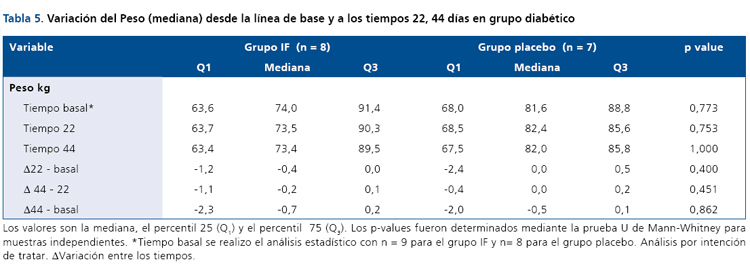
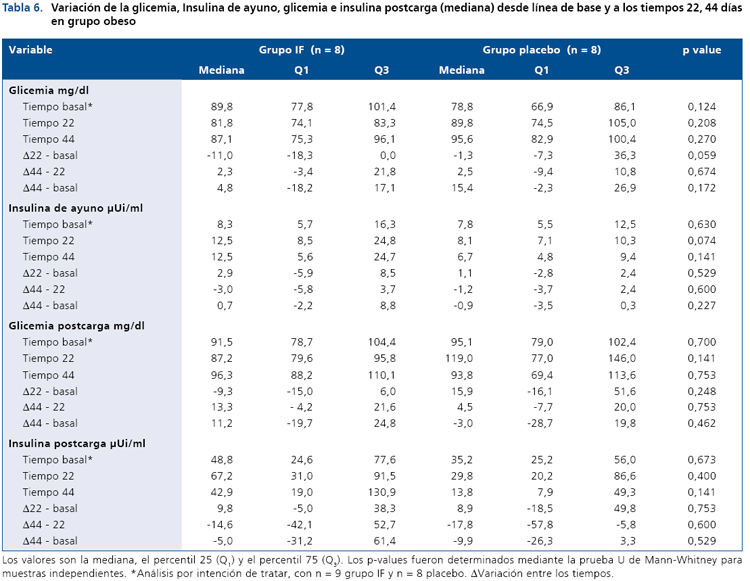
En el grupo obeso, la Tabla 6 resume la información de la glicemia e insulinemia de ayuno y post-carga en el estado basal, 22 y 44 días respectivamente. Para este grupo, no se observaron variaciones importantes durante el período de intervención. Los lípidos plasmáticos tampoco variaron durante la intervención. Sin embargo, la variable peso (Tabla7) si muestra diferencias estadísticamente significativas en el grupo intervenido con el IF respecto al grupo placebo en los períodos de intervención (día 22 vs basal, p <0,007) y día 44 vs basal (p < 0,001).
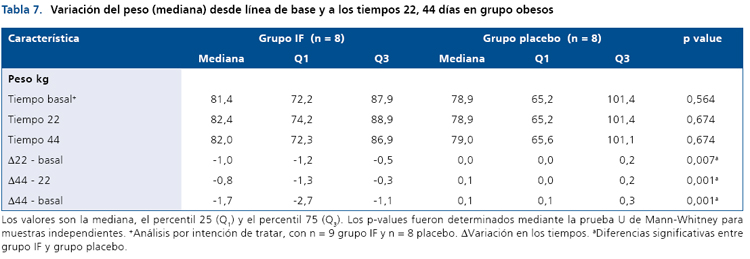
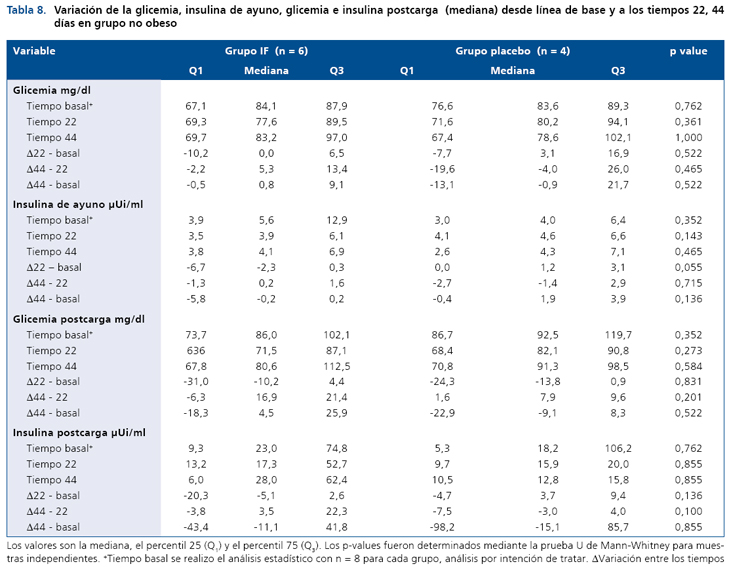
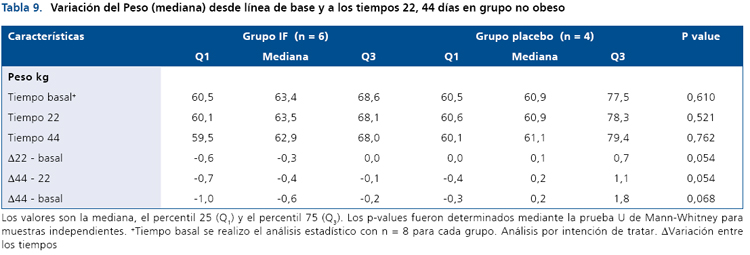
De forma similar, las variables glicemia e insulinemia basal y post-carga no se modificaron en el grupo control (no obeso) durante el período de intervención (Tabla 8). En cuanto a los lípidos plasmáticos sólo se observó una pequeñadisminución en el grupo intervenido vs el grupo placebo en el día 22 respecto al basal (p < 0,045), sin embargo, esta diferencia desaparece al finalizar el estudio el día 44. Por último, la Tabla 9, muestra que la variable peso tiende a bajar en el grupo intervenido, pero esta disminución no alcanza a ser estadísticamente significativa durante la intervención con el ingrediente funcional (p = 0,054).
Discusión
En los resultados de glicemia, no se presentaron diferencias significativas entre el grupo IF y el grupo placebo de todos los grupos. Esto se puede deber a la dosis utilizada de IF, dado que el 60% del IF corresponde a fibra dietética total con un aporte de 14,4 g de fibra dietética/día en el grupo intervenido, pudiendo tener un efecto con una dosis más elevada Además, el tamaño de la partícula de fibra (granulometría) podría modificar los efectos sobre este parámetro. A un mayor tamaño de la fibra podría acelerar más rápidamente el tránsito intestinal y disminuir o enlentecer la absorción de los nutrientes (glucosa, colesterol, entre otros). Por otra parte, hay que considerar que el tamaño de la partícula de fibra podría variar durante el tránsito en el tracto digestivo como resultado de la masticación, digestión y fermentación en el intestino, por lo que el tamaño de las partículas de fibra es una variable que se debe considerar.
Se ha visto que algunos componentes de la matriz de la fibra podrían ser solubilizados (dependiendo del origen de la fibra), antes de la ingestión, por lo que se requiere información adicional y complementaria al tamaño de las partículas de fibra, como son las características de superficie de la fibra, capacidad de hidratación, solubilidad, viscosidad, absorción, unión con iones y moléculas orgánicas. Al ser una mezcla el IF, primero se debe obtener la información, separando por tipo de origen de fibra (pomaza de manzana, pomaza de tomate, harina de paleta de tuna y afrechillo de arroz), para después realizar una evaluación en conjunto con el fin de tener una caracterización de la interacción entre los distintos tipos de fibra dietaria. El origen y obtención de la fibra, determina el tipo de fibra y la cantidad que posee, lográndose diferentes efectos sobre el organismo en parámetros metabólicos tales como: glicemia, colesterol total, triglicéridos, lipoproteínas: HDL, LDL e insulina. A su vez, los efectos del procesamiento de la fibra pueden actuar sobre la funcionalidad de ella mejorándola o disminuyéndola.
Al analizar los resultados de los lípidos sanguíneos (colesterol total, triglicéridos, lipoproteínas: LDL y HDL) estos no presentaron diferencias estadísticamente significativas durante el período de intervención, esto se debe a que la modificación de estos parámetros se logra como mínimo en un período de tres meses después de una intervención. Un estudio previo que evalúo la respuesta cardiovascular mediante el consumo de galletas con inulina (fibra soluble) en un período de un mes de intervención encontró una disminución significativa en colesterol total y triglicéridos27, por lo cual en el caso de nuestro ingrediente funcional, resultaría necesario evaluar cual puede ser el tiempo de intervención más adecuado que permita detectar cambios en los lípidos sanguíneos según el tipo de intervención que se realice, considerando que los cambios ocurren después de tres meses. Se detectó diferencias significativas en el grupo no obeso entre control e intervenido para LDL en la variación entre los tiempos 44-22 días (p = 0,045), pudiéndose deber al cambio del tamaño de muestra, ya que disminuyó a 6 y 4 sujetos, grupo IF e YG respectivamente, por lo tanto, el poder estadístico disminuye a 80% y aumenta el error tipo I (α = 0,01) y el error tipo II (β = 0,02) para 4 sujetos, por lo cual este resultado se puede deber a la falta de precisión y se podría cometer el error tipo I.
El yogurt se caracteriza por contener probióticos como Streptococcus thermophilus sp y Lactobacillus sp, los cuales al ser consumidos en forma periódica podrían modificar la microbiota intestinal (MI). Se ha descrito que la MI cambia con la dieta y que estos cambios modifican vías metabólicas y la expresión de genes. En la última década la proporción de grasa incorporada a la dieta ha ido reemplazando paulatinamente a la fibra dietaria, reduciendo el efecto prebiótico de este último. Estos cambios alimentarios están asociados con un incremento en la permeabilidad intestinal a lipopolisacáridos de las bacterias conduciendo a un estado de insulinoresistencia28. Se sabe que la MI modifica el metabolismo de los lípidos, además se ha descrito que está involucrada en la pérdida de peso. En modelos animales y humanos obesos se ha mostrado una reducción en la concentración colónica del filo Bacteroidetes y un aumento proporcional de Firmicutes comparados con individuos normopeso, junto con ello se han concluido que diferencias en la MI preceden al desarrollo de sobrepeso29. Observaciones en humanos proponen el uso de prebióticos en el manejo de la obesidad para disminuir la glicemia, mejorar la sensibilidad a la insulina, disminuir la ingesta alimentaria y reducir la ganancia de peso30. El IF utilizado en este estudio, al tener un 60% de fibra presenta componentes fermentables por la MI (lactobacillus, bifidobacterias entre otros). Aún con esta variable (probiótico) involucrada, no se encontraron diferencias significativas en HOMA-IR, glicemia insulina, glicemia postacarga e insulina postcarga en el grupo obeso, glicemia e insulina grupo diabético entre intervenido (IF) vs en grupo placebo (YG) y sus respectivas variaciones entre los tiempos. Se debe tener cuenta para estos resultados la dosis de la parte fermentable (prebiótico) de IF junto con el tipo de probióticos que administra, además del tiempo de intervención (exposición), ya que se ha visto que con una combinación de Lactobacillus acidophilus e inulina por 12 semanas, reduce colesterol total y el LDL, sin modificar peso31. Para el caso del grupo no obeso presentó diferencias significativas en la variación del tiempo: 22 días-basal en HOMA-IR e insulina y considerando que el tamaño de muestra disminuyó a 6 y 4 sujetos, grupo IF e YG respectivamente, el poder estadístico disminuye a 80% y aumenta el error tipo I (α = 0,01) y el error tipo II (β = 0,02), por lo cual este resultado se puede deber a la falta de precisión y/o a cambios en la alimentación.
Para peso los resultados no mostraron diferencias significativas entre los tiempos basal, 22 y 44 días en los 3 grupos (diabético, obesos y no obeso), los mismo ocurre con las variaciones de peso entre los tiempos, con excepción del grupo obeso que presento diferencias estadísticamente significativas en las variaciones de peso entre los tiempos, tiempo basal-tiempo 22 días (p = 0,007), tiempo 22 días-tiempo 44 días (p = 0,001) y tiempo basal-44 días (p = 0,001), por lo que el IF favorecería la pérdida de peso, sin lograr diferencias entre los grupos a los tiempos 22 y 44 días, pudiéndose deber al efecto saciador de las proteínas del yogurt en el grupo control (YG). En la saciedad, muchos factores participan en su desarrollo incluyendo las del alimento: la densidad energética, peso, volumen, la composición de macronutrientes, el tamaño de la partícula, satisfacción y la palatabilidad32. Diversos investigadores encontraron que las proteínas son el macronutriente que produce mayor saciedad de los alimentos y que la saciedad esta relacionada con un incremento de la concentración de hormonas anorexígenas: colecistoquinina, Peptido Y y el péptido similar al glucagón (GLP-1) y en una disminución de las hormonas “orexigenas” como la ghrelina33. Anderson, introduce que la fuente de las proteínas (leche, huevo o soya) como determinante de la sensación de saciedad y estas fuentes tienen características únicas que influyen en la saciedad como la coagulación de las proteínas en la leche. Los diferentes efectos de saciedad por las proteínas puede deberse a las propiedades físicas de los alimentos en el intestino independiente de su calidad nutricional. El yogurt (vehículo del IF) tiene un aporte de 3,8 g proteínas/100 g siendo equivalente al de la leche descremada 3 g/100 ml, siendo un poco mayor el aporte en los sujetos intervenidos, pudiendo generar saciedad en ambos grupos, pero se esperaría que el grupo que consume yogurt con IF presentara mayor saciedad otorgada por la fibra, traduciéndose en una mayor pérdida de peso, siendo mayor la baja en el grupo obeso que consumió el IF. Para el grupo no obeso y diabético aunque en todos los tiempos se produce una baja de peso, ésta no es significativa, debido a que son pequeñas bajas de peso.
En relación a los resultados de la reacciones adversas, la distensión abdominal fue uno de los efectos adversos de mayor frecuencia reportada en ambos grupos, pero sin diferencias estadísticamente significativas entre ellos, presentándose independiente de consumo de IF; es esperable encontrar este resultado en el grupo intervenido debido a que la fibra es fermentada por la flora intestinal con la producción gases como metano, hidrógeno, amonio y CO2 34 y el caso del grupo placebo la hinchazón podría ser debida a alimentos del consumo diario, o en una pequeña proporción al yogurt debido a que es bajo en lactosa. El yogurt se caracteriza por un pH ácido, pudiendo generar acidez estomacal considerando que se reemplazaron todos los lácteos consumidos en el día por yogurt. El reflujo gastroesofágico se presentó con mayor frecuencia en el grupo intervenido, siendo influenciado por el cambio de consistencia que presenta la mezcla de yogurt con IF, caracterizada por ser más ligosa y gelatinosa, aumentando el volumen cuando se mezclan, pudiendo inducir una sensación de reflujo gastroesofágico.
El ingrediente funcional posee una capacidad antioxidante (TEAC) 2,42 miliequivalentes trolox/100 g y un contenido de polifenoles totales de 5,51 mg ácido gálico/100 g, siendo su aporte diario para el grupo intervenido (IF) 0,6 y 1,37 respectivamente, presentado un bajo aporte en comparación a otros alimentos como frutilla, maqui, limón, ajo, entre otros35,36, debiéndose a que es una mezcla de residuos industriales de alimentos. Estos aportes bajos probablemente pueden no tener mayor efecto sobre las variables estudiadas.
El diseño del IF se baso en el modelo realizado en animales21 y que se caracteriza por su aporte de fibra dietaría principalmente insoluble debido a que esta compuesto por residuos industriales pomasa de manzana37, harina de paleta de tuna, afrechillo de arroz y pomasa de tomate, pudiéndose mejorar su aporte de fibra soluble mediante la incorporación de: psyllium, goma guar, pectina, inulina, entre otros. De esta manera potenciar el efecto sobre las variables estudiadas, debido a que diversos estudios muestran que la fibra soluble mejora los niveles de glicemia, lipemia e insulinemia38,39. Finalmente, en el presente estudio no se encontraron diferencias significativas para los sujetos estratificados en grupos diabéticos, obesos y no obesos reclutados del CESFAM Dr. Félix de Amesti, para las variables: glicemia, colesterol total, triglicéridos, LDL, HDL, insulinemia, glicemia postcarga, insulina postcarga, HOMA-IR y peso.
Creemos que es necesario enfocar dos posibles correcciones al protocolo utilizado en la evaluación del ingrediente funcional: en primer lugar aumentar el tamaño de muestra dado que esta variable podría ser crítica para disminuir la variabilidad de algunos parámetros y en segundo término el tiempo de intervención utilizado. Es posible que el tiempo del estudio no permita visualizar las variaciones de ciertos parámetros que requieren de un mayor tiempo para modificarse en el plasma, entre ellos se pueden citar a la hemoglobina glicosilada (A1c) y los lípidos. Por último, resultaría muy interesante evaluar la incorporación del ingrediente funcional IF en otro vehículo (galleta, pan integral, etc.) para disminuir el efecto intrínseco propio del yogurt sobre las variables analizadas, mejorar su porte de fibra soluble mediante adición externa y realizar un modelo cruzado.
Agradecimientos
Este proyecto fue financiado a través del fondo INNOVA-
CORFO: 07CT9Z-04.
Referencias bibliográficas
- Ministerio de salud. Resultados de Encuesta nacional de salud. 2009-2010.
- Bray G. 2004. Medical consequence of obesity”. J Clin Endocrinol
Metab 89: 2583-2589.
- Peters A, Barendregt J, Willenkens F, Mackenbach J, Mamun A,Bonneaux L. 2003. Obesity in the adulthood and its consequences for life expectancy: a life-table analysis. Ann Intern Med 138:
24-32.
- Kahn SE. 2003. The relative contribution of insulin resistance
and B cell disfunction to the pathophysioloy of type 2 diabetes.
Diabetologia 46: 3-9.
- Howard G, O’Leary DH, Zaccaro D, et al. 1996. Insulin sensitivi ty
and atherosclerosis: the Insulin Resistance Atherosclerosis Study
(IRAS) Investigators. Circulation 93: 1809-1817.
- Biesalki H, Dragsted L, Elmadfa I, Grossklaus R, Muller M,
Scherenk D, et al. 2009. Bioactive compounds: Definition and
assessment of activity. Nutrition 25: 1202-1205.
- Fereidoon S. 2009. Bolet Functional Foods, Boletin informativo.
International union of food science and technology.
- Siró I, Kápolna E, Kápolna B, Lugasi A. 2008. Functional food.
Product development, marketing and consumer acceptance-A
review. Appetite 51: 456-467.
- Araya H, Lutz M. 2003. Alimentos funcionales y saludables. Rev
Chilena Nutrición 30: 8-14.
- Figuerola F, Hurtado M, Estévez A, Chiffelle I, Asenjo F. 2005.
Fibre concentrates from apple pomace and citrus peel as potenti al
fibre sources for food enrichment. Food Chemistry 91: 395-401.
- Rabio N, Balanza R, Basulto J, Bulló M, Salas-Salvadó J. 2010.
Dietary fiber: influence on body weight, glycemic control and
plasma colesterol profile. Nutr Hosp 25: 327-340.
- Bunzel R, Steinhart H. 2001. Diferulates as structural components
in soluble and insoluble cereal dietary fibre. J of the Science of
Food and Agriculture 81: 653-660.
- Grunberger G, Jen C, Artiss J. 2007. The benefits of early
intervention in obese diabetic patients with FBCxTM-a new
dietary fibre. Diabetes Metab Res Rev 23: 56-62. - http://www.sciencedirect.com/science/article/pii/
S2210740111001422
- Byrd-Williams CE, Strother ML, Kelly LA, Huang TTK. 2009.
Dietary fiber and associations with adiposity and fasting insul in
among college students with plausible dietary reports. Nutrition
25: 896-904.
- Kendall CWC, Esfahani A, Jenkens DJ. 2009. The link between
dietary fiber and human health. Food hydrocolloids 24: 42-48.
- Tucker L, Thomas K. 2009. Increasing total fiber intake reduces
risk of weight and fat gains in women. J Nutr 39: 576-581.
- Salas-Salvadó J, Farrés X, Luque X, Narejos S, Borrell M,
Basora J, et al. 2008. Fiber in Obesity-Study Group. Ef fect of
two doses of a mixture of soluble fibres on body weight and
metabolic variables in overweight or obese patients: a randomiz ed
trial. Br J Nutr 1380-1387.
- Parrillo M, Riccadi G. 2004. Diet composition and the risk of type
2 diabetes: epidemiological and clinical evidence. Br J Nutr 92:
7-19.
- Rodrigues C, Dutra de Oliveira J, Hudari R. 2005. Efecto del
salvado de arroz como dieta en fibra en los niveles séricos de
glucosa de pacientes con Diabetes Mellitus en Brasil. Archivos
latinoamericanos de Nutrición 55: 23-27.
- Oyarzún A, Arredondo M, Pérez F. 2010. Efecto hipoglicemico e
hipolipemico de un ingrediente funcional en rata wistar aliment ada
con dieta alta en grasa”. XIV Congreso de la Asociación
Latinoamericana de Diabetes, Santiago 2010. Revista de la
asociación Latinoamericana de diabetes 18: 208-209.
- Escobar M, Olivares S, Zacarías I. 2002. Programa de salud
Cardiovascular, Manejo alimentario del adulto con sobrepeso u
obesidad. Ministerio de Salud.
- Ministerio de Salud. 2010. Series de guías clínicas Diabetes
Mellitus tipos 2. Ministerio de Salud.
- De la Maza M, Díaz J, Gómez R, Maíz A. 2002. Normas técnicas,
dislipidemias. Ministerio de Salud”.
- American Diabetes Association. 2011. Standars of Medical
Care-2011. Diabetes Care 32: 11-61.
- Matthews DR, Hosker JP, Rudenski AS, et al. 1985. Homeostasis
model assessment: insulin resistance and beta-cell function
from fasting plasma glucose and insulin concentrations in man.
Diabetologia 28: 412-419.
- De Luis D, De la fuente B, Conde R, Gutiérrez S, Morillo M,
Teba C. 2012. Ensayo clínico aleatorizado con una galleta
enriquecida en inulina en el patrón de riesgo cardiovascular de pacientes obesos. Nutrición Hosp 25: 54-59.
- Cani PD, Amar J, Iglesias MA, Poggi M, Knauf C, Bastelica D.
2007. Metabolic endotoxemia initiates obesity and insulin
resistance. Diabetes 56: 1761-1772. - Kalliomaki M, Collado MC, Salminen S, Isolauri E. 2008. Early
differences in fecal microbiota composition in children may
predict overweight”. Am J Clin Nutr 87: 534-538.
- Parnell JA, Reimer RA. 2009. Weight loss during oligofructose
supplementation is associated with decreased ghrelin and increased
peptide YY in overweight and obese adults”. Am J Clin Nutr 89:
1751-1759.
- Roberfroid MB. 2007. Inulin-type fructans: functional food
ingredients”. J Nutr 137 (11 Suppl): 2493-2502.
- Solah V, Kerr D, Adikara C, Meng X, Binns C, Zhu K, et al. 2010.
Differences in satiety effects of alginate- and whey protein-based
foods. Appetite 54: 485-491.
- Veldhorst M, Smeets A, Soenen S, Hochstenbach-Waelen A,
Hursel R, Diepvens K, et al. 2008. Protein-induced satiety: Effects
and mechanisms of different proteins. Physiology & Behavior, 94:
300-307.
- Escudero A, González P. 2006. La fibra dietética. Nutr Hosp 21:
61-67.
- Li H, Wong C, Cheng K, Chen F. 2011. Antioxidant properties
in vitro and total phenolic contents in methanol extracts from
medicinal plant. LWT 41: 385-390.
- Arab F, Alemzadeh I, Maghsoud V. 2011. Determination of
antioxidant component and activity of rice bran extract. Scientia
Iranica 18: 1402-1406.
- Figueroa H, Hurtado ML, Estevez AM, Chiffelle I, Asenjo F.
2005. Fibre concentrates from apple pomace and citrus peel as
potential fibre sources for food enrichment. Food Chemistry
91: 395-401.
- Butt MS, Shahzadi N, Sharif MK, Nasir M. 2007. Guar gum: a
miracle therapy for hypercholesterolemia, hyperglycemia and
obesity. Crit Rev Food Sci Nutr 47: 389-396.
- Ziai SA, Larijani B, Akhoondzadeh S, Fakhrzadeh H, Dastpak A, Bandarian F, et al. 2005. Psyllium decreased serum glucose and glycosylated hemoglobin significantly in diabetic outpatients. J Ethnopharmacol 102: 202-207.