Estruma ovarii maligno
Jocelyn Cortés R.1, Rosemarie Brenet W.2, Edda Spinetto M.3, Silvia Acuña B.2 y María Isabel López B.3
Malignant Struma ovarii
1Residente en Medicina Interna,
Universidad de Valparaíso.
2Endocrinóloga, Departamento de
Endocrinología, Hospital Carlos Van
Buren de Valparaíso.
3Endocrinóloga, Departamento de
Medicina Interna, Universidad de
Valparaíso.
Correspondencia a:
Dra. Jocelyn Cortés Rivera
Von Schroeders #385, depto. 151.
Viña del Mar.
E-mail: jcortesrivera@gmail.com
Recibido: 05-06-2014
Aceptado: 30-06-2014
The Malignant Struma ovarii (SO) is a thyroid carcinoma generated in a mature teratoma, constitutes
0.8-3% of ovarian tumors. Then, two cases will be reviewed. Case 1: 46 year old woman with
no known morbid consulted for right iliac fossa pain requiring exploratory laparotomy with findings
of an ovarian tumor, the biopsy reported mature ovarian teratoma SO type microfocus papillary
thyroid carcinoma. Case 2: 59 year old female with a history of dyslipidemia and knee osteoarthritis
in controls in gynecology since 2010 on the right adnexal mass of cystic type of 5x3 cm. The study
showed only free fluid dissemination ovarian, oofectomía bilateral was performed and biopsy showed
minimally invasive follicular carcinoma (2.8 cm) developed by SO, serosa without invasion of the
ovary. Is derived of endocrinology and the study showed: thyroid stimulating hormone (TSH) 3.3 uIU/
ml; Peroxidase antibody (anti-TPO) and thyroglobulin antibody (antiTG) negative. Ultrasonography
exhibited thyroid nodule of 0.8 x 0.6 cm, hipovascularizado with normal thyroid cintigraphy and cytology
negative for neoplastic cells in fine needle aspiration (FNA). Discussion: It’s a rare condition,
which requires a multidisciplinary approach to treatment.
Key words: Teratoma; Struma ovarii; Thyroid carcinoma.
Los teratomas ováricos constituyen alrededor del 15- 20% de los tumores ováricos, y habitualmente son tumores benignos que provienen de la vía germinal, y se desarrollan a partir de cualquiera de las tres capas germinales. Lo más frecuente es que estén compuestos por ectodermo (piel y fanéreos), pero también pueden formarse a partir de mesodermo y endodermo. Dentro de los teratomas, el Estruma ovarii (EO) se caracteriza por presentar más del 50% de tejido tiroideo en su conformación1-3. Este tumor corresponde alrededor del 0,3-1,2% de todos los tumores de ovario, y al 3-5% de los teratomas maduros, si bien el tejido tiroideo puede estar presente hasta en el 20% de los teratomas1,2.
A menudo los EO son benignos, pero hasta en el 0,8- 3% de los casos se pueden encontrar focos de carcinoma tiroideo. Debido a lo infrecuente de esta enfermedad, no existe evidencia de buena calidad sobre el tratamiento más efectivo, por lo que su manejo resulta controversial. A continuación se presentan dos casos clínicos que resaltan la importancia del trabajo multidisciplinario en esta patología.
Caso 1
Mujer de 46 años, con antecedentes de hipertiroidismo diagnosticado en mayo de 2002 asociado a nódulo sólido de 27 x 18 mm, ubicado en lóbulo derecho de aspecto frío a la cintigrafía. Se decidió tratamiento médico con drogas antitiroideas previo a resolución quirúrgica debido al tamaño del nódulo. Se inicia tratamiento con propiltiuracilo 300 mg al día por 2 meses y posteriormente se cambia por tirozol 30 mg al día debido a discreta elevación de las transaminasas asociado a prurito generalizado. Durante 4 meses se mantiene en tratamiento médico con buena evolución clínica, hasta que en noviembre de 2012, se realiza tiroidectomía subtotal. La biopsia informa hiperplasia nodular tiroidea con linfopatía reactiva inespecífica. Según protocolo la paciente continúa desde entonces en tratamiento con levotiroxina 100 ug/día, manteniéndose clínicamente estable.
En agosto de 2008 se realiza ecotomografía ginecológica de rutina en límites normales. En agosto de 2008 se realiza ecotomografía ginecológica de rutina en límites normales. En tanto que en julio de 2013 consulta en unidad de emergencia por fuerte dolor abdominal, de mayor intensidad en fosa ilíaca derecha. Se le realiza una ecografía de urgencia donde se evidencia un tumor ovárico de aspecto quístico. Ante la sospecha de complicación, se realiza laparotomía exploradora con extirpación del tumor. El informe diferido de la biopsia indica teratoma ovárico maduro de tipo Estruma ovarii, con microfoco de carcinoma papilar de tiroides.
Caso 2
Mujer de 59 años, con antecedentes de dislipidemia y artrosis de rodilla, en controles en ginecología desde el año 2010 por masa anexial derecha de tipo quística de 5 x 3 cm, como resultado de una ecotomografía ginecológica de rutina. En agosto de 2012, una ecotomografía abdominal muestra imagen sólido-quística de 6 cm de diámetro en anexo derecho. Se complementa con ecotomografía transvaginal que muestra imagen de 52 x 34 x 25 mm, la masa presenta numerosos folículos en la periferia con una masa densa muy vascularizada en el centro de 20 x 25 mm. Se decide estudiar con Tomografía axial computada (TAC) de abdomen y pelvis que muestra lesión quística compleja anexial derecha de 6 x 4,4 cm, con líquido libre periovárico y en fondo de saco de Douglas, no se observan signos de diseminación. Ante estos hallazgos y el antecedente de cáncer de ovario en la madre se programa anexectomía laparoscópica para el 27 de septiembre de 2012. En la cirugía se evidencia anexo derecho de aspecto tumoral de aproximadamente 5 cm, de paredes lisas, sin excresencias, con biopsia contemporánea que informa cáncer epidermoide, por lo que se amplía cirugía a anexectomía bilateral. Biopsia diferida muestra carcinoma folicular mínimamente invasivo (2,8 cm) desarrollado en un Estruma ovarii sin invasión de la serosa del ovario (Figura 1).
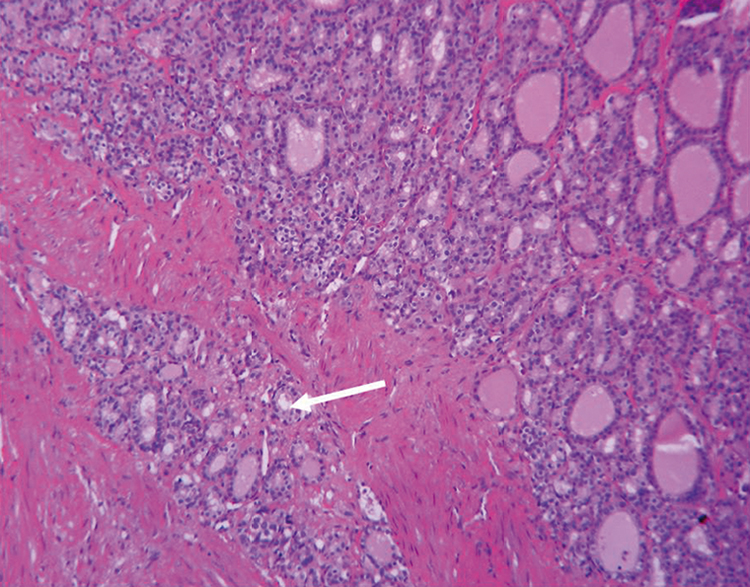
Figura 1. Biopsia con tinción de hematoxilina eosina que muestra un Estruma ovarii con foco de carcinoma folicular de tiroides. Flecha: invasión de cápsula del Estruma ovarii.
Se deriva a endocrinología para evaluación, donde destaca: Hormona tiroestimulante (TSH) 3,3 uIU/ml; Anticuerpo antiperoxidasa (AntitPO) y Anticuerpo antitiroglobulina (antiATG) negativos. Ecotomografía tiroidea mostró nódulo tiroideo de 0,8 x 0,6 cm, hipovascularizado, con cintigrafía tiroidea normal y punción aspirativa con aguja fina (PAAF) negativa para células neoplásicas. Actualmente la paciente se encuentra en control.
Revisión de la literatura
Como lo evidencian estos casos la presentación del EO, es similar a la de otros tumores benignos del ovario, manifestándose principalmente como masa pelviana, en el 90% de los casos unilateral, siendo más frecuente al lado izquierdo4. Otras formas de presentación son las irregularidades menstruales y el dolor pelviano.
Destaca que hasta en el 5% de los casos es evidenciable una producción de hormonas tiroideas, aunque se piensa que lo habitual es una producción subclínica de ellas, si bien se han descrito casos de tirotoxicosis asociados EO en el 5-8%2,5. Por otra parte, alrededor del 15-40% se puede asociar con bocio y de forma anecdótica se registran casos de hallazgos de EO posterior a un rastreo con I131 en casos de carcinoma tiroideo6.
Se denomina EO Maligno, a aquellos casos en que la biopsia informa focos de carcinoma tiroideo, lo que se encuentra en el 0,8 a 3% de los EO4,6. Tanto la determinación de malignidad en muestras de EO como la clasificación histológica de estos tumores, no ha estado ajena a controversia, y no fue hasta 1993, en que Devaney y su equipo definen que los EO Malignos se caracterizan por una arquitectura similar a la encontrada en carcinomas tiroideos en el cuello, donde el incremento de la actividad mitótica, la presencia de atipías y la invasión vascular son considerados criterios de malignidad. Por otra parte, a diferencia del tejido tiroideo cervical, no se puede considerar la invasión de tejidos vecinos como criterio de malignidad, dado la irregular distribución de los tejidos en el interior de un teratoma. De esta forma clasificó a los EO en: Carcinoma papilar (44%), folicular (30%), papilar variante folicular (20%) y otros que en conjunto sólo constituyen el 6%1,7.
Si bien actualmente existe consenso en el diagnóstico histológico del EO Maligno, al igual que en el carcinoma tiroideo cervical existen casos que pueden generar confusión. En estos casos se ha usado como apoyo algunos marcadores de inmunohistoquímica, tales como HBME-1 y Citokeratina 19, que en asociación son altamente sensibles y específicos para el diagnóstico de carcinoma papilar. Otra alternativa es buscar la expresión del gen BRAF, presente en aquellos carcinomas papilares de mal pronóstico8,9.
La metástasis a distancia se observa hasta en el 5%10, habitualmente existe compromiso contralateral del ovario, o vía hematógena a hígado, hueso y pulmón11, y en promedio se presenta a los 4 años desde el diagnóstico, por lo que es importante el seguimiento de estos pacientes12.
Debido a lo infrecuente de esta enfermedad, no existe evidencia de buena calidad sobre el tratamiento más efectivo, se recomienda que el manejo del tumor, sea similar al de otros tumores ováricos, con histerectomía, ooforectomía bilateral y linfadenectomía en mujeres postmenopáusicas o premenopáusicas que no desean mantener la fertilidad3,6,10. En aquellas mujeres que desean mantener la fertilidad se propone oforectomía unilateral y seguimiento exhaustivo. Ahora bien, el manejo de la tiroides es controversial, hay reportes que sugieren tiroidectomía total y ablación con radioyodo, dado que se ha observado en ellos una menor tasa de recidiva1,13,14. Los beneficios de la tiroidectomía total serían descartar lesiones sincrónicas, favorecer la afinidad de las células cancerígenas por I131 y el seguimiento con tiroglobulina. Si bien también se debe considerar los riesgos propios de una tiroidectomía como lesión del nervio recurrente y el hipoparatiroidismo secundario. Por otra parte, la ablación con I131 se recomienda principalmente en metástasis a distancia, tumores mayores a 4 cm, carcinoma papilar con BRAF positivo y carcinoma tiroideo sincrónico, todas condiciones consideradas de mal pronóstico13-15. Así mismo, como el tejido metastásico tiene menor captación de yodo, se ha sugerido también el uso de TSH recombinante para estimular la captación de radioyodo por las células residuales10. Mención aparte, tienen los tumores considerados como microcarcinoma (foco de carcinoma menor a 10 mm), dado que se ha observado una sobrevida a 15 años del 99% sin terapia ablativa con I131 1.
El pronóstico de este tumor, es considerado similar al del carcinoma diferenciado de tiroides, con una sobrevida del 92% a los 10 años1. Se recomienda mantener un reemplazo con tiroxina para lograr TSH entre 0,1-0,5 mU/L al menos los primeros 5 años, y un seguimiento con tiroglobulina hasta 10 años después del diagnóstico1,13,15. Ante sospecha de recaída se debe realizar rastreo con I131.
Discusión
Dado que esta patología es poco frecuente, y que en la literatura existe poca evidencia de buena calidad para su manejo, es importante reconocer esta entidad, y establecer una estrategia de tratamiento individualizada para cada paciente, en conjunto entre ginecólogos, patólogos, cirujanos y endocrinólogos. Por ejemplo, en el segundo caso, según la evidencia disponible se debería complementar el tratamiento con tiroidectomía total y ablación con I131, decisión que no deja de ser controversial, dado los riesgos de la cirugía, que dependen en gran medida de la expertiz del equipo quirúrgico por lo que se beneficiaría de una decisión en conjunto.
Agradecimientos
Dr. Carlos Lozano. Departamento de Anatomía Patológica, Hospital Carlos Van Buren.
Referencias bibliográficas
- Gutiérrez J, Builes C, Vélez A. 2013. Struma ovarii con un foco de micro-carcinoma papilar variante folicular de tiroides: reporte de caso y revisión de la literatura. Rev chil endocrinol diabetes 6: 95-98.
- Sapunar J, Roa J, Meissner A. 2003. Hipotiroidismo primario luego de la resección de un Struma ovarii: Report of one case. Rev Med Chile 131: 785-787.
- Stanojevic B, Dzodic R, Saenko V, et al. 2012. Unilateral follicular variant of papillary thyroid carcinoma with unique KRAS mutatio n in struma ovarii in bilateral ovarian teratoma: a rare case report. BMC Cancer 12: 224.
- Collins A, Bodenner D, Chen C, et al. 2012. Delayed treatment of papillary thyroid carcinoma arising from struma ovarii in a patient with history of bilateral salpingo-oophorectomy: a case report. Endocr Pract 18: E1-4.
- Teale E, Gouldesbrough D, Pecey S. 2006. Graves’ Disease and Coexisting Struma ovarii Struma Expression of Thyrotropin Receptors and the Presence of Thyrotropin Receptor Stimulating Antibodies. Thyroid 16: 791-793.
- Jammah A, Driedger A, Rachinsky I. 2011. Incidental finding of ovarian teratoma on post-therapy scan for papillary thyroid cancer and impact of SPECT/CT imaging. Arquivos Brasileiros de Endocrinologia & Metabologia 55: 490-493.
- Devaney K, et al. 1993. Proliferative and histologically malignant struma ovarii: A clinicopathologic study of 54 cases. International Journal of Gynecological Pathology 12: 333-343.
- Scognamiglio T, Hyjek E, Kao J. 2006. Diagnostic Usefulness of HBME1, Galectin-3, CK19, and CITED1 and Evaluation of Their Expression in Encapsulated Lesions With Questionable Features of Papillary Thyroid Carcinoma 126: 700-708.
- Boutross-Tadross O, Saleh R, Asa A. 2007. Follicular Variant Papillary Thyroid Carcinoma Arising in Struma ovarii. Endocr Pathol 18: 182-186.
- Rotman-Pikielny P, Reynolds JC, Barker WC, et al. 2000. Recombinant Human Thyrotropin for the Diagnosis and Treatment of a Highly Functional Metastatic Struma ovarii. J Clin Endocrinol Metab 85: 237-244.
- O’Connell, Fisher F, Harmer L. 1990. Malignant struma ovarii: presentation and management. British Journal of Radiology 63: 360-363.
- Makania S, Kima W, Gaba A. 2004. Struma ovarii with a focus of papillary thyroid cancer: a case report and review of the liter ature. Gynecologic Oncology 94: 835-839. 13. DeSimone C, Lele S, Modesitt S. 2003. Malignant struma ovarii: a case report and analysis of cases reported in the literature with focus on survival and I131 therapy 89: 543-548.
- Jean S, Montone L, McGrath, et al. 2012. Papillary thyroid cancer arising in struma ovarii. Journal of Obstetrics and Gynaecology 32: 222-226.
- Yücesoy G, et al. 2010. Malignant struma ovarii: A case report. J Korean Med Sci 25: 327-329.