Alteraciones hematológicas en la Diabetes Mellitus
Lilian Sanhueza M.1, Luciana Concha L.2, Pilar Durruty A.1,a y Manuel García de los Ríos A.1
Blood disorders in Diabetes Mellitus
11Unidad de Diabetes, Hospital San Juan de Dios, Servicio y Departamento de Medicina Occidente. Facultad de Medicina Universidad de Chile.
2Unidad de Endocrinología y Diabetes. Hospital Gustavo Fricke. Viña del Mar. aBioquímico.
Sin financiamiento. No hay conflicto de interés.
Correspondencia a:
Lilian Sanhueza M. Fray Camilo Henríquez 175, Depto. 404. Santiago. Chile.
Teléfono: 26353533 Fax: 26817414
E-mail: lilianllay@yahoo.es
Recibido: 11-06-2014
Aceptado: 06-07-2014
Although it has been treated in a limited way the relationship between diabetes and hematopoietic system, there is evidence demonstrating the deleterious effect of hyperglycemia on the three cell lines: red blood cells, white cells and platelets. Different forms of anemia associated with hyperglycemia are analyzed and erythrocyte alterations observed in diabetes. In chronic decompensated patients have been demonstrated alterations of monocytes, lymphocytes and polymorphonuclear particularly, with decreased chemotaxis, adherence, phagocytosis and opsonization. Hyperglycemia determines a prothrombotic state by platelet hyperreactivity, which is a marker of inflammation.
Key words: Diabetes Mellitus, hematology, anemia, hematologic abnormalities.
La diabetes mellitus (DM), enfermedad crónica no transmisible, es considerada por su alta prevalencia una verdadera pandemia que afecta a individuos de cualquier edad, siendo especialmente frecuente la diabetes tipo 2 (DM2) en los sujetos de la tercera edad, donde una de cada cuatro personas es diabética.
La diabetes es una enfermedad sistémica y tanto la diabetes tipo 1 (DM1), como la DM2, presentan compromiso de distintos parénquimas, comúnmente denominados órganos blanco, los que han sido ampliamente reconocidos y estudiados, y que comprometen a vasos sanguíneos de pequeño tamaño (microangiopatía) y gran grosor (macroangiopatía). Las complicaciones crónicas microvasculares constituyen las tan conocidas retinopatía, nefropatía y neuropatía, de alta morbilidad y mortalidad. La macroangiopatía corresponde al daño de las arterias coronarias, cerebrales y de las extremidades inferiores, que en conjunto son la principal causa de muerte de los diabéticos. El daño arterial generalizado ha llevado a muchos al concepto de que la diabetes es una enfermedad metabólica y vascular.
Al ser la DM una enfermedad sistémica, nos ha llamado la atención el escaso interés que ha habido en estudiar como un todo, el posible impacto de la DM en el sistema hematopoyético. Es así como al revisar los textos clásicos de diabetes publicados en los últimos años, sólo encontramos en el Joslin’s Diabetes Mellitus, Twelfth Edition del año 19851, un capítulo dedicado a este tema y, más aún, resulta curioso que en las ediciones XIII y XIV del mismo libro no aparece tratada esta temática.
Al revisar la bibliografía médica a nuestro alcance, tampoco aparecen artículos dedicados a analizar en general las alteraciones hematológicas observadas en los pacientes diabéticos. Esta falta de información nos motivó a revisar la literatura y realizar esta publicación.
En consideración a la heterogeneidad de la relación de la DM con el sistema hematopoyético y sólo con fines de ordenamiento, analizaremos las alteraciones hematológicas observadas en las distintas líneas celulares.
Serie roja
Diabetes y su repercusión en los eritrocitos
Haremos referencia en primer lugar a distintas formas de anemia que se observan en pacientes diabéticos. Según la Organización Mundial de la Salud, se define como anemia la presencia de hemoglobina menor de 13 g/dl en el hombre y menor a 12 g/dl en la mujer (adultos) hallazgo frecuente en los sujetos diabéticos. Se ha descrito que aproximadamente el 20% de los pacientes DM2 presentan anemia sin tener alteración de la función renal2. Esta situación también se ha estudiado en los DM1, con distintos estadios de filtración glomerular, donde se detectó un 15% de anemia3. En primera instancia se presenta como una anemia normocítica normocrómica y en su génesis participarían distintos mecanismos.
El daño túbulo intersticial renal por la hiperglicemia crónica se presenta tempranamente en el transcurso de la diabetes, incluso antes que se detecte algún grado de deterioro de la filtración glomerular. Esto ocasiona una alteración en la respuesta de la eritropoyetina (EPO), estrés oxidativo, deterioro en la acción del óxido nítrico (NO), neuropatía autonómica y elevación de los productos de glicosilación avanzada (AGES). La EPO es una hormona glicoproteica producida por el fibroblasto peritubular que se libera ante la presencia de hipoxia tisular y es clave para regular la masa eritrocitaria, que en última instancia, es la que determina el transporte de oxígeno a los tejidos. Este mecanismo sería el más alterado en las etapas tempranas de la diabetes4.
Al deteriorarse la función renal se exacerban los mecanismos descritos, aumentando al doble la presencia de anemia con las características de aquella que acompaña a las enfermedades crónicas, es decir, normocíticas (Volumen Corpuscular Medio mayor a 80 fl) y con un Ancho de Distribución de los glóbulos rojos (RDW) normal. En esta etapa se suman otros factores como la disminución en la síntesis de EPO, acción directa de las toxinas urémicas, aumento de la respuesta inflamatoria crónica y déficit de hierro. Esto último se produce debido a que la interleukina 6 (IL6) estimula la producción de hepcidina que es una hormona sintetizada en el hígado que regula la absorción de hierro en el tubo digestivo y su distribución en los distintos tejidos. Al activarse, disminuye la absorción intestinal y la liberación del hierro desde los depósitos5. A su vez el grado de anemia es mayor en los pacientes con enfermedad renal por nefropatía diabética que por otras causas y se correlaciona con los valores de macroalbuminuria6.
La presencia de anemia se ha relacionado con la progresión de las complicaciones microvasculares, como es el caso del mayor deterioro en la velocidad de filtración glomerular, progresión de la retinopatía y neuropatía. Pero, al tener los diabéticos una mayor prevalencia de patología cardiovascular, son más vulnerables a los efectos deletéreos de la hipoxia tisular, por lo que la presencia de anemia se considera un importante factor de riesgo cardiovascular con aumento de las hospitalizaciones y muerte prematura7.
Se han descrito alteraciones del metabolismo de la glucosa en otras patologías hematológicas, tales como la talasemia, anemia de células falciformes, y en la anemia hemolítica de carácter leve o moderado por déficit de glucosa 6 fosfato deshidrogenasa (G6PD). En algunos pacientes diabéticos que presentan una forma atípica denominada diabetes tipo 2 con tendencia a la cetosis (ketosis prone type 2 diabetes) también se ha detectado déficit de G6PD. El mecanismo patogénico de este subtipo de diabetes aún no se conoce; sin embargo, una de las hipótesis apunta a que la menor actividad de G6PD produciría falta del cofactor Nicotinamida Adenina Dinucleótido Fosfato (NADPH), biomolécula de gran poder reductor. De manera que el déficit de NADPH favorecería el daño oxidativo debido a la hiperglicemia. Mutaciones en el gen de G6PD disminuyen su acción, precipitando episodios de anemia hemolítica y tendencia a la cetosis, sin causa desencadenante, lo que caracteriza a estos pacientes8.
Alteraciones del eritrocito
A continuación nos referiremos a las alteraciones eritrocitarias
relacionadas con distintos trastornos del metabolismo glucídico (Tabla 1).

Vida media reducida de los glóbulos rojos. La vida media normal del eritrocito determinada por diferentes técnicas (glóbulos rojos marcados con cromo, selenio, etc.), establece una sobrevida promedio de 123 ± 23 días en individuos sanos.
Existe una técnica rápida, sencilla y no invasiva, que cuantifica la vida media del glóbulo rojo, en base a mediciones de la concentración de monóxido de carbono del aire espirado. Esta técnica demostró, en un estudio con 23 pacientes diabéticos tipo 2, un promedio de sobrevida eritrocitaria de 112 ± 25 días9.
Esto último motivó diversos estudios tratando de establecer la importancia que tendría el fenómeno denominado glicación o glicosilación en la sobrevida del eritrocito. La interacción de la glucosa plasmática con proteínas de larga vida media (por ejemplo la hemoglobina) genera los AGES que se acumulan indefinidamente en los distintos tejidos, modificándolos tanto estructural como funcionalmente.
La hemoglobina glicosilada fracción A1c (HbA1c), representa la unión covalente específica entre el amino terminal de la hemoglobina y la glucosa. Se genera por una reacción no enzimática e irreversible, que depende de los niveles de glucosa plasmática y del tiempo que dure la hiperglicemia. El valor normal se encuentra en un rango de 4 a 6%, aceptándose como un buen índice de control metabólico niveles cercanos a 7%. Se ha recomendado su medición cada tres meses, considerando la sobrevida normal del glóbulo rojo; pero a la luz de los conocimientos actuales, en relación a una vida media menor en los pacientes diabéticos, pareciera aconsejable efectuar la determinación de HbA1c cada dos meses. Además, se ha demostrado que los niveles elevados de hemoglobina glicosilada A1c reducen la sobrevida eritrocitaria en un promedio de 6,9 días por cada 1,0% de aumento de la HbA1c sobre el valor normal9.
Aumento de la agregación eritrocitaria. Este fenómeno no es exclusivamente inducido por factores plasmáticos, como son los niveles de fibrinógeno, sino que está determinado por la composición fosfolipídica de la membrana eritrocitaria. En un estudio con 86 pacientes diabéticos tipo 2, se estableció una diferencia en la composición fosfolipídica de la membrana eritrocitaria, con un aumento de la esfingomielina, una disminución de la fosfatidilserina y mantención del porcentaje de fosfatidilcolina y fosfatidiletanolamina. Esta situación se traduce en un aumento de la agregación eritrocitaria. A nivel de la retina y conjuntiva, este fenómeno favorece el enlentecimiento del flujo y aumento de la presión sanguínea intraocular10.
Disminución de la capacidad de deformación de los glóbulos rojos. Este trastorno ocurre debido a la baja concentración de ácido siálico y de colesterol de la membrana eritrocitaria y a las reacciones de glicosilación que sufren las proteínas estructurales. Se ha demostrado que la fluidez de la membrana del glóbulo rojo está disminuida en los diabéticos; alteración que resulta en la rápida destrucción de estas células. La insulina estimula la proliferación de las células progenitoras eritroides mejorando la capacidad de deformación de la membrana celular, facilitando su pasaje a través del lecho capilar, aun cuando los niveles de glucosa permanezcan elevados11.
Anormalidad en el sistema de transporte de oxígeno. La glicosilación de la hemoglobina disminuye las concentraciones del 2-3-difosfoglicerato, principal componente del metabolismo intraeritrocitario de la glucosa, lo que aumenta la afinidad del glóbulo rojo por el oxígeno favoreciendo la hipoxia tisular12.
Aumento de la capacidad oxidativa. Los glóbulos rojos de los pacientes diabéticos tienen aumentada su capacidad oxidativa determinada por la medición del ciclo redox del glutatión. Esto promueve el aumento del stress oxidativo, lo que favorece la disfunción endotelial.
Serie blanca
En los pacientes diabéticos, el estudio de los glóbulos blancos puede enfocarse desde dos puntos de vista: por una parte la relación existente entre el recuento leucocitario elevado, que sería un marcador de inflamación crónica endotelial y por ende responsable del desarrollo de complicaciones micro y macrovasculares y, en segundo lugar, su relación con el sistema inmunológico, donde efectivamente se han demostrado anormalidades funcionales13.
Recuento de glóbulos blancos y disfunción endotelial
En ausencia de un cuadro infeccioso intercurrente, el recuento leucocitario del paciente diabético se encuentra generalmente en rango normal alto. Este valor absoluto es independiente de los fenómenos de insulinorresistencia o hiposecresión insulínica; se ha correlacionado con el desarrollo de graves fenómenos presentes en la ateroesclerosis, importante daño crónico del endotelio14.
La disfunción endotelial se define como un defecto en la relajación del endotelio mediado por el NO y la prostaciclina. Los monocitos y linfocitos activados son reclutados a nivel del endotelio dañado, interactuando con las moléculas de adhesión VCAM-1 (vascular cell adhesión molecule-1) e ICAM-1 (intercelular adhesión molecule-1), las que facilitan su ingreso al espacio subendotelial desencadenando distintos fenómenos inmunoinflamatorios. Los linfocitos liberan una serie de citoquinas y factores de crecimiento, tales como las interleukinas (IL6 e IL8), el factor de necrosis tumoral alfa y el factor de crecimiento tumoral beta 1. Estos factores liberan radicales superóxidos y proteasas, que favorecen el estrés oxidativo y estimulan la liberación del factor de transcripción nuclear kappa beta por las células mononucleares periféricas.
Por otro lado, los macrófagos son también activados por estas citoquinas, que al interactuar con las LDL oxidadas (lipoproteínas de baja densidad), dan origen a las células espumosas, base histológica de la placa ateroesclerótica15.
El recuento de glóbulos blancos influye en la viscosidad sanguínea, estimulando la liberación de productos que inducen la ruptura de la placa ateroesclerótica y la formación de trombos16.
Las mieloperoxidasas, enzimas sintetizadas por los leucocitos, también estimulan la vía oxidativa del ión superóxido, incrementando la producción de las especies reactivas de oxígeno potenciando el daño endotelial17.
Hiperglicemia crónica y respuesta inmune
En el paciente diabético, es frecuente la presencia de infecciones bacterianas, virales y fúngicas; con una evolución
más tórpida y de peor pronóstico. Esto ha sido demostrado
por las largas estadías intrahospitalarias y por la necesidad de
utilizar esquemas terapéuticos más complejos. Determinados
factores específicos del huésped predisponen a los pacientes
diabéticos a las infecciones, entre estos se encuentran: la hiperglicemia
que conlleva a la alteración de la respuesta inmune,
la insuficiencia vascular, la neuropatía periférica sensitiva,
la neuropatía autonómica y la colonización de la piel
y mucosas con patógenos, tales como el estafilococo aureus y
la cándida albicans18. Por otra parte, algunos estudios sugieren
que los leucocitos en los DM2 contribuyen al desarrollo
y progresión de la nefropatía, en parte a través del efecto de
la leptina19. A continuación nos referiremos a los trastornos
leucocitarios observados en las distintas células de la serie
blanca (Tabla 2).
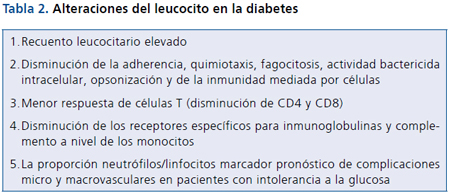
Polimorfonucleares (PMN). La hiperglicemia crónica provoca en los PMN una serie de alteraciones caracterizadas por una disminución de la adherencia y quimiotaxis al endotelio vascular, de la fagocitosis, de la actividad bactericida intracelular, de la opsonización y de la inmunidad mediada por células20.
Diversos estudios han informado defectos en la función de los neutrófilos, situación que se pone de manifiesto como una menor activación frente a la hiperglicemia acompañado de un aumento de los niveles de elastasa y de consumo de oxígeno. Los estados de hiperglicemia crónica y/o hiperinsulinemia disminuyen la función de los neutrófilos. Otros desórdenes metabólicos tales como la dislipidemia y niveles elevados de los productos finales de glicosilación avanzada, también pueden afectar estas funciones21.
Hace varios años se asignó un valor de glicemia a la recuperación de la función granulocítica, al demostrarse una mejoría significativa en la adherencia en diabéticos con mal control metabólico, al reducir la glicemia de ayunas de 294 ± 20 mg/dl a 198 ± 29 mg/dl. Es así como se asignó un valor promedio de glicemia plasmática de 200 mg/dl como causante de la disfunción leucocitaria22.
Otros estudios demostraron una elevación de los niveles basales de calcio citosólico en los PMN de pacientes diabéticos, lo que se asoció con una reducción del contenido de ATP y disminución de la fagocitosis.
Además, se observó una correlación directa entre el calcio citosólico de los PMN y la glicemia de ayunas. Estos trastornos fueron inversamente proporcionales a la actividad fagocitaria. La normalización de la glicemia provocó una disminución del calcio citosólico, aumento del contenido de ATP y mejoría de la fagocitosis.
Se han correlacionado las vías fisiopatológicas de la DM con la disfunción granulocítica; ya sea a través de la vía de la aldosa reductasa, de los productos finales de glicosilación avanzada, de los radicales superóxidos y de la protein kinasa C. Esto ha sentado las bases para lograr mejorías en la actividad fagocitaria del neutrófilo con el uso de inhibidores de la aldosa reductasa. Sin embargo, estos medicamentos debieron ser retirados del mercado en el año1996 por producir necrosis hepática (Epalrestat y Sorbinil).
Monocitos. En la superficie de los monocitos existen receptores específicos para inmunoglobulinas y fracciones del complemento, que son modulados por la acción de la insulina. En situaciones de hiperglicemia aguda, tanto neutrófilos como monocitos muestran niveles aumentados de moléculas de adhesión. La activación del factor kappa beta junto a su proteína inhibitoria y la activación de la protein kinasa C se postulan como mecanismos potenciales de la interacción entre leucocitos y endotelio23.
Linfocitos. A nivel linfocitario se ha encontrado en pacientes diabéticos con mal control metabólico una menor respuesta de las células T, lo que se traduce en una síntesis reducida tanto de CD4 como de CD8.
La proporción de neutrófilos/linfocitos ha demostrado ser un mejor factor de riesgo, comparado con el recuento total de glóbulos blancos, en la predicción de factores adversos con diferentes grados de intolerancia a la glucosa e insulinorresistencia. Ello puede ser utilizado como un marcador pronóstico coadyuvante de las complicaciones micro y macrovasculares en pacientes con intolerancia a la glucosa24.
Hemostasis
Es un hecho conocido que los pacientes diabéticos tienen mayor riesgo de eventos coronarios y mortalidad cardiovascular; fenómeno que se explica por desregulación de los factores involucrados en la coagulación y por activación de las plaquetas25.
En la patogénesis de este estado protrombótico participan tanto la hiperglicemia como la insulinorresistencia26. En los pacientes mal controlados están aumentados los niveles del inhibidor del activador del plasminógeno y el fibrinógeno; los que disminuyen al ser tratados con hipoglicemiantes orales (metformina o glibenclamida)27. Además, los diabéticos tipo 2 presentan una mayor concentración y actividad de factores procoagulantes (factor VII, trombina y factor tisular) y una disminución de los componentes antitrombóticos (trombomodulina soluble y proteína C activada)28.
Este estado protrombótico se debe a una hiperreactividad plaquetaria29; contribuyen a esta disfunción varios mecanismos que afectan la adhesión, activación y la agregación plaquetaria. La hiperglicemia altera la homeostasis del calcio en las plaquetas, con modificación del citoesqueleto y aumento de los factores proagregantes30. Además, la up-regulation de las glicoproteínas Ib y IIb/IIIa gatillan la vía de formación de trombos, interactuando con el factor de von Willebrand y las moléculas de fibrina.
En los últimos años se ha encontrado que micropartículas (MPs) liberadas a la circulación por la activación o apoptosis de varios tipos de células están aumentadas en los diabéticos y favorecen las actividades de la coagulación en las células endoteliales31. Además, estas MPs llevan factores que promueven la formación de trombos a los sitios de injuria endotelial, lo que representa un nuevo y adicional mecanismo de trombosis coronaria en pacientes diabéticos32.
Alteraciones de las plaquetas provocadas por la hiperglicemia
En los diabéticos las plaquetas han emergido como importantes marcadores de inflamación, con un rol en la ateroesclerosis y la enfermedad cardiovascular. El estrés oxidativo inducido por la hiperglicemia produce alteraciones en los glóbulos rojos y en la hemoglobina; sin embargo, existe escasa información del comportamiento de las plaquetas en la diabetes. A continuación nos referiremos a algunos trastornos observados en diabéticos (Tabla 3).

Hiperagregación plaquetaria. Es uno de los cambios más comunes encontrados en pacientes con DM1 y DM233. Se ha informado de un aumento de los productos finales del tromboxano y de la protrombina, los que aceleran la agregación plaquetaria con tendencia a bloquear los vasos sanguíneos; en contraste, están disminuidos los factores anticoagulantes.
Producción de tromboxano. En los DM2 está aumentada la producción de tromboxano, lo que favorece la agregación y activación plaquetaria, situación que está directamente relacionada con los niveles altos de glucosa, indicando un alto riesgo cardiovascular. Los estudios han demostrado reducción de los niveles de tromboxano con la mejoría del control glicémico34.
Fluidez de la membrana. Está asociada a daño en la función de las plaquetas, las membranas enriquecidas en colesterol hipersensibilizan a las plaquetas a diferentes agonistas. Además sus receptores de superficie glicoproteicos están significativamente aumentados en los diabéticos y correlacionados con los niveles de HbA1c.
Alteración del ambiente iónico intracelular. En ambiente hiperglicémico se ha encontrado hiperactividad de las plaquetas, la que está asociada con aumento de calcio intracelular. A su vez la concentración de magnesio está disminuido, lo que favorece la agregación y adhesión plaquetaria35.
Plaquetas más grandes. Desde hace muchos años se conoce que los diabéticos presentan plaquetas de mayor volumen, lo que las haría más reactivas y con mayor superficie para expresar receptores; hechos relacionados directamente con los infartos al miocardio36.
Cambio en el potencial de la membrana mitocondrial. Los estudios han establecido que los niveles de HbA1c se correlacionan positivamente con el contenido de ATP de las plaquetas, sugiriendo que la hiperglicemia promueve a las mitocondrias a generar más ATP, disminuyendo el potencial de membrana37.
Diabetes, trastornos hematológicos y enfermedad cardiovascular
Las plaquetas, así como los eritrocitos, son células permeables a la glucosa y no requieren de la presencia de insulina para su ingreso. Esto permite que en su interior se produzcan una serie de fenómenos fisiopatológicos al elevarse los niveles de glucosa intracelular, tales como la glicación de proteínas, mayor actividad de la proteinquinasa C beta, aumento en la producción de radicales libres, disminución de producción de prostaciclina y de NO, todo lo cual facilita la disfunción endotelial. Esto último se revierte con la administración de insulina38.
La producción de prostaciclina y NO por el endotelio sano, inhiben la agregación plaquetaria, relajan el músculo liso vascular, lo que permite un flujo sanguíneo normal y evita los fenómenos trombóticos. La actividad de las plaquetas está correlacionada con la síntesis de NO, que está disminuido en el síndrome coronario agudo. En pacientes diabéticos coronarios se ha encontrado polimorfismo de la enzima que sintetiza NO en el endotelio, alterando la adhesión de las plaquetas39; demostrando que el factor genético estaría involucrado en la enfermedad cardiovascular (ECV).
La DM2 es el mayor factor de riesgo de ECV. Esta condición se asocia con insulinorresistencia y anormalidades metabólicas que incluyen hiperglicemia, hipertensión, adiposidad visceral y dislipidemia con bajo colesterol HDL y altos triglicéridos40. Muchos esfuerzos se hacen para reducir la ECV enfocados a los factores de riesgo, pero los pacientes diabéticos continúan siendo vulnerables a pesar de las terapias agresivas.
Referencias bibliográficas
- Bern MM, Busick EJ. 1985. Disorders of the Blood and Diabetes. In: Marble A, Krall LP, Bradley RF, Chistlieb AR, Soeldner JS, ed. Joslin’s Diabetes Mellitus Twelfth Edition. Philadelphia, USA. Lea and Febiger 748-768.
- Thomas MC, MacIsaac RJ, Tsalamandris C, Power D, Jerums G. 2002. Unrecognized anemia in patients with diabetes. Diabetes Care 24: 1164-1169.
- Thomas MC, MacIsaac RJ, Tsalamandris C, Molyneaux L, Goubina I, Fulcher G, et al. 2004. Anemia in Patients with Type 1 Diabetes. J Clin Endocrinol Metab 89: 4359-4363.
- Deray G, Heurtier A, Grimaldi A. 2004. Anemia and diabetes. Am J Nephrol 24: 522-526.
- Zadrazil J, Horak P. 2014. Pathophysiology of anemia in chronic kidney diseases A review. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 158: XX.
- Dousdampanis P, Trigka K, Fourtounas C. 2014. Prevalence of Anemia in Patients with Type II Diabetes and Mild to Moderate Chronic Kidney Disease and the Impact of Anti-RAS Medications. Saudi J Kidney Dis Transpl 25 (3): 552-557.
- Thomas MC, Tsalamandris C, MacIsaac R, Jermus G. 2005. Anemia in diabetes: an emerging complication of microvascular disease. Curr Diabetes Rev 1: 107-126.
- West IC. 2002. Glucose 6 phosphate dehydrogenase: a candidate gene for diabetes. Diabetes Med 19: 172-174.
- Vitue M, Furne J, Nuttall F, Levit M. 2004. Relationship
Between Ghb Concentration and Erytrocyte Survival Determined
From Breath Carbon Monoxide Concentration. Diabetes Care 27: 913-934. - Abiko T, Abiko A, Clermont A, Shoelson B, Horio N, Takahashi J, et al. 2003. Characterization of Retinal Leukostasis and Hemodynamics in Insulin Resistance and Diabetes: Role of Oxidants and Protein Kinase-C Activation. Diabetes 52: 829-837.
- Shin S, Ku Y, Babu N, Singh M. 2007. Erythrocyte deformability and its variation in diabetes mellitus. J Exp Biol 45: 121-128.
- Lao T, Lai-Fong Ho. 2004. Impact of Iron Deficiency Anemia on Prevalence of Gestional Diabetes Mellitus. Diabetes Care 27: 650-656.
- Dabanch J. 2014. Infecciones en Diabetes Mellitus. En: García de los Ríos M, Durruty P, Bezanilla CG, Soto N eds. Diabetes Mellitus. 3a Ed. Santiago: Editorial Mediterráneo 393-402.
- Ohshita K, Yamane K, Hanafusa M, Mori H, Mito K, Okubo M, et al. 2004. Elevated White Blood Cell Count in Subjets With Impaired Glucose Tolerance. Diabetes Care 27: 491-496.
- Tabit C, Chung W, Hamburg N, Vita JA. 2010. Endotelial dysfunction in diabetes mellitus: Molecular mechanism and clinical implications. Rev Endocr Metab Disord 11: 61-74.
- Tong PC, Lee KF, So WY, NgHM, Chan WB, Lo MK, Chan NV, et al. 2004. White Blood Cell Count Is Associated With Macro and Microvascular Complication in Chinese Patients With Type 2 Diabetes. Diabetes Care 27: 216-222.
- Zhang C, Yang J, Jennings L. 2004. Leukocyte-Derived Myeloperoxidase Amplifies High-Glucose-Stimulated, Vascular Non-Leukocyted-Derived Reactive Oxigen Species. Diabetes 53: 2950-2959.
- Llorente L, De la Fuente H, Richaud-Patin, et al. 2000. Innate immune response mechanisms in non-insulin dependent diabetes mellitus patients assessed by flowcytoenzymology. Immunol Lett 74: 239.
- Chung Fu-Mei, Tsai Jack CR, Chang Dao-Ming, Shin, Shyi, Lee Yau-Jiunn. 2005. Peripheral Total and Differential Leukocyte Count in Diabetic Nephropaty Diabetes Care 28: 1710-1717.
- Stegenga ME, Van der Crabben SN, Dessing MC, Parter JM, Van den Pangart PS, de Vos AF, et al. 2008. Effect of acute hyperglycemia and/or hyperinsulinaemia on proinflammatory gene expression, cytokine production and neutrophil function humans. Diabetic Medicine 25: 157-164.
- Clement S, Braithwaite S, Magee M, Ahmann A, Smith E, Schafer R. 2004. Management of Diabetes and Hyperglycemia in Hospitals. Diabetes Care 27: 553-591.
- Shurtz-Swirs R, Sela S, Herskovits A, Shasha S, Shapiro G, Nasser L, et al. 2001. Involvement of Peripheral Polimorphonuclear Leukocytes in Oxidative Stress and Inflammation in Type 2 Diabetic Patients. Diabetes Care 24: 104-120.
- Baier E, García de los Ríos M. 2003. Infecciones en el Diabético. En: García de los Ríos M, Durruty P, eds. Diabetes Mellitus 2a Ed. Santiago: Editorial Arancibia Hnos. y Cía Ltda 209-211.
- Shiny A, Bibin YS, Shanthirani CS, Regin BS, Anjana RM, Balasubramanyam M, et al. Association of Neutrophil-Lymphocyte Ratio with Glucose Intolerance: An Indicator of Systemic Inflammation in Patients with Type 2 Diabetes. Diabetes Technol Ther 2014 Jan 23 (Epub of print).
- Vazzana N, Ranalli P, Cuccurrullo C, Davi G. 2012. Diabetes mellitus and thrombosis. Thromb Res 129: 371-377.
- Boden G, Rao AK. 2007. Effects of hyperglycemia and hyperinsulinemia on the tissue factor pathway of blood coagulation. Curr Diab Rep 7: 223-227.
- Lemkes BA, Hermanides J, Devries JH, Holleman F , Meijers JC, Hoekstra JB. 2010. Hyperglycemia: a protrombotic factor? J Thromb Haemost 8: 1663-1669.
- Colwell J. 2001. Treatment for the procoagulant state in type 2 diabetes. Endocrin and Metab Clin North Am 30: 1011-1030.
- Linden MD, Tran H, Woods R, Tonkin A. 2012. High platelet reactivity and antiplatelet therapy resistance. Semin Thromb Haemost 38: 200-212.
- Ferreira IA, Mocking AI, Feijge MA, Gorter G, van Haeften TW, Heemskerk JW, et al. 2006. Platelet inhibition by insulin is absent in type 2 diabetes. Arterioscler Thromb Vasc Biol 26: 417-422.
- Tsimerman G, Roguin A, Bachard M, Melamed E, Brenner B,
Aharon A. 2011. Involvement of microparticles in diabetic
vascular complications. Tromb Haemost 106: 310-321. - Sinning JM, Losch J, Walenta K, Bohm M, Nickenig G, Werner C. 2011. Circulating cd31+/annexin v+ microparticles correlate with cardiovascular outcomes. Eur Heart J 32: 2034-2041.
- Undas A, Wiek I, Stepien E, Zmudka K, Tracz W. 2008. Hyperglycemia is associated with enhanced thrombin formation, platelet activation, and fibrin clot resistance to lysis in patients with acute coronary syndrome. Diabetes Care 31: 1590-1595.
- Balestrieri ML, Servillo L, Espósito A, D´Onofrio N, Giovane A, Casall R, et al. 2013. Poor glycaemic control in type 2 diabetes reduces endothelial progenitor cell number by influencing S IRT1 signalling via platelet activating factor receptor activation. Diabetología 56: 162-172.
- Li Y, Woo V, Bose R. 2001. Platelet hyperactivity and abnormal Ca+2 homeostasis in diabetes mellitus. Am J of Physiol-Heart and Circ Physiol 280: H1480-H1489.
- Verdoai M, Schaffer A, Barbieri L, Cassetti E, Nardin M, Bellomo G, et al. 2014. Diabetes, glucose control and mean platelet volumen: a single-centre cohort study. Diab Res and Clin Pract 104: 288-294.
- Guo X, Wu J, Du J, Ran J, Xu J. 2009. Platelet of type 2 diabetic patients are characterized by high ATP content and low mitochondrial membrane potencial. Platelets 20: 588-593.
- Calverley DC, Baldermann LV, Moran K, Chen NN, McFann K. 2006. Platelet CδRIIA expression is associated with the α2 integrin C807T gene polymorphism in type 2 diabetes. Platelets 17: 78-83.
- Tabit CE, Chung WB, Hamburg NM, Vita JA. 2010. Endothelial dysfunction in diabetes mellitus: Molecular mechanism and clinical implications. Rev Endocr Metab Disord 11: 61-74.
- Vazzana N, Ranalli P, Cuccurrullo C, Davi G. 2012. Diabetes mellitus and thrombosis. Thromb Res 129: 371-377.