Reducción de la esteatosis hepática, insulino resistencia y pérdida de la defensa antioxidante en ratones alimentados con dieta alta en grasa suplementados con AGPICL n-3 más aceite de oliva extra virgen
Rodrigo Valenzuela B.1, María Catalina Hernández-Rodas1, Cynthia Barrera R.1, Francisco Pérez B.1 y Manuel Ruz O1.
Reduction of hepatic steatosis, insulin resistance and loss of antioxidant defense in high fat diet fed mice suplemented with n-3 LCPUFA more extra virgin olive oil
1Departamento de Nutrición. Facultad de Medicina. Universidad de Chile. Correspondencia a: Independencia, Santiago, Chile. Casilla 1227 Teléfono: 56-2-29786014 Fax: 56-2-29786182 E mail: rvalenzuelab@med.uchile.cl
Recibido: 01-07-2015
Aceptado: 01-09-2015
Non-alcoholic fatty liver disease (NAFLD) is directly associated with insulin resistance and oxidative stress. In NAFLD is established a reduction in n-3 LCPUFA (EPA + DHA) levels and hepatic activity of transcription factor PPAR-á. EPA and DHA inhibit lipogenesis and stimulate fatty acid oxidation in the liver. Extra virgin olive oil (EVOO) has important antioxidant properties. This study evaluated the prevention of insulin resistance and prevention of depletion of hepatic antioxidant defense in C57BL/6J mice fed high-fat diet (HFD), supplemented with n-3 LCPUFA plus EVOO. HFD generated insulin resistance and hepatic steatosis, together with significant reduction in i) n-3 LCPUFA hepatic levels, ii) DNA binding activity of PPAR-á, iii) activity of antioxidant enzymes (catalase and superoxide dismutase), respect to control group (fed with control diet). Supplementation with n-3 LCPUFA plus EVOO prevent development insulin resistance and attenuate increased of fat in liver (p < 0.05), together with a normalization of i) DNA binding activity of PPAR-á, ii) activity of antioxidant enzymes (catalase and superoxide dismutase) and iii) reducing depletion of n-3 LCPUFA levels in liver tissue, compared to the control group (p < 0.05). Supplementation with n-3 LCPUFA plus EVOO reduced hepatic steatosis and prevent development of insulin resistance, along with preserving the antioxidant defense in liver. Projecting the use of this mixture of AGPICL n-3 plus EVOO as a potential treatment of NAFLD. Key words: Liver steatosis, insulin resistance, antioxidant enzymes, n-3 LCPUFA (EPA + DHA), extra virgin olive oil.
La enfermedad por hígado graso no alcohólico (EHGNA) se caracteriza por la acumulación anormal (superior al 5% del peso total del hígado) de triacilglicéridos (TAG) en el tejido hepático en ausencia de un consumo mayor a 20 g de alcohol/día, fenómeno conocido como esteatosis, el cual si va acompañado de inflamación puede evolucionar a esteatohepatitis no alcohólico, fibrosis y cirrosis hepática1. En sujetos obesos, la incidencia de EHGNA alcanza entre un 60-90%, la esteatohepatitis un 20-25% y la cirrosis hepática un 2-8%2. La resistencia a la insulina, el estrés oxidativo y la inflamación serían factores desencadenantes de la enfermedad3, y por este motivo la EHGNA puede ser considerada como la manifestación hepática del síndrome metabólico, siendo su incremento directamente vinculado a una mayor prevalencia de obesidad y diabetes tipo 24. En la EHGNA se generan importantes alteraciones del metabolismo hepático, favoreciendo la lipogénesis de novo e inhibiendo tanto la oxidación como exportación de ácidos grasos desde el hígado a otros órganos5. Además, en asociacion con la resistencia a la insulina, el estres oxidativo y la inflamacion, se observa una significativa y drastica disminucion en los niveles hepaticos de acidos grasos poliinsaturados (AGPI) de cadena larga n-3 (AGPICL n-3), especificamente el acido eicosapentaenoico (C20:5 n-3, EPA) y acido docosahexaenoico (C22:6 n-3, DHA)6. El agotamiento de los AGPICL n-3 y la disminucion en la actividad del factor de transcripcion PPAR-α (del ingles peroxisome proliferator-activated receptor alpha) pueden jugar un papel fundamental en el aumento de la capacidad de union al ADN de los factores de transcripcion pro-inflamatorios NF-kB (del ingles nuclear factor kappa-light-chain-enhancer of activated B cells) y AP-1 (del ingles activator protein 1), lo que constituiria uno de los mecanismos mas importantes para la progresion de la esteatosis a la esteatohepatitis7.
El EPA y el DHA, presentan diversas propiedades fisiologicas para el organismo, el DHA tiene un rol fundamental en el desarrollo cerebral y visual8, mientras que el EPA tiene un importante efecto cardio-protector, siendo incluso considerado como una alternativa no farmacologica para la prevencion y/o tratamiento de las enfermedades cardiovasculares9. Ademas, estos acidos grasos son capaces de estimular la lipolisis, inhibir la lipogenesis y la inflamacion a nivel hepatico10. Antecedentes que permiten plantear la posibilidad de utilizar estos acidos grasos como un tratamiento nutricional especifico para la EHGNA; sin embargo, las dosis necesarias de EPA + DHA para lograr un efecto significativo en humanos podrian generar potenciales efectos secundarios adversos, particularmente un aumento en el estres oxidativo11,12.
El aceite de oliva extra virgen (AOEV) tiene propiedades antioxidantes y antiinflamatorias13,14, beneficios atribuidos al alto contenido de vitamina E y de polifenoles, particularmente el hidroxitirosol (HT) y otros fenoles tales como: tirosol, oleuropeina aglicona y oleocantal, todos presentes en cantidades variables en el AOEV14-16. Respecto a las propiedades antioxidantes del AOEV, los compuestos fenolicos presentes en este ejercerian un efecto protector frente al estres oxidativo, previniendo especialmente la lipoperoxidacion y el dano oxidativo del ADN14. Considerando estos antecedentes, el presente trabajo tiene por objetivo evaluar el efecto protector de un protocolo combinado de AGPICL n-3 (EPA+DHA) mas AOEV frente a la esteatosis hepatica, insulino resistencia y perdida de la defensa antioxidante hepatica inducida por dieta alta en grasa en ratones.
Material y Metodos
Animales, dietas y suplementacion dietaria Ratones machos C57/6J (12-14 g) obtenidos desde el Bioterio Central de la Facultad de Medicina de la Universidad de Chile, fueron asignados al azar en cada grupo experimental. Siendo separados segun dieta y tipo de suplementacion que recibieron. Utilizandose una dieta control (DC) (Research Diet INC, Rodent Diet, Product data D12450B, USA.) que aportaba (expresado como % de las calorias totales) un 10% de grasa, 20% de proteina y 70% de hidratos de carbono, con un valor calorico de 3,85 Kcal/g, libre de EPA y DHA, que contenia 0,7 g de acido α-linolenico (C18:3 n-3, ALA) (ALA)/100 g de dieta. La dieta alta en grasa (DAG) (Research Diet INC, Rodent Diet, Product data D12492, USA) aportaba un 60% de grasa, 20% de proteina y 20% de hidratos de carbono, con un valor calorico de 5,24 Kcal/g, libre de EPA y DHA, y con un aporte de 0,7 g de ALA. Los animales consumieron agua y dieta ad libitum, sometidos a ciclos de luz y oscuridad por 12 h cada uno, en un periodo de 12 semanas. Durante todo ese tiempo los animales recibieron una suplementacion dietaria (via oral) de EPA (67 mg/kg de EPA) + DHA (33 mg/kg de DHA) (100 mg/kg/dia) (UP-Ultra Omega-3, New Science, Chile) o AOEV (100 mg/kg/dia) (IV region de Coquimbo, Chile). Los grupos controles recibieron en cantidades iso-volumetricas una solucion salina segun el grupo experimental al que fueron asignados. Conformandose ocho grupos experimentales: a) DC; b) DC + AGPICL n-3; c) DC +AOEV; d) DC + (AGPICL n-3 + AOEV); e) DAG; f) DAG + AGPICL n-3; g) DAG + AOEV y h) DAG + (AGPICL n-3 + AOEV). Controlandose semanalmente el peso corporal y la ingesta dietaria. Al finalizar las 12 semanas de intervencion los animales se mantuvieron en ayunas (6-8 h), siendo anestesiados con ketamina y xilacina (150 y 10 mg/kg, respectivamente), obteniendose la muestra de sangre mediante puncion cardiaca para determinar los niveles de glucosa e insulina. Las muestras de higado se congelaron inmediatamente en nitrogeno liquido y fueron almacenadas a -80oC, para la posterior cuantificacion de grasa hepatica total y determinacion de la composicion de acidos grasos. Todos los protocolos y procedimientos realizados en los animales cumplieron con la guia para el cuidado y uso de animales (National Academy of Sciences, NIH Publication 6-23, revised 1985) y fueron aprobados por el comite de bioetica de investigacion en animales de la Facultad de Medicina de la Universidad de Chile (CBA #0630 FMUCH).
Determinacion de parametros metabolicos y contenido de lipidos hepaticos
La glucosa en sangre (mM) se determino usando un kit especifico (Wiener Lab, Argentina). La insulina serica (μU/mL) se determino utilizando un kit ultra-sensible (Mercodia, Uppsala, Suecia) acorde a las instrucciones del fabricante. La insulino resistencia fue estimada por el metodo ghomeostasis model assessment methodh (HOMA) [insulina en ayunas (μU/mL) ~ glucosa en ayunas (mM)/22,5]17. La grasa hepatica total se determino mediante el metodo descrito por Bligh y Dyer18, y el contenido hepatico de TAG se evaluo utilizando un kit comercial especifico (Wiener Lab, Argentina).
Determinacion del perfil de acidos grasos hepaticos totales
La extraccion total de los lipidos hepaticos totales se realizo de acuerdo a la metodologia descrita por Bligh y Dyer17, las muestras de higado (200 mg de tejido) fueron homogeneizadas en un ambiente frio (hielo) utilizando un homogeneizador Utraturrax (Janke & Kunkel, Stufen, Germany) en tubos de vidrio, con una solucion de metanol/cloroformo (2:1 v/v) que contenia 0,01% de butilhidroxitolueno (BHT) como antioxidante. Logrando un volumen de 1 mL de producto homogenizado, adicionado H2O bidestilada (3 mL) y cloruro de magnesio 0,5 N (1 mL) hasta alcanzar 5 mL de solucion final. Posteriormente se obtuvo todo el cloroformo (fraccion oleosa) y mediante extraccion de solvente con nitrogeno gaseoso se logro obtener el contenido total de grasa hepatica (TAG, mono y di-acilgliceridos, fosfolipidos, acidos grasos libres, colesterol esterificado y libre) (mg grasa/100 mg higado). Luego se prepararon los esteres metilicos de acidos grasos (EMAG) de acuerdo a la metodologia descrita por Morrison y Smith19, mediante hidrolisis alcalina y acida, utilizando trifluoruro de boro al 12% en metanol e hidroxido de sodio en metanol 0,5N. Los EMAG fueron extraidos y recolectados con hexano (0,5 mL) para ser cuantificados mediante cromatografia gas-liquida en un equipo Agilen Hewlett-Packard (modelo 7890A, CA, USA) usando una columna capilar (Agilent HP-88, 100 m x 0,250 mm; I.D. 0,25 μm) con detector de ionizacion en llama (FID). La temperatura fue programada desde 140 a 220‹C, con 3‹C/min y con un tiempo final de 5 min. La temperatura del detector y el inyector fue de 250‹C; utilizandose hidrogeno como gas de arrastre. Los acidos grasos fueron identificados mediante comparacion de sus tiempos de retencion, utilizando como estandar interno el acido graso C23:0 (Nu-Chek Prep Inc, Elysian MN, USA) con aquellos estandares individuales a traves de integracion computarizada en un equipo Hewlett-Packard Chemstation (Palo Alto, CA, USA).
Determinacion de la actividad de union al DNA de PPAR-α
Los extractos de proteinas nucleares se obtuvieron utilizando un kit comercial de extraccion (Cayman Chemical Company, Item N‹ 10011223, Ann Arbor, MI, USA) y luego se realizo un ELISA utilizando un kit especifico (Cayman Chemical Company, Item N° 10006915, Ann Arbor, MI, USA). Los resultados se expresaron como porcentaje de union de PPAR- α al ADN nuclear respecto a un control positivo.
Determinacion de la actividad de las enzimas antioxidantes catalasa y superoxido dismutasa
Las muestras de higado fueron homogenizadas en un buffer fosfato que contenia 1 mmol de EDTA y 250 mmol de sacarosa. Luego de una centrifugacion por 10 min (750 rpm a 4°C), se utilizo una alicuota del sobrenadante para la determinacion de la actividad de las enzimas superoxido dismutasa (SOD) y catalasa. La actividad de la catalasa se midio mediante la metodologia descrita por Luck20. Definiendose una unidad de enzima como la cantidad de enzima que libera la mitad de peroxido de hidrogeno a partir de una solucion de peroxido de hidrogeno en 100 s a 25oC. La evaluacion cuantitativa de la actividad de la SOD se realizo utilizando un kit comercial (Cayman Chemical Company, Item N‹ 706002, Ann Arbor, MI, USA) de acuerdo a las instrucciones del fabricante.
Analisis estadistico
Los resultados finales se expresaron como promedios } error estandar de la media para 9-12 animales por grupo experimental. La evaluacion de la distribucion normal de los datos se realizo mediante test Shapiro wilk. Las diferencias entre los grupos experimentales, se evaluaron mediante ANOVA unifactorial, seguido del test de Newman Keuls. (GraphPad Prisma version 6.00 para Windows, GraphPad Software, San Diego California USA, www.graphpad.com.), con un limite de confianza de 5% (p < 0,05).
Resultados
La suplementacion con AGPICL n-3 mas AOEV reduce el incremento de peso del tejido adiposo visceral y la acumulacion de grasa en higado inducida por DAG
Los animales de los diferentes grupos experimentales no presentaron diferencias (p < 0,05) en el peso inicial, no obstante, a las 12 semanas de intervención, los ratones alimentados con DAG (con o sin suplementación) presentaron un incremento significativo de peso corporal respecto a los animales alimentados con DC (Tabla 1A). El peso del hígado no presentó diferencias (p < 0,05) entre los grupos experimentales. El peso del tejido adiposo visceral aumentó significativamente en los animales que recibieron DAG, pero en aquellos que fueron suplementados con AGPICL n-3 este incremento fue menor (p < 0,05), respecto a los no suplementados con este tipo de ácidos grasos (Tabla 1A). La DAG generó un incremento (p < 0,05) en el contenido de grasa hepática total y en los TAG hepáticos (Tabla 1B). La suplementación con AGPICL n-3 más AOEV en los ratones alimentados con DAG generó un menor incremento en estos parámetros de esteatosis hepatica, comparados con el grupo alimentado con DC. No obstante, dicha suplementacion, no logro normalizar los niveles de grasa total y TAG hepaticos respecto al grupo control (Tabla 1B). La suplementacion con AGPICL n-3 mas AOEV previene la insulino resistencia generada por DAG Los animales que recibieron DAG presentaron un incremento significativo en la glicemia, insulinemia y HOMA respecto al grupo control, mientras que la suplementacion con AGPICL n-3 mas AOEV logro normalizar los parametros evaluados (Tabla 1C). Siendo interesante destacar que la suplementacion en forma separada de AGPICL n-3 o AOEV en aquellos ratones alimentados con DAG no redujo (p < 0,05) las alteraciones en dichos parametros, comparados con los animales que recibieron DC (Tabla 1C). Efectos de la suplementacion con AGPICL n-3 mas AOEV en el perfil de acidos grasos hepaticos totales en los ratones alimentados con DAG o DC Los animales alimentos con DAG presentaron un incremento (p < 0,05) en los niveles hepaticos de acidos grasos saturados (AGS), acido palmitico (C16:0) y en la relacion AGPICL n-6/n-3, observandose ademas una reduccion (p < 0,05) en los niveles de AGPI, AGPICL n-6, AGPICL n-3, acido linoleico (C18:2 n-6, AL), acido alfalinolenico (C18:3 n-3, ALA), acido araquidonico (C20:4 n-6, AA), EPA y DHA (Tabla 2). Mientras que en el grupo alimentado con DAG suplementado con AGPICL n-3 mas AOEV se observo una normalizacion en los niveles hepaticos de AGS, acido palmitico, ALA, respecto al grupo control. Sin embargo, dicha suplementacion no logro normalizar los niveles hepaticos de los AGPI, AGPICL n-6, AGPICL n-3, AA, EPA y DHA (Tabla 2). Normalizacion de la actividad de union de PPARal ADN en ratones alimentados con DAG luego de la suplementacion con AGPICL n-3 mas AOEV En los ratones alimentados con DAG se observo una reduccion (p < 0,05) en la actividad de union de PPAR-α al ADN respecto al grupo alimentado con DC. A su vez el grupo alimentado con AGPICL n-3 mas AOEV logro normalizar la actividad de union de PPAR-α al ADN (Figura 1). Ademas, en los grupos alimentados con DC y suplementados con AGPICL n-3 (grupo b y d) se observo un incremento en la actividad de union de PPAR-α al ADN, comparado con el grupo control, sin embargo, en el grupo alimentado con DAG más suplementación con AGPICL n-3 sin AOEV no se observó este efecto (Figura 1). La DAG reduce la actividad de las enzimas antioxidantes hepáticas catalasa y SOD en ratones; efectos normalizados por la suplementación con AGPICL n-3 más AOEV La DAG generó en los animales una drástica y significativa reducción en la actividad de las enzimas antioxidantes hepáticas catalasa (Figura 2A) y SOD (Figura 2B) 51% y 20% respectivamente. Reducción que fue normalizada en aquellos ratones alimentados con DAG que fueron suplementados con AGPICL n-3 más AOEV (Figura 2 A-B), respecto al grupo alimentado con DC. Siendo interesante mencionar que la suplementación con AOEV en los ratones alimentados con DAG si bien logra reducir (p < 0,05) la caída en la actividad de ambas enzimas, este efecto no logra normalizar dicha actividad respecto al grupo control.
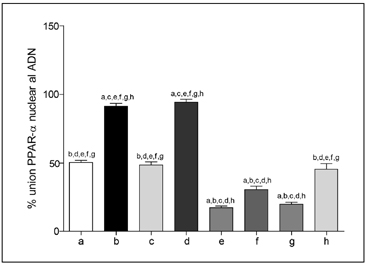 Figura 1. Actividad de union de PPAR-ƒ¿ nuclear al DNA ratones alimentados con DC o DAG, sometidos a la suplementacion con AGPICL n-3, AOEV o AGPICL n-3 + AOEV. Los valores corresponden al porcentaje de union de PPAR-ƒ¿ respecto a un control positivo mediante ELISA y son } D.S.M. para 9 animales por grupo. La significancia de las diferencias entre los valores promedio de los animales controles y los tratados (p < 0,05; Anova unifactorial y test Newman-Keuls) se indica con las letras de los respectivos grupos.
Figura 1. Actividad de union de PPAR-ƒ¿ nuclear al DNA ratones alimentados con DC o DAG, sometidos a la suplementacion con AGPICL n-3, AOEV o AGPICL n-3 + AOEV. Los valores corresponden al porcentaje de union de PPAR-ƒ¿ respecto a un control positivo mediante ELISA y son } D.S.M. para 9 animales por grupo. La significancia de las diferencias entre los valores promedio de los animales controles y los tratados (p < 0,05; Anova unifactorial y test Newman-Keuls) se indica con las letras de los respectivos grupos.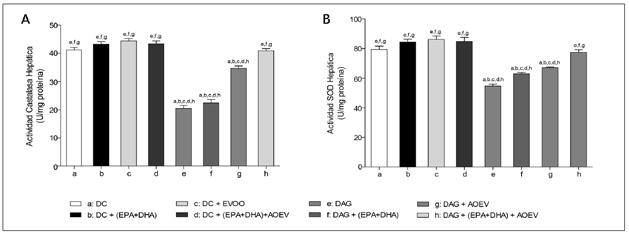 Figura 2. Cambios en la actividad de las enzimas antioxidantes catalasa y superóxido dismutasa de ratones alimentados con DC o DAG, sometidos a la suplementación con AGPICL n-3, AOEV o AGPICL n-3 + AOEV. Grupos experimentales: DC(a); DC+(EPA+DHA)(b); DC+AOEV(c); DC+(EPA+DHA+AOEV)(d); DAG(e); DAG+(EPA+DHA)(f); DAG+AOEV)(g); DAG+(EPA+DHA+AOEV)(h). Los valores corresponden al promedio ± D.S.M. para 8-10 animales por grupo. La significancia de las diferencias entre los valores promedio de los animales controles y los tratados (p < 0,05; Anova unifactorial seguido de test de Newman-Keuls) se indica con las letras de los respectivos grupos.
Figura 2. Cambios en la actividad de las enzimas antioxidantes catalasa y superóxido dismutasa de ratones alimentados con DC o DAG, sometidos a la suplementación con AGPICL n-3, AOEV o AGPICL n-3 + AOEV. Grupos experimentales: DC(a); DC+(EPA+DHA)(b); DC+AOEV(c); DC+(EPA+DHA+AOEV)(d); DAG(e); DAG+(EPA+DHA)(f); DAG+AOEV)(g); DAG+(EPA+DHA+AOEV)(h). Los valores corresponden al promedio ± D.S.M. para 8-10 animales por grupo. La significancia de las diferencias entre los valores promedio de los animales controles y los tratados (p < 0,05; Anova unifactorial seguido de test de Newman-Keuls) se indica con las letras de los respectivos grupos.
Tabla 1. Parámetros generales y bioquímicos en los ratones alimentados con DC o DAG sometidos a suplementación dietaria con AGPICL n-3, AOEV o AGPICL n-3 + AOEV
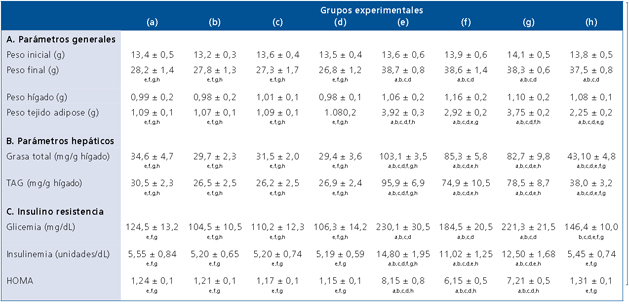
Grupos experimentales: DC(a); DC+(EPA+DHA)(b); DC+AOEV(c); DC+(EPA+DHA+AOEV)(d); DAG(e); DAG+ (EPA+DHA)(f); DAG+AOEV)(g); DAG+(EPA+DHA+AOEV)(h). Los valores corresponden al promedio ± DSM para 8-10 animales por grupo. La significancia de las diferencias entre los valores promedio de los animales controles y los tratados (p < 0,05; Anova unifactorial seguido de test de Newman-Keuls) se indica con las letras de los respectivos grupos.
Tabla 2. Composición de ácidos grasos hepáticos totales obtenidos de ratones alimentados con DC o DAG, sometidos a la suplementación con AGPICL n-3, AOEV o AGPICL n-3 + AOEV
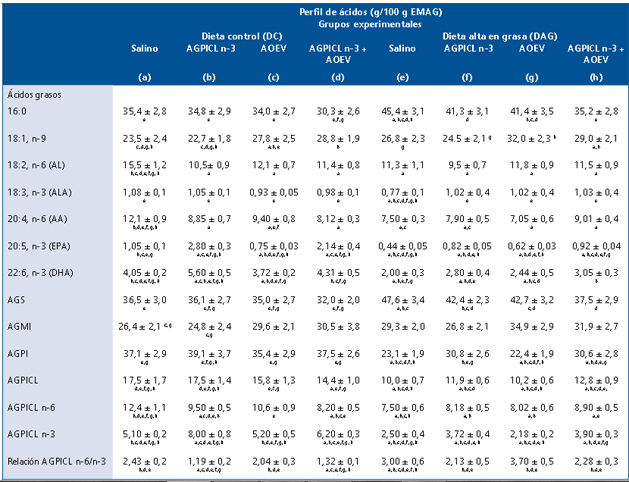
Los valores son expresados como g de ácidos grasos por 100 g de EMAG y corresponden al promedio ± D.S.M. para 8-10 animales por grupo. Grupos experimentales: DC(a); DC+(EPA+DHA)(b); DC+AOEV(c); DC+(EPA+DHA+AOEV)(d); DAG(e); DAG+ (EPA+DHA)(f); DAG+AOEV)(g); DAG+(EPA+DHA+AOEV)(h). Ácidos grasos saturados (AGS) corresponden a 14:0, 16:0 y 18:0. Ácidos grasos monoinsaturados (AGMI) corresponden a 14:1, n-7, 16:1, n-7 y 18:1, n-9. Ácidos grasos poliinsaturados (AGPI) corresponden a 18:2, n-6, 18:3, n-3, 20:4, n-6, 20:5, n-3, y 22:6, n-3. Ácidos grasos poliinsaturados de cadena larga (AGPICL) corresponden a 20:4, n-6 (AGPICL n-6), 20:5, n-3 y 22:6, n-3 (AGPICL n-3). La significancia de las diferencias entre los valores promedio de los animales controles y los tratados (p < 0,05; Anova unifactorial seguido de test de Newman-Keuls) se indica con las letras de los respectivos grupos. Relación AGPICL n-6/n-3: 20:4, n-6/ (20:5, n-3 + 22:6, n-3).
Discusion y Conclusion
La DAG genero en los animales un incremento significativo en i) el peso corporal y del tejido adiposo visceral; ii) la acumulacion de grasa total y TAG en higado; iii) insulino resistencia, situacion que ha sido descrita en otros estudios21,22. Siendo la interrelacion entre el estres oxidativo, la inflamacion y la insulino resistencia generada por esta dieta uno de los factores claves en el desarrollo de EHGNA3. Respecto a los mecanismos patogenicos involucrados en el desarrollo de la esteatosis hepatica y posterior evolucion a la EHGNA, es posible observar que una regulacion negativa del factor de transcripcion PPAR-α, acompanada de un incremento en la actividad de los factores de transcripcion PPAR-γ y SREBP-1c (del ingles sterol regulatory element-binding protein 1), cambios que generan importantes alteraciones del metabolismo hepatico, favoreciendo la lipogenesis de novo e inhibiendo tanto la oxidacion como exportacion de acidos grasos desde el higado a otros organos5. Ademas, en animales alimentados con DAG, se observa una directa correlacion entre el estres oxidativo inducido por esta dieta con la reduccion en la actividad de las enzimas desaturasas hepaticas (Δ-5 y Δ-6), situacion que repercute en una disminucion en los niveles tisulares de AGPICL n-6 y n-322. Efecto que tambien se observa en este estudio (Tabla 2). Otro aspecto interesante de discutir es que un estres oxidativo prolongado o de gran intensidad inducido por especies reactivas del oxigeno y nitrogeno, es capaz de deteriorar irreversiblemente estructuras sub-celulares, especialmente las membranas mitocondriales23, desencadenando una cascada inflamatoria y fibrogenica en el higado24, lo cual se refleja por ejemplo en la caida en la actividad de las enzimas antioxidantes hepaticas, tales como la catalasa y SOD (Figura 2 A-B). En relacion a la insulino resistencia, esta es una alteracion asociada a la obesidad, la cual favorece aun mas la esteatosis hepatica25, observandose que la insulino resistencia estimula por retroalimentacion β-pancreatica un aumento en la secrecion de insulina26. Fomentandose la secrecion de acidos grasos desde el tejido adiposo al plasma (lipolisis), aportando asi mas sustrato al higado para realizar lipogenesis27. En la esteatosis hepatica, una exposicion permanente y excesiva de glucosa y acidos grasos libres (AGL), puede generar glucotoxicidad y lipotoxicidad28, fenomenos fuertemente asociados a condiciones de estres oxidativo e inflamacion23, y el desarrollo de esteatohepatitis. EL EPA y DHA (AGPICL n-3) tienen importantes efectos cito-protectores, especialmente frente al sindrome metabolico y las enfermedades cardiovasculares9, mediados principalmente por i) un cambio en la composicion de los fosfolipidos de membrana, favoreciendo la incorporacion de diversos receptores, y por ende la mantencion de vias de senalizacion incluidos el de la insulina; ii) la disminucion en la sintesis de eicosanoides con efectos pro-inflamatorios derivados del AA y iii) la produccion de eicosanoides y docosanoides derivados de AGPICL n-3, con importantes efectos antiinflamatorios9. Ademas, estos acidos grasos al activar a PPAR-α, favorecen la expresion de genes que participan en la oxidacion de acidos grasos, lo cual sumado a la represion generada por estos mismos acidos grasos sobre la actividad de union al ADN, producen un estado anti-lipogenico a nivel hepatico29,30. Estableciendose incipientemente que isoprostanos de la serie J3 (compuestos derivados del EPA y DHA) participarian en la activacion del factor de trascripcion Nrf2 (del ingles nuclear erythroid 2-related factor), favoreciendo un incremento en la capacidad antioxidante intracelular31. En relacion al AOEV, los antioxidantes que este posee le permiten disminuir la oxidacion de la LDL, lo cual ayuda a prevenir el desarrollo de ateroesclerosis y enfermedad cardiovascular15,16. Ademas de lograr una reduccion en la generacion de especies reactivas del oxigeno32, incrementando la capacidad antioxidante del plasma y reduciendo los niveles de F-2 isoprostanos (compuestos derivados de la oxidacion especifica del AA)33. El AOEV permite tambien mejorar la relacion GSH/GSSG, y aumentar la actividad de la glutation peroxidasa (GSH-Px) en eritrocitos33, siendo este uno de los principales efectos protectores del AOEV frente a la lipoperoxidacion y formacion de placas de ateroma34. Dentro de los polifenoles presentes en el AOEV, el HT activaria tambien a Nrf2, fortaleciendo aun mas la capacidad de respuesta antioxidante a nivel intracelular35. En conclusion, la suplementacion dietaria con suplementacion con AGPICL n-3 (EPA+DHA) mas AOEV, logro prevenir la esteatosis hepatica, insulino resistencia y la perdida de la defensa antioxidante (actividad de las enzimas Catalasa y SOD) en ratones alimentados con DAG. Siendo la conservacion de la actividad de union del factor de transcripcion PPAR- al ADN uno de los mecanismos involucrados en estos efectos, lo cual requiere continuar con mas estudios al respecto.
Agradecimientos
Los autores agradecen a la Sociedad Chilena de Endocrinologia y Diabetes (SOCHED 2013-04 PROYECTO) por financiar esta investigacion.
Referencias bibliograficas
- Byrne CD. 2012. Non-alcoholic fatty liver disease, insulin resistance and ectopic fat: a new problem in diabetes managemen t. Diabet Med 29: 1098-1107.
- Ratziu V, Bellentani S, Cortez-Pinto H, et al. 2010. A position statement on NAFLD/NASH based on the EASL 2009 special conference. J Hepatol 53: 372-384.
- Videla LA, Rodrigo R, Araya J, et al. 2006. Insulin resistance and oxidative stress interdependency in non-alcoholic fatty liv er disease. Trends Mol Med 12: 555-558.
- Charlton MR, Burns JM, Pedersen RA, et al. 201 1. Frequency and outcomes of liver transplantation for nonalcoholic steatohepati tis in the United States. Gastroenterology 141: 1249-1253.
- Musso G, Gambino R, Cassader M. 2009. Recent insights into hepatic lipid metabolism in non-alcoholic fatty liver disease (NAFLD). Prog Lipid Res 48: 1-26.
- Araya J, Rodrigo R, Videla LA, et al. 2004. Increase in long-chain polyunsaturated fatty acid n-6/n-3 ratio in relation to hepatic steatosis in patients with non-alcoholic fatty liver disease. Clin Sci (Lond) 106: 635-643.
- Valenzuela R, Videla LA. 2011. The importance of the longchain polyunsaturated fatty acid n-6/n-3 ratio in development o f non-alcoholic fatty liver associated with obesity. Food Funct 2: 644-648.
- Campoy C, Escolano-Margarit MV, Anjos T, et al. 2012. Omega 3 fatty acids on child growth, visual acuity and neurodevelopment . Br J Nutr 107: S85-106.
- Poudyal H, Panchal SK, Diwan V, et al. 2011. Omega-3 fatty acids and metabolic syndrome: effects and emerging mechanisms of action. Prog Lipid Res 50: 372-387.
- Sun C, Wei ZW, Li Y. 2011. DHA regulates lipogenesis and lipolysis genes in mice adipose and liver. Mol Biol Rep 38: 731-737.
- Tsuduki T, Honma T, Nakagawa K, et al. 2011. Long-term intake of fish oil increases oxidative stress and decreases lifespan in senescence-accelerated mice. Nutrition 27: 334-337.
- Baarine M, Andreoletti P, Athias A, et al. 2012. Evidence of oxidative stress in very long chain fatty acid-treated oligodendrocytes and potentialization of ROS production using RNA interference-directed knockdown of ABCD1 and COX1 peroxisomal proteins. Neuroscience 213: 1-18.
- Cicerale S, Lucas LJ, Keast RS. 2012. Antimicrobial, antioxidant and anti-inflammatory phenolic activities in extra vir gin olive oil. Curr Opin Biotechnol 23: 129-135.
- Cicerale S, Conlan XA, Sinclair AJ, et al. 2009. Chemistry and health of olive oil phenolics. Crit Rev Food Sci Nutr 49: 218-2 36.
- Covas MI, Nyyssonen K, Poulsen HE, et al. 2006. The effect of polyphenols in olive oil on heart disease risk factors: a rando mized trial. Ann Intern Med 145: 333-341.
- 16. De la Torre-Carbot K, Chavez-Servin JL, Jauregui O, et al. 2010. Elevated circulating LDL phenol levels in men who consumed virgin rather than refined olive oil are associated with less oxidation of plasma LDL. J Nutr 140: 501-508.
- Matthews DR, Hosker JP, Rudenski AS, Naylor BA, Treacher DF, Turner RC. 1985. Homeostasis model assessment: insulin resistance and beta-cell function from fasting plasma glucose and insulin concentrations in man. Diabetologia 28: 412-419.
- Bligh EG, Dyer WJ. 1959. A rapid method of total lipid extraction and purification. Can J Biochem Physiol 37: 91 1-917.
- Morrision WR, Smith LM. 1964. Preparation of fatty acid methyl esters and dimethylacetals from lipids with boron fluoride-metan ol. J Lipid Res 5: 600-608.
- Luck H. 1965. Methods of Enzymatic Assay ed. H.U. Bermayer, Academicv Press, New York pp. 885-894.
- Valenzuela R, Espinosa A, Gonzalez-Manan D, DfEspessailles A, Fernandez V, Videla LA, et al. 2012. N-3 long-chain polyunsaturated fatty acid supplementation significantly reduces liver oxidative stress in high fat induced steatosis. PLoS One 7:e46400.
- Valenzuela R, Barrera C, Espinosa A, Llanos P, Orellana P, Videla LA. 2015. Reduction in the desaturation capacity of the l iver in mice subjected to high fat diet: Relation to LCPUF A depletion in liver and extrahepatic tissues. Prostaglandins Leukot Essent Fa tty Acids 98: 7-14.
- Videla LA, Rodrigo R, Orellana M, et al. 2004. Oxidative stress-related parameters in the liver of non-alcoholic fatty l iver disease patients. Clin Sci (Lond) 106: 261-268.
- Serviddio G, Sastre J, Bellanti F, et al. 2008. Mitochondrial involvement in non-alcoholic steatohepatitis. Mol Aspects Med 29: 22-35.
- Houstis N, Rosen ED, Lander ES. 2006. Reactive oxygen species have a causal role in multiple forms of insulin resistance. Nat ure 440: 944-948.
- Videla LA, Rodrigo R, Araya J, et al. 2004. Oxidative stress and depletion of hepatic long-chain polyunsaturated fatty acids may contribute to nonalcoholic fatty liver disease. Free Radic Biol Med 37: 1499-1507.
- Newsholme P, Haber EP, Hirabara SM, et al. 2007. Diabetes associated cell stress and dysfunction: role of mitochondrial a nd non-mitochondrial ROS production and activity. J Physiol 583: 9-24.
- Anderson N, Borlak J. 2008. Molecular mechanisms and therapeutic targets in steatosis and steatohepatitis. Pharmacol Rev 60: 311-357.
- Clarke SD. 2004. The multi-dimensional regulation of gene expression by fatty acids: polyunsaturated fats as nutrient sen sors. Curr Opin Lipidol 15: 13-18.
- Tapia G, Valenzuela R, Espinosa A, Romanque P, Dossi C, Gonzalez-Manan D, et al. 2014. N-3 long-chain PUFA supplementation prevents high fat diet induced mouse liver steatosis and inflammation in relation to PPAR-α upregulation and NF-kB DNA binding abrogation. Mol Nutr Food Res 58: 1333-1341.
- Gao L, Wang J, Sekhar KR, et al. 2007. Novel n-3 fatty acid oxidation products activate Nrf2 by destabilizing the associati on between Keap1 and Cullin3. J Biol Chem 282: 2529-2537.
- Nakbi A, Dabbou S, Champion S, et al. 201 1. Modulation of superoxide anion production and MMP-9 expression in PMA stimulated THP-1 cells by olive oil minor components: tyrosol and hydroxytyrosol. Food Res Int 44: 575-581.
- Bogani P, Galli C, Villa M, et al. 2007. Postprandial antiinflammatory and antioxidant effects of extra virgin olive oil. Atherosclerosis 190: 181-186.
- Weinbrenner T, Fito M, de la Torre R, et al. 2004. Olive oils high in phenolic compounds modulate oxidative/antioxidative status i n men. J Nutr 134: 2314-2321.
- Zhu L, Liu Z, Feng Z, Hao J, Shen W, Li X, et al. 2010. Hydroxytyrosol protects against oxidative damage by simultaneou s activation of mitochondrial biogenesis and phase II detoxifying enzyme systems in retinal pigment epithelial cells. J Nutr Bioc hem 21: 1089-1098.