Efecto del ejercicio sobre la inflamación y ferritina sérica en pacientes con obesidad y diabetes mellitus 2
Pablo Orellano C¹, Christopher Rivera H², Jenifer Silva M³, Raúl Pisabarro G4, Mauricio Gutiérrez A5, Germán Botto N6.
Effect of exercise on inflammation and serum ferritin in patients with obesity and type 2 diabetes mellitus
1Profesor Adjunto del Departamento de Endocrinología y Metabolismo, Facultad de Medicina, Uruguay. 2. Postgrado del Departamento de Endocrinología y Metabolismo, Facultad de Medicina, Uruguay. 3. Residente del Departamento de Endocrinología y Metabolismo, Facultad de Medicina, Uruguay. 4. Colabo rado r Cal i f icado del Departamento de Endocrinología y Metabolismo, Facultad de Medicina, Uruguay. 5. Profesor de Endocr inología y Metabolismo, Facultad de Medicina, Uruguay. 6. Asistente del Departamento de Métodos Cuantitativos.PhD Student | Fulbright Scholar Montana State University.
Correspondencia:
Pablo Orellano.
Correo: porellanoc@gmail.com
Ciudad de la Costa. Canelones. Uruguay. CD 15005
Cátedra de Endocrinología y Metabolismo Hospital de Clínicas “Dr. Manuel Quíntela” Av. Italia S/N, 11600 Montevideo-Uruguay.
Numero Fax: 0059824809267
Recibido: 27-05-2018
Aceptado: 03-08-2018
Abstract:Type 2 Diabetes Mellitus (DM2) is considered a chronic inflammatory and systemic disease of low degree of intensity that promotes other pathologies such as cardiovascular disease, cancer and cognitive impairment. The relationship between inflammatory markers and insulin resistance in obese patients is known. Low-grade inflammation is an independent predictor of chronic diseases and mortality from all causes. Ferritin may be increased in DM2, but it is not clear if its cause is hyperglycemia or chronic inflammation. Objective: To evaluate the impact of a twenty-week program of exercise and diet on the markers of inflammation, metabolic control and the value of ferritin in a sample ofobesepatientswithDM2, assisted in our National Health System. Materials and Methods: Open, controlled and randomized clinical trial in primary care patients. Of 161 patients with DM2 evaluated 35 fulfilled the inclusion criteria. They were divided into two homogeneous groups (control and intervention). Blood was taken from both groups to measure Ferritin along with other inflammatory and metabolic markers, before and after the exercise and diet program. These variables and the changes in serum Ferritin were analyzed. Results: At the beginning of the study Ferritin was elevated in 72.2% and 52.9% of the control and intervention group respectively. In the end, there was a significant difference between the groups, with benefit of the intervention group in the decrease of Interleukin-6, glycosylated hemoglobin, waist and body mass index. There was a non-significant decrease in C-reactive protein and Ferritin. This last one was not related to the other variables. The control group showed no significant decrease of any variable Conclusions: To apply a program of controlled exercise and diet, in the usual treatment of patients with DM2, improves inflammation and glucose homeostasis, discernible by the decrease in inflammatory parameters and by the improvement in the glycemic control. Serum ferritin was not useful to predict the metabolic control of these patients and assess the response to treatment.
Keywords: Ferritin; Type 2 Diabetes Mellitus; Obesity; Inflammation.
Resumen: Introducción: La diabetes mellitus 2 (DM2) es considerada una enfermedad inflamatoria crónica y sistémica de bajo grado de intensidad que promueve otras patologías. Es conocida la relación entre |inflamación e insulino resistencia en pacientes obesos, siendo un predictor independiente de morbimortalidad por todas las causas. Ferritina puede estar aumentada en la DM2, no es claro si su causa es la hiperglucemia o la inflamación crónica. Objetivo: Evaluar el impacto de un programa de veinte semanas de ejercicio y dieta sobre los marcadores de inflamación, control metabólico y el valor de ferritina en una muestra de pacientes con DM2 obesos. Materiales y Métodos: Ensayo clínico abierto, controlado y randomizado en pacientes del nivel primario de atención. Se evaluaron 35 pacientes con DM2 que se dividieron en dos grupos homogéneos (control e intervención). Se extrajo sangre para medir Ferritina, marcadores inflamatorios y metabólicos, antes y luego del programa de ejercicio y dieta. Analizamos los cambios de esas variables. Resultados: Ferritina estaba elevada en el 72.2% y 52.9% del grupo control e intervención respectivamente. Al final hubo una diferencia significativa entre los grupos, con beneficio del grupo intervención en el descenso de Interleucina-6, hemoglobina glicosilada, cintura e índice de masa corporal. Hubo un descenso no significativo de Ferritina y Proteína C reactiva. Ferritina no presentó relación con las demás variables. En el grupo control no hubo descenso significativo de ninguna variable. Conclusiones: Aplicar un programa de ejercicio controlado y dieta, en el tratamiento de pacientes con DM2, mejora la inflamación y la homeostasis de la glucosa, discernible por el descenso de parámetros inflamatorios y por la mejora en el control glucémico. Ferritina sérica no fue útil para predecir el control metabólico y valorar la respuesta al tratamiento.
Palabras claves: Ferritina; Diabetes mellitus tipo 2; Obesidad; Inflamación.
Introducción
La DM2 considerada como una pandemia metabólica del siglo XXI aumenta dramáticamente en el mundo occidental al igual que la obesidad. Es responsable del 7% de la mortalidad global y se estima que para el año 2035 habrá 600 millones de casos nuevos1. Se la considera una enfermedad inflamatoria crónica y sistémica de bajo grado de intensidad (EICSBI) que promueve otras patologías como enfermedad cardiovascular y cáncer2,3,4. Similar connotación tiene la obesidad centro abdominal de riesgo cardiometabólico5,6. Es conocida la relación entre los marcadores de EICSBI con la insulino resistencia (IR) en pacientes DM2 obesos7,8.
La proteína Ferritina tiene un rol primordial en el almacenamiento del hierro libre y por su acción ferro oxidasa protege a los tejidos del daño oxidativo9. En ausencia de hemocromatosis el exceso de ferritina en DM2 se produce sin una sobrecarga real de hierro10. El hierro puede ser liberado de la molécula de ferritina en presencia de especies reactivas del oxígeno generadas por fenómenos inflamatorios a través de citoquinas como el factor de necrosis tumoral alfa (TNF-α), Interleuquina-6 (IL-6) Interleuquina-1 (IL-1)11. Se describe una alta prevalencia de ferritina elevada en enfermos con DMT29,12. Numerosos estudios la relacionan a IR y a un aumento en el riesgo de desarrollar DM213,14.También se ha encontrado una correlación entre el nivel sérico de ferritina y el control glucémico en pacientes con DM2 establecida15,16,17.
El ejercicio regular es un pilar terapéutico en el tratamiento de la DM218,19. Los marcadores de inflamación disminuyen con la pérdida de peso a través de la dieta y ejercicio20,21. El descubrimiento de citoquinas y mioquinas anti-inflamatorias que produce la contracción muscular contribuye al conocimiento del efecto beneficioso del ejercicio en la salud general, confirmando su eficacia como terapia no farmacológica en el EICSBI22,23.
La influencia de la dieta es capital en la terapéutica de la DM2. Una revisión importante, analizó la relación entre la dieta occidental (pro inflamatoria) con enfermedad cardiovascular y metabólica con resultados relevantes24. A nivel molecular el receptor TLR4 se activa con los ácidos grasos saturados de la dieta provocando señales pro-inflamatorias y activación del factor nuclear kB (NF-kB)25,26 determinando enfermedades inflamatorias como DM2, obesidad, dislipemia y enfermedad cardiovascular27.
En este contexto de inflamación e hiperglucemia crónica la ferritina sérica elevada parece ser la consecuencia de sus eventos moleculares. Su fácil acceso como valoración de laboratorio puede hacerla útil como marcador de respuesta al tratamiento en DM2.
Objetivos del estudio
- Determinar el impacto de un programa de veinte semanas de ejercicio controlado (PVSEC) y dieta, en el valor de ferritina sérica, los marcadores de inflamación y de control metabólico en una muestra de DM2 asistidos en nuestro Sistema Nacional de Salud (SNS).
- Evaluar la asociación entre ferritina, otros marcadores de inflamación y de control metabólico.
Métodos
Población de estudio
Ensayo clínico abierto, randomizado, controlado acorde a los protocolos CONSORT con un programa de ejercicio y dieta de 20 semanas de duración en pacientes asistidos en el primer nivel de atención de las instituciones de salud de la ciudad de Mercedes, Soriano, Uruguay. Participan; Hospital Zoilo A. Chelle (público), CAMS IAMPP (privado). Un total de 161 paciente fueron evaluados, 39 pacientes cumplieron con los criterios de inclusión de los cuales 4 pacientes rechazaron su participación en el ensayo clínico. Fueron aleatorizados 35 pacientes.
Los participantes fueron asignados al grupo de intervención o grupo control por técnica de muestreo simple. La aleatorización fue realizada por el Coordinador del proyecto que no tuvo contacto con los pacientes o sus datos, utilizando la función “RANDOM” del software Microsoft Excel. El grupo intervención le fue comunicado por el coordinador del proyecto al investigador que trataba al paciente.
Se dividió en un grupo intervención con 17 pacientes y grupo control con 18 pacientes.
Un paciente asignado al grupo intervención no pudo participar del programa de ejercicio por problema geográfico. Fue analizado en su grupo original. Del grupo control se excluyeron dos pacientes que no concurrieron a la segunda evaluación bioquímica.
Los participantes aceptaron voluntariamente y firmaron un consentimiento informado. El estudio fue aprobado por el Comité de Ética del Hospital de Clínicas, Hospital Universitario del Uruguay.
En la figura 1 se muestra un diagrama de flujo de la selección de participantes basada en los criterios de inclusión y exclusión.
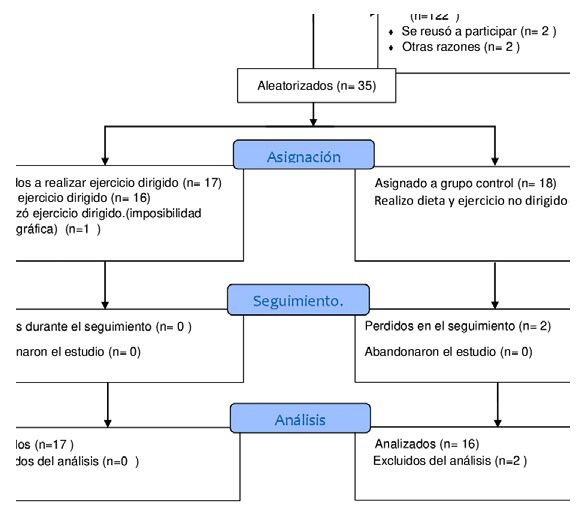 Figura 1. Diagrama de selección de pacientes.
Figura 1. Diagrama de selección de pacientes. Criterios de inclusión
1) DM2 entre 55 - 70 años, con >5 años en tratamiento con
antidiabéticos orales.
2) Obesos IMC ≥ 30 kg/m2.
3) Sedentarios (Menos de 150 min. de actividad física/semana).
Criterios de exclusión
1) Hábito tabáquico.
2) Alcoholismo.
3) Psicofármacos.
4) Patología psiquiátrica mayor-
5) Tratamiento con insulina.
6) Tratamiento con betabloqueantes.
7) Retinopatía diabética severa.
8) Neuropatía diabética severa.
9) Pie diabético u otra lesión que impida el buen deambular.
10) Patología cardiovascular que contraindique el ejercicio,
evento cardíaco en los últimos 6 meses o arteriopatía de
miembros inferiores.
11) Enfermedad renal severa.
12) Cualquier enfermedad que contraindique el programa de
ejercicio.
Evaluación
Los pacientes seleccionados eran sedentarios, según las recomendaciones de la CDC y el Colegio Americano de Medicina del Deporte28.
Se realizaron medidas antropométricas, peso altura, índice de masa corporal (IMC) y cintura abdominal. Para evaluar las variables antropométricas se usó la balanza Seca 700, báscula con pesas deslizantes, con división mínima de 50g y capacidad máxima de 220 kg. Equipada con tallímetro Seca 220, con divisiones mínimas de 1 mm y rango de medición entre: 60 a 220 cm. El IMC fue calculado a partir de la fórmula: peso (kg)/talla2 (m).Obesidad abdominal; circunferencia ≥102 cm masculino, ≥88cm femenino (Americanos).
Todos los individuos fueron evaluados por un cardiólogo del SNS.
Para las variables bioquímicas se obtuvieron muestras de sangre en ayunas (8 horas) al inicio y al final del estudio.
Evaluación metabólica: HbA1c total medida por Inhibición de Aglutinación de látex Equipamiento DCA 2000 Bayer-Siemens.
El colesterol total, lipoproteínas de alta densidad, triglicéridos fueron realizados por métodos convencionales.
Marcadores inflamatorios medidos: IL-6 mediante Electroquimioluminicecia (ECLIA). Equipo Cobas E 411, Roche. Proteína C-reactiva (PCR), por inmunoturbimetría equipo Cobas C 311. Fibrinógeno, por Clauss equipo ACL 200 IZAZA
Ferritina se evaluó por Electroquimioluminicecia (ECLIA). Equipo Cobas E 411, Roche Los valores de referencia de ferritina fueron para mujeres mayores de 17 años: 13-150ng/ mL y para hombres mayores de 17 años: 30-400ng/mL.
Programa de veinte semanas de ejercicio controlado (PVSEC)
Antes y después del PVSEC fue evaluada la capacidad aeróbica de los sujetos por un médico deportólogo mediante la prueba de Rockport29.
El grupo intervención cumplió con un programa de veinte semanas de ejercicio. Se siguieron las recomendaciones del CDC y del Colegio Americano de Medicina del Deporte28. En el primer mes caminaron 45 minutos seis días por semana, con una intensidad moderada, y los 2 minutos finales con intensidad enérgica. El segundo mes se incrementó a 4 minutos de intensidad enérgica, el tercer mes a 6 minutos, el cuarto a 8 minutos, y el quinto mes (veinte semanas) a 10 minutos. Una enfermera caminó con los pacientes y controló la presión arterial, el pulso y los valores de glicemia con tirilla reactiva, al principio y al final del ejercicio diario. Al grupo control se le aconsejó caminar.
Una vez al mes, un médico deportólogo evaluó a ambos grupos de pacientes. Se obtuvo las muestras para bioquimica antes y después del PVSE.
Ambos grupos recibieron consejo nutricional sobre una dieta hipocalórica a cargo de nutricionista del SNS, de acuerdo a las recomendaciones de la Asociación Americana de Diabetes 2014.
El grupo control recibió recomendaciones generales del cuidado del paciente diabético y dieta pero no se controló el ejercicio realizado. Todos continuaron con sus tratamientos farmacológicos habituales. Se controlaron mensualmente. Cuando el estudio hubo finalizado se alentó a los pacientes a continuar con hábitos saludables.
El personal involucrado en la recolección y análisis de datos estadísticos fue cegado a la asignación del tratamiento de los participantes.
Métodos estadísticos
Para la comparación de proporciones entre grupos se utilizaron el test de Chi cuadrado (para la distribución de sexos) y el test exacto de Fisher (para la proporción de pacientes con valores de Ferritina por encima del umbral normal). Para comparar las distribuciones de variables continuas entre ambos grupos al comienzo del estudio, se utilizó el test de t de student para muestras independientes, con corrección de Welch para desigualdad de varianzas. En el caso de la Ferritina, se utilizó una alternativa no paramétrica: prueba de rangos de Wilcoxon, debido a la distribución marcadamente asimétrica de la variable. Para comparar la diferencia entre ambos grupos en el cambio observado en cada variable, se construyó para cada grupo una variable de diferencias individuales (final - inicial) y se compararon estas diferencias entre ambos grupos utilizando una prueba de rangos de Wilcoxon (ya que al utilizar las diferencias en cada grupo, los datos son independientes). En las variables que resultaron significativas en la comparación anterior, se evaluó el cambio dentro de cada grupo utilizando una prueba de signos de Wilcoxon para datos apareados. Para evaluar la asociación entre variables continuas se utilizaron gráficos de dispersión bivariados como herramienta exploratoria, y el coeficiente de correlación de spearman (ya que no había comportamiento lineal). Todo el análisis estadístico se realizó utilizando el lenguaje de programación R (versión 3.4.1) en RStudio (versión 1.0.153) (R Core Team, 201730; RStudioTeam, 201231.
Resultados
Al inicio del estudio, ambos grupos fueron homogéneos. No se encontraron diferencias significativas entre los grupos para ninguna de las variables analizadas (Tabla 1). La edad media era de 62 y 63 años para el grupo control e intervención respectivamente. Ferritina se encontraba elevada en ambos grupos según el sexo en 22 de los 35 pacientes.
No se encontró diferencia significativa (Test exacto de Fisher, valor-p= 0.3053) entre la proporción de pacientes con Ferritina por encima de los valores normal en ambos grupos (72.2% y 52.9% grupos control e intervención respectivamente), para cada paciente se consideró el límite en relación a su sexo (400 ng/ml en hombres y 150ng/ml en mujeres).
Las variables (IMC, HbA1c, Triglicéridos, Colesterol HDL, IL-6, PCR) al inicio del estudio no mostraron ninguna relación evidente con la Ferritina (Figura 2). Ninguna de estas relaciones resultó significativa en un análisis de correlación no paramétrica (coeficiente de correlación de Spearman, p>0.1 para todas las comparaciones, en ambos grupos).
Luego de PVSEC el grupo intervención mostro un aumento en su capacidad aeróbica en los diferentes grupos, con mayor incremento en aquellos que pasaron a una categoría de alta capacidad aeróbica, en 36.4% (Figura 3).
| Variable (unidades) | Grupo Control | Grupo Intervención | Valor-p |
| Sexo (Mas : Fem) | 7:11 | 5:12 | 0.8149 |
| Edad (años) | 62.83 ± 6.95 | 63.71 ± 5.47 | 0.6817 |
| IMC (Kg/m2) | 32.89 ± 3.16 | 32.73 ± 1.91 | 0.8548 |
| Cintura (cm) | 110.33 ± 9.06 | 107.65 ± 8.11 | 0.3614 |
| Cintura Hombres (cm) | 116.43 ± 7.28 | 111.00 ± 3.67 | |
| Cintura Mujeres (cm) | 106.45 ± 8.07 | 106.25 ± 9.14 | |
| HbA1c (%) | 7.03 ± 1.14 | 7.15 ± 1.29 | 0.7748 |
| Colesterol Total (<200mg/dl) | 192.83 ± 37.28 | 185.29 ± 46.16 | 0.6001 |
| HDL (mg/dl) | 44 ± 11.23 | 49.24 ± 10.62 | 0.1657 |
| Triglicéridos (<150mg/dl) | 173.11 ± 73.3 | 162.76 ± 49.94 | 0.6275 |
| Ferritina | 357.11 ± 239.29 | 319.41 ± 329.23 | 0.2188 |
| PCR (0-5mg/L) | 3.84 ± 3.28 | 2.92 ± 2.72 | 0.3714 |
| IL-6 (1-7pg/ml) | 3.3 ± 1.63 | 4.51 ± 3.2 | 0.1762 |
| Fibrinógeno (220-496mg/dl) | 299.28 ± 80.57 | 345.59 ± 46.82 | 0.0457 |
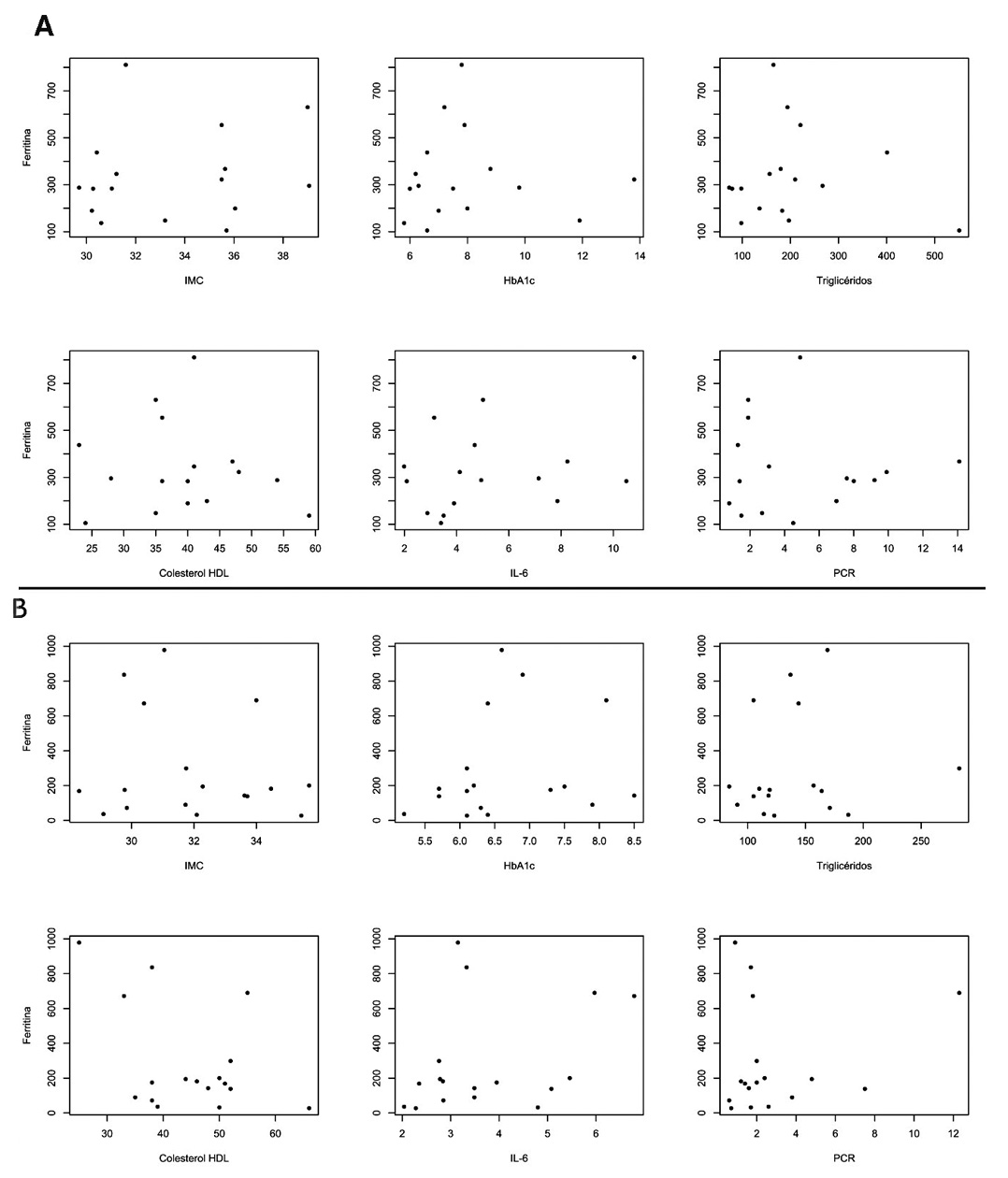
Figura 2. Distribución al inicio del estudio de Ferritina en función del Índice de masa corporal (IMC), Hemoglobina glicosilada (HbA1c), Triglicéridos, Colesterol HDL, Interleucina 6 (IL-6) y Proteina Reactiva C (PCR); en el grupo control (A) y grupo intervención (B).
Tabla 2. Última pregunta de la encuesta a los 300 alumnos, identificando la fuente de la información que los encuestados poseían sobre la Diabetes mellitus tipo 2. Todos los números representan porcentajes.
| Grupo Control | Grupo Intervención | Valor-p | |||
| Variable (unidades) | Inicio | Final | Inicio | Final | |
| IMC (Kg/m2) | 32.89 ± 3.16 | 33.42 ± 3.2 | 32.73 ± 1.91 | 31.94 ± 2.25 | <0.0001 |
| Cintura (cm) | 110.33 ± 9.06 | 110.5 ± 9.84 | 107.65 ± 8.11 | 106.06 ± 8.1 | * 0.0002 |
| HbA1c (%) | 7.03 ± 1.14 | 7.95 ± 2.21 | 7.15 ± 1.29 | 6.65 ± 0.92 | * 0.0035 |
| Colesterol Total (<200mg/dl) | 192.83 ± 37.28 | 199.69 ± 40.28 | 185.29 ± 46.16 | 185.06 ± 45.46 | 0.8288 |
| HDL (mg/dl) | 44 ± 11.23 | 39.38 ± 9.82 | 49.24 ± 10.62 | 44.71 ± 9.88 | 0.8850 |
| Triglicéridos (<150mg/dl) | 173.11 ± 73.3 | 200.62 ± 123.32 | 162.76 ± 49.94 | 140.06 ± 47.52 | 0.0938 |
| Ferritina | 357.11 ± 239.29 | 337.35 ± 191.26 | 319.41 ± 329.23 | 290.22 ± 302.91 | 0.7356 |
| PCR (0-5mg/L) | 3.84 ± 3.28 | 4.99 ± 3.91 | 2.92 ± 2.72 | 2.88 ± 2.97 | 0.1347 |
| IL-6 (1-7pg/ml) | 3.3 ± 1.63 | 5.26 ± 2.81 | 4.51 ± 3.2 | 3.73 ± 1.4 | * 0.0042 |
| Fibrinógeno (220-496mg/dl) | 299.28 ± 80.57 | 349.75 ± 63.58 | 345.59 ± 46.82 | 383.65 ± 64.18 | ~1.0000 |
Cuando comparamos los cambios pre y post intervención entre ambos grupos vemos que: IMC, Cintura, HbA1c e IL-6 mostraron diferencias estadísticamente significativas. (Tabla 2). Dentro de estas variables las diferencias pueden explicarse por un aumento en un grupo junto a una disminución en el otro (IMC, HbA1c), o sólo por el comportamiento (aumento o disminución) en uno de los grupos, mientras que en el otro no se observan diferencias significativas (Cintura, IL-6).
En el caso del IMC se vio un aumento significativo en el grupo control (media= 0.20, valor-p= 0.0025), mientras que hubo una disminución también significativa en el grupo intervención (media= -0.78, valor-p= 0.0034). La Cintura, mostró un aumento no significativo en el grupo control (media= 0.06, valor-p≈1) y se constató una reducción significativa en el grupo intervención (media= -1.59, valor-p= 0.0020). La HbA1c mostró un aumento significativo en el grupo control (media= 0.83, valor-p= 0.0244), y una disminución también significativa en el grupo intervención (media= -0.50, valor-p= 0.0417). La IL-6 mostró un aumento significativo en el grupo control (media= 1.80, valor-p= 0.0001), con una disminución no significativa en el grupo intervención (media= -0.78, valor-p= 0.4586). Ferritina mostro un descenso en ambos grupos al final del estudio sin una diferencia estadísticamente significativa entre ellos.
Las variables (IMC, HbA1c, Triglicéridos, Colesterol HDL, IL-6, PCR) tras el periodo de intervención, tampoco mostraron relación evidente con Ferritina, ni se encontró una correlación significativa de cada una con Ferritina (coeficiente de correlación de Spearman, p> 0.1 para todas las comparaciones, en ambos grupos) (Figura 4).
No se registraron eventos adversos.
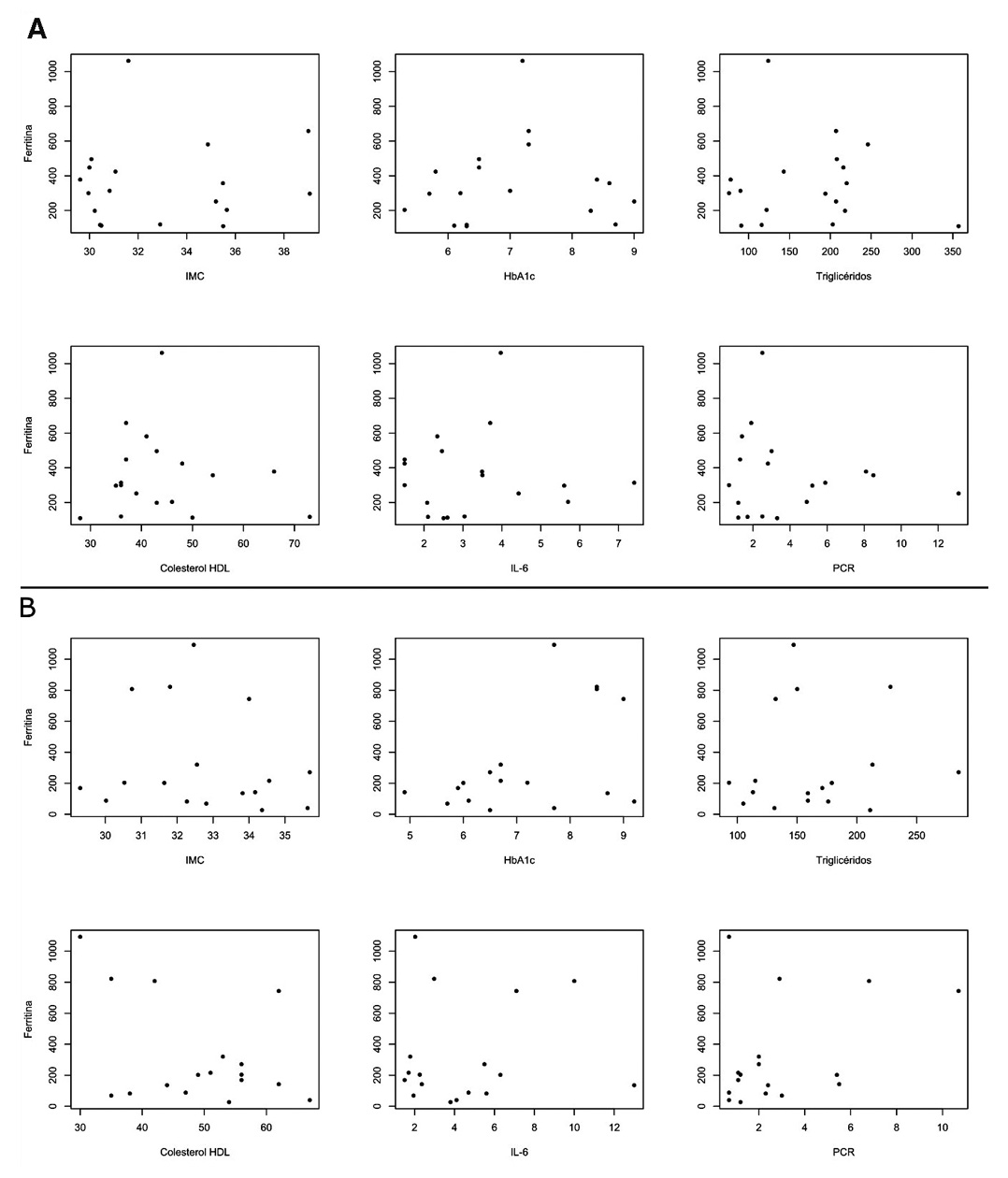 Figura 4. Distribución, luego de 20 semanas de tratamiento, de Ferritina en función del Índice de masa corporal (IMC), Hemoglobina glicosilada (HbA1c), Triglicéridos, Colesterol HDL, Interleucina 6 (IL-6) y Proteina Reactiva C (PCR); en los grupos control (A) y grupo intervención (B).
Figura 4. Distribución, luego de 20 semanas de tratamiento, de Ferritina en función del Índice de masa corporal (IMC), Hemoglobina glicosilada (HbA1c), Triglicéridos, Colesterol HDL, Interleucina 6 (IL-6) y Proteina Reactiva C (PCR); en los grupos control (A) y grupo intervención (B).
Discusión
Trabajamos con una muestra de pacientes con DM2 con más de 5 años de diagnóstico que a pesar de estar tratados y controlados, presentaban obesidad y eran sedentarios por lo cual no se encontraban en equilibrio metabólico en la etapa basal. Se recomienda un mínimo de actividad física moderada semanal de 150 minutos o 75 minutos de actividad física vigorosa, estimándose que un 30% de los adultos no cumplen con este requisito. Un reciente meta análisis apoya la noción generalmente aceptada de la asociación graduada que existe entre actividad física y mantenimiento de la salud19.
Nuestro propósito fue examinar si un PVSEC y dieta promueve un efecto beneficioso sobre los marcadores de inflamación y metabólicos como se ha demostrado en este tipo de intervenciones que promueven una pérdida de peso32,33.
La DM2 y la obesidad están asociadas con inflamación sistémica y varios estudios han demostrado que la pérdida de peso inducida por la dieta y el ejercicio reduce significativamente los marcadores de inflamación34,35. Los procesos inflamatorios desempeñan un papel fundamental en la patogénesis de la aterosclerosis e insulino resistencia y los niveles plasmáticos elevados de estos marcadores pueden proporcionar información sobre el estado inflamatorio en personas con alto riesgo de enfermedad cardiovascular (ECV)36.
Sin embargo, al final del PVSEC el grupo intervención alcanzo una diferencia estadísticamente significativa respecto al grupo control, en el descenso del IMC, circunferencia de la cintura, en el marcador inflamatorio IL-6 y el marcador metabólico HA1c.
Es clara la contribución del ejercicio controlado y la dieta, en el descenso del peso evidenciado por la diferencia significativa entre grupos en el descenso del IMC y la circunferencia de la cintura. En cambio en el grupo que no realizo ejercicio estas dos variables presentaron un aumento mostrando perjuicio en el control metabólico.
Se ha visto que el tejido adiposo puede contribuir con un 10% a 30% del nivel circulante de IL-6 basal. Esta citoquina contribuye en la IR relacionada con la obesidad. Nuestro estudio muestra como su concentración plasmática desciende o aumenta en el mismo sentido al IMC, circunferencia de cintura, así como con los cambios en el control glucémico a través de HA1c. Sugiriendo el vínculo de esta citoquina con la obesidad, y la IR en consonancia con otros estudios33,37.
En ausencia de depleción de hierro o hemocromatosis la ferritina ha demostrado ser un buen marcador de inflamación aguda y de inflamación crónica de bajo grado38. Varios estudios relacionaron la ferritina con el síndrome metabólico, la diabetes y otras enfermedades inflamatorias. En el estudio prospectivo de EPIC-Norfolk los niveles elevados de ferritina sérica predicen la DM2 de nueva aparición39.
En nuestro estudio observamos que ferritina se encontraba elevada en dos tercios de los pacientes evaluados y si bien presento un descenso en ambos grupos al final del seguimiento, este descenso no mostro diferencia estadísticamente significativa a favor de la intervención. Ferritina no se relacionó a ninguna variable al inicio ni al final del estudio.
PCR; proteína reactante de fase aguda sensible a la inflamación aguda y crónica, aumentó en el grupo control junto al aumento significativo de IL-6 (media= 1.80, valor-p= 0.0001) y disminuyo en el grupo intervención de acuerdo con la regulación positiva que interleucina ejerce sobre PCR. Sin embargo no hubo diferencia significativa entre los grupos.
No pudimos explicar el aumento de fibrinógeno (no significativo) en ambos grupos.
Conclusiones
Según nuestro conocimiento este estudio demuestra que un programa corto de ejercicio y dieta, u otro programa similar en el tratamiento de pacientes con DM2, mejora la inflamación y la homeostasis de la glucosa, discernible por los descensos de los parámetros inflamatorios y por la mejora en el control glucémico con un descenso significativo de HA1c.
Aunque el nivel de ferritina sérica se encontró elevado en ambos grupos, no hubo una diferencia estadísticamente significativa en su descenso. No se relacionó con el resto de las variables analizadas en especial con IL-6 que la regula positivamente. Ferritina sérica en nuestro estudio no fue útil para predecir la mejoría clínica.Los hallazgos deben considerarse en el contexto de las limitaciones de diseño de nuestro estudio. Pensamos que se podrían esperar mayores asociaciones si hubiéramos contado con número mayor de participantes, posicionándolo como un estudio preliminar. Estudios futuros con mayor número de pacientes son necesarios.
Referencias
- International Diabetes Federation. IDF.2013 Diabetes Atlas. 6th ed. Brussels
- Freeman DJ, Norrie J, Caslake MJ,et al. C-reactive protein is an independent predictor of risk for the development of diabetes in the West of Scotland Coronary Prevention Study. Diabetes May 2002; 51(5): 1596-1600.
- Marioni RE, Strachan MWJ, Reynolds RM, et al. Association Between Raised Inflammatory Markers and Cognitive Decline in Elderly People With Type 2 Diabetes: The Edinburgh Type 2 Diabetes Study. Diabetes 2010; 59(3): 710-713.
- Zheng. F, Yan. L, Yang. Z,Zhong. B, Xie. W.Diabetes and cognitive decline: the English Longitudinal Study of Ageing. Diabetologia 2018; 61: 839. https://doi.org/10.1007/s00125-017-4541-7
- Zulet M.A, Puchau B, Navarro C, Martí A, Martínez J.A. Biomarcadores del estado inflamatorio: nexo de unión con la obesidad y complicaciones asociadas. Nutr. Hosp. [online]. 2007; 22(5) [citado 2018-06-02]: 511-527. Disponible en:http://scielo.isciii.es/scielo.php?script=sci_arttext&pid=S0212- 16112007000700001&lng=es&nrm=iso
- Herrera D, Coria. G, Fernández C, Aranda G, Manzo J, Hernández M. La obesidad como factor de riesgo en el desarrollo de cáncer. Revista Peruana de Medicina Experimental y Salud Pública, [S.l.], p. 766-776, dic. 2015. ISSN 1726-4642. Disponible en: http://www.rpmesp.ins.gob. pe/index.php/rpmesp/article/view/1771
- Hotamisligil GS. Inflammation and metabolic disorders. Nature 2006; 444(7121): 860-867.
- Lumeng CN, Saltiel AR. Inflammatory links between obesity and metabolic disease. The Journal of Clinical Investigation. 2011; 121(6): 2111-2117. doi: 10.1172/JCI57132
- Fernández J, Ricart W. Resistencia a la insulina relacionada con el hierro. Endocrinología y Nutrición 2002; 49(6): 185-193.
- Hearnshaw S, Thompson NP, McGill A. The epidemiology of hyperferritinaemia. World Journal of Gastroenterology : WJG. 2006; 12(36): 5866-5869.
- Forrellat M, Fernández N, Hernández P. Regulación de la hepcidina y homeostasia del hierro: Avances y perspectivas. Revista Cubana de Hematología, Inmunología y Hemoterapia Disponible [revista en Internet]. 2012. 8(4). Disponible en: http://www.revhematologia.sld.cu/index.php/hih/ article/view/3
- Sharifi F, Sazandeh SH. Serum ferritin in type 2 diabetes mellitus and its relationship with HbA1c. Acta Medica Iranica, Acta Medica Iranica 2004; 42(2): 142-145. Disponible en: http://acta.tums.ac.ir/index.php/acta/article/ view/2706.
- Cho MR, Park JK, Choi WJ, Cho AR, Lee YJ. Serum ferritin level is positively associated with insulin resistance and metabolic syndrome in postmenopausal women: A nationwide population-based study. Maturitas. 2017; 103: 3-7.
- Chen L., Li Y., Zhang F., Zhang S., Zhou X., Ji L Association of serum ferritin levels with metabolic syndrome and insulin resistance in a Chinese population. Journal of Diabetes and its Complications 2017; 31(2): 364-368.
- Raj. S, Rajan. GV. Correlation between elevated serum ferritin and HbA1c in type 2 diabetes mellitus. International Journal of Research in Medical Sciences. January-March 2013; 1(1): 12-14.
- Virji. M, Bhoi. BK, Sadariya. BR, Javia. HN, Gusani. JK, Sharma. H. Correlation between serum ferritin and glycaemic control in patients of type 2 diabetes mellitus: a case control study. International Journal of Research in Medical Sciences, [S.l.] jan. 2017; 3(9): 2327-2330. ISSN 2320-6012. Available at: http://www.msjonline.org/index.php/ijrms/article/view/1717
- Momeni A, Behradmanesh MS, Kheiri S, Abasi F. Serum ferritin has correlation with HbA1c in type 2 diabetic patients. Advanced Biomedical Research 2015; 4: 74.
- Zisser.H, Gon. P, Kelley.CM, Seidman. JS. and Riddell. MC. Exercise and diabetes. The International Journal of Clinical Practice 2011; 65(s170): 71-75.
- Smith AD, Crippa A, Woodcock J, Brage S. Physical activity and incident type 2 diabetes mellitus: a systematic review and dose-response metaanalysis of prospective cohort studies. Diabetologia 2016; 59: 2527-2545. doi: 10.1007/s00125-016-4079-0.
- Monzillo LU, Hamdy O, Horton ES, Ledbury S, Mullooly C, Jarema C, et al. Effect of lifestyle modification on adipokine levels in obese subjects with insulin resistance. Obes Res 2003; 11: 1048-1054. doi: 10.1038/ oby.2003.144.
- Xu H, Barnes GT, Yang Q, et al. Chronic inflammation in fat plays a crucial role in the development of obesity-related insulin resistance. The Journal of Clinical Investigation 2003; 112(12): 1821-1830. doi: 10.1172/ JCI200319451.
- Pedersen BK. Muscles and their myokines. The Journal of Experimental Biology 2011; 214: 337-346.
- Pinto A, Di Raimondo D, TuttolomondoA, et al. Effects of physical exercise on inflammatory markers of atherosclerosis.Curr Pharm Des 2012; 18(28): 4326-4349.
- Esposito K. and Giugliano D. European Heart Diet and inflammation: a link to metabolic and cardiovascular diseases European Heart Journal 2006; 27: 15-20.
- Fessler MB, Rudel LL, Brown JM. Toll-like receptor signaling links dietary fatty acids to the metabolic syndrome. Curr. Opin. Lipidol 2009; 20: 379- 385. doi: 10.1097/MOL.0b013e32832fa5c4.
- Velloso L, Folli F, Saad M. TLR4 at the Crossroads of Nutrients, Gut Microbiota, and Metabolic Inflammation. Endocrine Reviews. 1 June 2015; 36(3): 245-271. https://doi.org/10.1210/er.2014-1100.
- Eskelinen MH, Ngandu T, Helkala EL, et al. Fat intake at midlife andcognitive impairment later in life: a population-based CAIDE study. Int J Geriatr Psychiatry 2008; 23: 741-747.
- Pale RR, Pratt M, Blair SN, Haskell WL, Macera CA, Bouchard C. Physical activity and public health: a recommendation from the Centers for Disease Control and Prevention and the American College of Sports Medicine. JAMA 1995; 273: 402-407.
- Kline GM, Porcari JP, Hintermeister R, et al. Estimation of VO2 max from a one mile track walk, gender, age and body weight. Med Sci. Sports Exerc. 1987, 19, 253-259. Rockport Fittness Waling Test available on https://www.brianmac.co.uk/rockport.htm.Last access on 2016 November.
- R Core Team R. (2017). A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. URL https://www.R-project.org/
- RStudio Team (2012). RStudio: Integrated Development for R. RStudio, Inc., Boston. URL https://www.rstudio.com/
- Ziccardi P, Nappo F, Giugliano G, Esposito K, Marfella R, Cioffi M, et al. Reduction of inflammatory cytokine concentrations and improvement of endothelial functions in obese women after weight loss over one year. Circulation 2002; 105: 804-809.
- Nicklas B, Ambrosius W, Messier S, Miller D, Penninx B, Loeser R, et al. Diet-induced weight loss, exercise, and chronic inflammation in older, obese adults: a randomized controlled clinical trial. Am J ClinNutr 2004; 79: 544-551.
- Tsukui S, Kanda T, Nara M, Nishino M, Kondo T, Kobayashi I. Moderateintensity regular exercise decreases serum tumor necrosis factor-alpha and HbA1c levels in healthy women. IntJObesRelatMetabDisord 2000; 24: 1207-1211.
- Mattusch F, Dufaux B, Heine O, Mertens I, Rost R. Reduction of the plasma concentration of C-reactive protein following nine months of endurance training. Int J SportsMed 2000; 21: 21-24.
- Lawler H, Underkofler Ch, Kern P, Erickson C, Bredbeck B, Rasouli N. Adipose Tissue Hypoxia, Inflammation, and Fibrosis in Obese Insulin- Sensitive and Obese Insulin-Resistant Subjects, The Journal of Clinical Endocrinology & Metabolism. 1 April 2016; 101(4): 1422-1428.
- Bastard JP, Jardel C, Bruckert E, Blondy P, Capeau J, Laville M, et al. Elevated Levels of Interleukin 6 Are Reduced in Serum and Subcutaneous Adipose Tissue of Obese Women after Weight Loss, The Journal of Clinical Endocrinology & Metabolism. 25 Abr. 2011; 85(9); 1 September 2000, Pages 3338-3342.Web.
- Kell DB, Pretorius E. Serum ferritin is an important inflammatory disease marker, as it is mainly a leakage product from damaged cells. Metallomics. 2014; (4): 748-73.
- Forouhi N.G., Harding A.H., Allison M., Sandhu M.S., Welch A., Luben R, et al. Elevated serum ferritin levels predict new-onset type 2 diabetes: Results from the epic-norfolk prospective study.Diabetologia. 2007; 50: 949-956.doi: 10.1007/s00125-007-0604-5.