Efectos de la ingesta de los edulcorantes Estevia y D-Tagatosa sobre el metabolismo de la glucosa, ácido úrico y apetito-saciedad
Isabella Vicuña H.1,4, Claudia Vega S.1,5, Kathleen Priken F.1,4, Victoria Novik A.2, Verónica Sambra V.3,5,*
Effects of stevia and D-tagatose sweeteners intake on glucose, uric acid metabolism and appetite-satiety
1Escuela de Nutrición. Facultad de Farmacia. Universidad de Valparaíso.
Valparaíso, Chile.
2Escuela de Medicina. Facultad de
Medicina. Universidad Andrés Bello.
Escuela de Medicina. Facultad de Medicina.
Universidad de Valparaíso. Valparaíso,
Chile.
3Departamento de Nutrición. Facultad
de Medicina. Universidad de Chile.
Santiago, Chile.
4Nutricionista.
5Msc, Nutricionista Universidad de Chile,
Santiago Chile
*Correspondencia: Verónica Sambra Vásquez / vero.sambrav@uchile.cl
Departamento de Nutrición. Facultad de
Medicina. Universidad de Chile.
Independencia 1027, Santiago, Chile.
Cel:569/64072287; Tel (562) 27378778;
Fax (562) 29786240.
Origen del apoyo financiero: Financiamiento
Sociedad Chilena de Endocrinología
y Diabetes, proyecto SOCHED
17-10, “Efecto de la ingesta de los
edulcorantes estevia y D-tagatosa sobre
glicemia, péptido C y apetito-saciedad
en mujeres con hiperinsulismo: Ensayo
clínico controlado”.
Recibido 03-07-2019
Aceptado: 21-08-2019
Resumen: Introducción: Si bien, los edulcorantes no nutritivos (ENN) estevia y D-tagatosa han sido reportados como seguros, han demostrado tener algunos efectos metabólicos tras su ingesta. Objetivo: Describir los efectos de la ingesta de estevia y D-tagatosa sobre el metabolismo de la glucosa y ácido úrico, y del apetito-saciedad, a partir de la evidencia disponible. Métodos: Revisión descriptiva. Se realizó búsqueda en PubMed utilizando los siguientes términos y palabras clave: “stevia rebaudiana”, “tagatose”, “D-tagatose”, “blood glucose”, “insulin”, “metabolic processes”, “uric acid”, “hyperuricemia”, “appetite” o “satiety”. El análisis de los estudios seleccionados fue discrecional. Resultados: Existen estudios que demuestran efectos beneficiosos tras el consumo de estevia o D-tagatosa sobre el control glicémico, apetito y saciedad tanto en sujetos sanos como con alteraciones en el metabolismo de la glucosa. Por otra parte, un número importante de estudios que evalúan la ingesta de estevia reportan efectos nulos sobre dichos parámetros. En relación al ácido úrico, solo un estudio en sujetos con enfermedad renal crónica reporta aumento en la concentración de ácido úrico plasmático tras la ingesta de 500 mg/día de estevia. Pocos estudios han evaluado el efecto de la ingesta de D-tagatosa sobre uricemia, en sujetos sanos y diabéticos, reportando un aumento transitorio y significativo en los niveles de ácido úrico sérico, sin embargo, no se ha logrado demostrar un efecto hiperuricémico asociado. Es importante destacar que la metodología de los estudios revisados es heterogénea, especialmente en relación al tamaño muestral, tiempo, dosis y vía de adminitración del edulcorante. Conclusión: La ingesta de estevia y D-tagatosa ha demostrado efectos beneficiosos sobre el metabolismo de la glucosa, el apetito y la saciedad. El efecto del consumo de D-tagatosa sobre ácido úrico sérico requiere mayor evidencia para demostrar su significancia clínica.
Palabras clave: Ácido úrico, Glicemia, Insulina, Stevia rebaudiana, Tagatosa o D-tagatosa.
Abstract. Introduction: No-nutritive sweeteners stevia and D-tagatose have been reported as safe according to their acceptable daily intake, however, they have been shown to have metabolic effects after their ingestion. Objective: To describe the effects of stevia and D-tagatose intake on parameters associated to glucose, uric acid metabolism and on appetite-satiety, considering the available evidence. Methods: Descriptive review. PubMed search was carried out to identify the totality of the published articles. The following terms and key words were used: “stevia rebaudiana”, “tagatose”, “D-tagatose”, “blood glucose”, “insulin”, “metabolic processes”, “uric acid”, “hyperuricemia”, “appetite” o “satiety”. The analysis of the selected studies was discretionary. Results: studies have shown beneficial effects of stevia and D-tagatose consumption on glycemic control, appetite and satiety in healthy subjects as well as subjects with impairment glucose metabolism. On the other hand, a significant number of studies evaluating estevia intake report null effects on these parameters. In relation to uric acid, only one study in subjects with chronic kidney disease reported an increase in plasmatic uric acid concentration after the intake of 500 mg/day of stevia. Several studies have evaluated the effect of D-tagatose intake on plasmatic uric acid, in healthy and diabetic subjects, reporting a transient and significant increase in serum uric acid levels, however, has not been able to demonstrate an associated hyperuricemic effect. It is important to highlight that the methodology of the studies reviewed is heterogeneous, especially in relation to sample size, dose administered, time and route of exposure to the sweetener. Conclusion: Stevia and D-tagatose intake has shown beneficial effects on glucose metabolism, appetite and satiety. The effects of the consumption of both sweeteners on uric acid require further study to demonstrate their clinic significance.
Key words: Blood glucose, Insulin, Stevia rebaudiana, Tagatose o D-tagatose, Uric acid.
Los edulcorantes no nutritivos (ENN) previamente a su comercialización deben demostrar seguridad ante su ingesta, la cual es determinada por el Comité Mixto FAO/OMS de Expertos en Aditivos Alimentarios (JECFA), organismo que fija el límite de ingesta diaria admisible (IDA) de cada sustancia1,2. Estudios llevados a cabo en niños y adultos con diabetes, encontraron aquellos con mayor consumo de ENN no superaban el límite de IDA en la mayoría de los casos3,4.
Actualmente, el enfoque de los estudios relacionados con los ENN se orienta a evaluar los efectos de su ingesta sobre parámetros metabólicos, cómo éstos se relacionan con el sabor dulce y de qué manera influyen sobre el apetito-saciedad5.
Los ENN al ser ingeridos se unen al receptor de sabor dulce de la cavidad oral representado por el heterodímero T1R2-T1R3, el cual se une a diferentes compuestos de alta heterogeneidad química, cuya unión activa una cascada de señalización intracelular que resulta en la percepción consciente de su dulzor6. A nivel intestinal, en presencia de azúcares disponibles, se unen a T1R2-T1R3 en el dominio apical de las células enteroendocrinas K y L, activando vías intracelulares que conducen a la secreción de incretinas, tales como, el péptido similar al glucagón 1 y 2 (GLP-1 y GLP-2) y polipéptido inhibidor gástrico (GIP)7.
La incretina GLP-1 actúa como la principal hormona que aumenta la secreción de insulina, inhibe la secreción de glucagón, retrasa el vaciamiento gástrico suprimiendo el apetito y promoviendo la saciedad7. Por otro lado, el GIP aumenta la secreción de insulina dependiente de la glucosa en respuesta a los nutrientes vía oral y el GLP-2 promueve la proliferación de células intestinales y aumenta la absorción de glucosa6.
Existen diversos planteamientos respecto al efecto metabólico de estevia y D-tagatosa.
Algunos autores plantean que el ENN estevia podría tener un uso potencial en el manejo de la diabetes mellitus tipo 2 (DM2) debido a su efecto hipoglicemiante3, mientras que otros estudios han observado un aumento de las concentraciones de ácido úrico sérico tras la ingesta aguda de D-tagatosa, sin embargo, el efecto hiperuricémico y su relevancia clínica aún es controversial.
Estudios que evalúan la ingesta de estevia o D-tagatosa han demostrado la reducción en la ingesta total de calorías e hidratos de carbono si se sustituye por sacarosa u otros ENN, sin compensar la ingesta energética con otras fuentes de alimentos. Lo que demuestra sus potenciales efectos sobre el eje apetito-saciedad4,8.
La presente revisión tiene como objetivo describir los efectos de la ingesta de estevia y D-tagatosa sobre el metabolismo de glucosa, ácido úrico, y sobre el apetito-saciedad en individuos sanos y con alteraciones en el metabolismo de la glucosa, considerando la evidencia disponible.
Metodología
El presente artículo corresponde a una revisión descriptiva. Se realizó una búsqueda no sistemática en PubMed para identificar los artículos publicados que estudien los efectos de la ingesta de estevia y D-tagatosa sobre la respuesta glicémica, insulínica y sobre las concentraciones séricas de ácido úrico en humanos o animales. Se utilizaron los siguientes términos y palabras claves: stevia rebaudiana, blood glucose, insulin, metabolic processes tagatose, D-tagatose, uric acid o hyperuricemia. El análisis de los estudios seleccionados fue discrecional. En la tabla 1 se indican los estudios seleccionados y sus principales características.
Tabla 1: Características de los estudios que evalúan el efecto de estevia o D-tagatosa sobre el metabolismo de glucosa, ácido úrico y apetito-saciedad.
| Estudio | Sujetos | Metodología | Resultados |
| Barriocanal LA. et al. (2008) Ref 21 |
76 sujetos: 16 con DM1, 30 DM2, 30 sin diabetes y niveles normales-bajos de presión arterial. | Asignación aleatoria a 250 mg de esteviósido por 3 veces/ día o placebo por 3 meses. | Glicemia y HbA1c sin cambios |
| Maki KC. et al. (2008) Ref 22 |
122 sujetos con DM2. | Suplementación diaria de 1000 mg rebaudiósido A (n=60) vs placebo (n=62) por 4 meses. | Glicemia sin cambios. |
| Gregersen S et al. (2004) Ref 16 |
12 sujetos con DM2. | Estudio cruzado. Comida de prueba estándar + 1 g de esteviósido o 1 g de almidón de maíz (control). | Esteviósido redujo 18% el ABC incremental de glicemia (p = 0,013). |
| Chang JC et al. (2005) Ref 15 |
Ratas diabéticas. | Administración oral de esteviósido 0,2 mg/kg x 3 veces/día en ratas diabéticas con dieta en base a fructosa por 10 días. | Incremento sensibilidad a la insulina. |
| Curi R et al. (1986) Ref 7 |
16 sujetos sanos. | Administración de 5 g de hojas de estevia cada 6 h por 3 días. PTGO antes y después de administración. | Reducción significativa de glicemia durante PTGOydespués de ayuno nocturno. |
| Jeppesen PB et al. (2002) Ref 17 |
Ratas diabéticas Goto Kabizaki vs Ratas Wistar normales. | Esteviósido (0,2 g/kg de peso corporal) vs D-glucosa (2,0 g/kg de peso corporal) administrados en ratas anestesiadas. | En ratas diabéticas, esteviósido tanto por vía intravenosa como vía oral ejerce acciones antihiperglicémicas, insulinotrópicas y glucagonostáticas. |
| Anton SD et al. (2010) Ref 20 |
Sujetos sanos (n=19) y obesos (=12). | Evaluación del efecto de pre-cargas que contenían estevia (290 kcal), aspartamo (290 kcal) o sacarosa (493 kcal) en días de prueba por separado. | Pre-cargas de aspartamo o estevia no compensaron ingesta alimentaria en la siguiente comida (almuerzo o cena), con niveles similares de saciedad vs sacarosa. |
| Rizwan F et al. (2018) Ref 25 |
97 sujetos con enfermedad renal crónica (estadio I a III). | Cápsula de estevia (250 mg) o placebo por dos veces al día, junto con bloqueador del receptor de angiotensina II y/o bloqueador del canal de calcio durante 9 meses | Grupo con tratamiento de estevia redujo significativamente creatinina sérica (p<0.027), el ácido úrico sérico (p<0.009), glicemia de ayuno (p <0.041) y glicemia postprandial (p <0.013). |
| Saunderset al. (1999) Ref 29 |
8 sujetos sanos (4 H, 4 M); 8 sujetos con DM2 (4 H, 4 M) con tratamiento dietético y n=2 junto con sulfonilureas. |
Fase aguda: Día 1: PTGO 75 g glucosa-3 h.;
día 2: 5 g tagatosa/d; día 3: 10 g; día 4: 15 g;
día 5: PTTO 75g de tagatosa-3 h.
Fase subcrónica 8 semanas: 4 sujetos sanos con 75g tagatosa (25g x 3 veces/día) v/s 4 sujetos sanos con 75g sacarosa; 4 sujetos con DM2 con 75g tagatosa vs 4 sujetos con DM2 sin suplemento. |
Ácido úrico, fósforo y magnesio plasmáticos en ayunas sin cambios en fase subcrónica. En fase aguda, aumentó ABC-ácido úrico tras PTTO D-tagatosa en sujetos sanos y DM2 vs PTGO (p= 0,03). Peak de ácido úrico en plasma a los 60 min., concentración en 180 min. no volvió a línea basal tras ingesta de D-tagatosa en sanos y DM2. |
| Boesch et al. (2001) Ref 38 |
12 hombres sanos | Ensayo cruzado, doble ciego, con lavado de 28 días entre pruebas. Ingesta de 15g por 3 veces al día de D-tagatosa y sacarosa (placebo) durante 28 días cada uno. Ingesta de un desayuno estandarizado con 15 g de tagatosa o sacarosa para evaluar el efecto postprandial. |
Sin cambios significativos en volumen hepático o concentraciónde glucógeno según tratamiento, período, o sujeto. Ácido úrico plasmático sin cambiossegún edulcorante en ingestapura o desayuno. |
| Buemann et al. (2000) Ref 28 |
8 hombres sanos. | Ensayo randomizado, cruzado, doble ciego con un lavado de 5 y 33 días entre pruebas. Ingesta de 30g de D-tagatosa, 30g de D-fructosa disuelta en 400 ml de agua ycontrol (agua). Consumo de almuerzo 4,5 h post carga. |
Peak de D-tagatosa sérica ocurrió a los 50 min., sin detección a los 420 min. En orina excreción 1,5% de la dosis de 30 g previo al almuerzo. D-tagatosa redujo diuresis antes del almuerzo (P= 0,002) y aumentó excreción urinaria de ácido úrico antes y post almuerzo. ABC-4h de ácido úrico sérico mayor post D-tagatosa vs D-fructosa oagua. Solo un sujeto mostró hiperuricemia (>450 μmol/L) durante las 3 pruebas. Disminución leve y transitoria del Pi sérico solo a los 50 min y 400 min post carga de D-tagatosa (vs D-fructosa p=0.01; vs agua p=0.03). |
| Buemann et al. (2000) Ref 37 |
5 hombres sanos. | Ensayo cruzado, doble ciego,
aleatorio. Ingesta de 30 g de D-tagatosa o 30g de D-fructosa disueltos en 400 ml de agua. |
Acumulación intracelular hepática de D-tagatosa-1-fosfato (1 mmol/L), 30 min postcarga de D-tagatosa. Disminución 12% ATP hepático (0,30 mmol/L) luego de ingesta de D-tagatosa (p<0,05), coincide con peak máximo de Dtagatosa-1-fosfato. Aumento 16% ácido úrico sérico primeros 50 min. postcarga D-tagatosa (P <0,05) sin alcanzar nivel basal al finalizar tratamiento (230 min.). Sin efecto post D-fructosa. Reducción 12% extracción fraccional de ácido úrico en D-tagatosa, lo cual no explicaría efecto hiperuricémico agudo de Dtagatosa. |
Resultados
Estevia. Definición, características y metabolización
El ENN estevia (Stevia Rebaudiana Bertoni; SRB) es una especie del género de la familia de las asteráceas, nativa de la región tropical de Sudamérica. Se encuentra aún en estado silvestre en Paraguay y en la provincia argentina de Misiones, pero desde hace varias décadas se cultiva por sus propiedades edulcorantes y su ínfimo contenido calórico9. La estevia se emplea como sustituto del azúcar y presenta un sabor más lento al comienzo y una duración más prolongada, aunque algunos de sus extractos pueden tener un sabor amargo similar al “regaliz” en altas concentraciones10. Aunque la palabra “estevia” se refiere a toda la planta, sólo algunos de los componentes de la hoja de estevia son dulces, éstos se conocen como glicósidos de esteviol (esteviósido, rebaudiósido A), no contienen calorías y son considerados como Generalmente Reconocido Como Seguro (GRAS) por la FDA. Estos son hasta 300 veces más dulces que la sacarosa, no aportan calorías y pueden ser utilizados como un sustituto a la sacarosa o como una alternativa de ENN10. La seguridad de los glicósidos de esteviol se ha confirmado en numerosos estudios toxicológicos que incluyen investigaciones de toxicidad aguda y subaguda, toxicidad reproductiva, genotoxicidad y carcinogenicidad. En consecuencia, los glicósidos de esteviol cumplen la norma de seguridad del JECFA11. Este comité sugirió una IDA de esteviol de hasta 4 mg/kg de peso corporal, que es equivalente a 10 mg/kg peso corporal de esteviósido11.
Se han realizado estudios en humanos para documentar el metabolismo de los glicósidos de esteviol, éstos no se absorben en el intestino delgado, son descompuestos por bacterias en el colon que los hidrolizan a esteviol cortando sus unidades de glucosa. El esteviol se absorbe, viaja a través de la vena porta y se metaboliza principalmente en el hígado para la formación de glucurónido de esteviol el cual es secretado por la orina12. Se ha demostrado que no hay acumulación de estevia, o cualquier subproducto de estevia, en el cuerpo durante el metabolismo13.
Respuesta glicémica, insulinémica, apetito-saciedad
Entre los posibles beneficios del glucósido de esteviol sobre la salud humana, se incluyen su efecto antihipertensivo14 y antihiperglicémico3,16,20. Sin embargo, la Academia de Nutrición y Dietética, tras la revisión de estudios disponibles con un número reducido de sujetos y uso de dosis variables de glicósidos de esteviol en comparación con un placebo, concluye que el ENN estevia muestra efectos mínimos, de tener alguno, sobre la glicemia, la insulinemia, la presión arterial y el peso2.
Por otro lado, los componentes dulces de la hoja de estevia se han asociado con un retraso en el desarrollo de resistencia a la insulina en un modelo de ratas alimentadas con dieta rica en fructosa15 y con efectos beneficiosos sobre la glicemia y los niveles de insulina en adultos sanos y con DM23,16,20. Es así como, la ingesta de 5 g de extracto de SRB durante 3 días redujo significativamente los niveles de glicemia durante la prueba de tolerancia a la glucosa oral y después de un ayuno nocturno en sujetos sanos3.
Estudios in vitro en islotes pancreáticos aislados de ratón mostraron que la liberación de insulina mediada por esteviósido es dependiente de la glucosa plasmática19. En consecuencia, el efecto insulinotrópico del esteviósido en experimentos con animales se desvaneció en presencia de niveles normales a bajos de glicemia. Por lo tanto, Se requieren concentraciones de glucosa de al menos 119 mg/dl-1 para la estimulación de la liberación de insulina17. De esta manera, se demostró en ratas con DM2 que la administración de esteviósido tanto por vía intravenosa como por vía oral ejerce acciones antihiperglicémicas, insulinotrópicas y glucagonostáticas18.
Un estudio evaluó el efecto de precargas que contienen estevia, aspartamo o sacarosa, en la ingesta de alimentos, saciedad, glicemia e insulinemia postprandial en sujetos normales y obesos. Se observó que los sujetos al consumir aspartamo o estevia no compensaron comiendo más en la siguiente comida (almuerzo o cena) y presentaron niveles similares de saciedad en comparación con los sujetos que consumieron sacarosa. Adicionalmente la estevia redujo los niveles de glucosa plasmática e insulina, lo que sugiere que la estevia podría contribuir en la regulación del metabolismo de la glucosa20. Otro estudio que comparó la suplementación de un 1 g de esteviósido con 1 g de almidón de maíz (control) en una comida de prueba estándar para evaluar su efecto agudo, reportó que el esteviósido reduce la glicemia postprandial y tiende a potenciar la secreción de insulina en pacientes con DM216.
En términos de evaluación de ingesta crónica de estevia, los resultados han demostrado nulo efecto sobre la glicemia o el apetito-saciedad. Dos estudios a largo plazo (3-4 meses) que evaluaron el efecto del uso de glicósidos de esteviol (rebaudiósido A) en comparación con un placebo, reportaron que no tiene efectos significativos sobre la glicemia, hemoglobina glicada (HbA1c), presión arterial y el peso corporal en personas con DM221,22. Un estudio posterior informó que la glicemia de ayunas y la HbA1c no se redujo significativamente por la ingesta de 1,5 g diarios de esteviósido en comparación con el placebo23.
En relación al efecto sobre las incretinas, estudios in vitro en islotes aislados de ratón donde se analizó el efecto hormonal de la exposición al esteviósido, reveló que las diferencias en los niveles de glucagón y GLP-1 fueron insignificantes19. Además, un estudio que evaluó la suplementación de esteviósido de la planta SRB, no logró estimular la secreción de GLP-1 o GIP en pacientes con DM216.
Existe sólo un estudio que evalúa el efecto de la ingesta de estevia sobre el ácido úrico. Este ensayo clínico, randomizado, cruzado y doble ciego consideró una intervención de nueve meses en 97 individuos diagnosticados con ERC etapa I, II o IIII. A cada individuo se le entregó una cápsula de 250 mg de estevia dos veces al día. Los resultados demostraron que estevia tiene el potencial de mejorar significativamente la uricemia, además de la glicemia y la creatinina sérica en personas con ERC24.
D-Tagatosa. Definición, características y metabolización
La D-Tagatosa es un ENN de origen natural e industrialmente deriva de la lactosa, su aporte calórico es bajo (1,5 kcal/g) y su dulzor es 92% más intenso que la sacarosa. D-Tagatosa fue establecido como seguro por la JECFA desde 2001 para su uso en alimentos y bebidas, y aprobado como aditivo alimentario por la FDA en 200325. En un principio, se determinó IDA para D-tagatosa debido a que su consumo podría inducir la deposición de glucógeno e hipertrofia en el hígado, aumentando las concentraciones de ácido úrico en plasma26. Sin embargo, tras la publicación de nuevos estudios, desde el año 2004 se declara una IDA “no especificada” para D-tagatosa, en espera de nuevos antecedentes y considerando que presenta propiedades fisiológicas y toxicológicas similares a las de otros hidratos de carbono (H de C) de baja digestibilidad27.
Entre un 20 y 25% de la dosis de D-tagatosa ingerida se absorbe a nivel intestinal y se metaboliza en el hígado a través de una ruta similar a la de la D-fructosa. La D-tagatosa es fosforilada a D-tagatosa 1-fosfato por la fructoquinasa, implicando la desfosforilación de adenosina trifosfato (ATP) a adenosina difosfato (ADP). A continuación, la D-tagatosa-1- fosfato se degrada a D-gliceraldehído y dihidroxiacetona fosfato por la aldolasa B para continuar por la ruta metabólica hacia la formación de piruvato. La porción no absorbida es fermentada por la microbiota en el intestino grueso28,29.
No existe registro de sus niveles de ingesta a nivel local, sin embargo, ha comenzado a utilizarse masivamente en la industria alimentaria chilena, específicamente en panadería y pastelería puesto que es el único edulcorante capaz de resistir temperaturas elevadas y de reemplazar el uso de sacarosa disminuyendo el aporte calórico de las preparaciones25.
Respuesta glicémica, insulinémica, apetito-saciedad
Se postula que los ENN podrían no generar beneficios en el manejo dietoterapéutico de la diabetes, excepto como sustituto de los H de C30. Sin embargo, el isómero de D-galactosa bajo en calorías ha sido estudiado como un fármaco con potencial acción sobre la DM2 y la obesidad demostrando efectos beneficiosos en la hiperglicemia e hiperinsulinemia postprandial, reduciendo el peso corporal, aumentando la lipoproteína HDL, con poder antioxidante y prebiótico31. En estudios preliminares en seres humanos, la D-tagatosa ha mostrado una disminución de la glicemia postprandial y de la respuesta insulinémica. Los mecanismos de acción propuestos para D-tagatosa son escasos, uno de ellos señala una interferencia en la absorción de H de C mediante la inhibición de las enzimas sacarasa y maltasa, inhibición de la glicogenólisis y/o competencia por los transportadores de glucosa32. En 1999, Donner y sus colaboradores demostraron los efectos sobre la respuesta glicémica de la D-tagatosa con o sin glucosa oral en seres humanos. Este estudio incluyó ocho sujetos no diabéticos y ocho con DM2. Los pacientes recibieron D-tagatosa, primero en dosis de 5 g, luego en dosis de 10 g y finalmente en dosis de 25 g para la adaptación y minimización de los efectos secundarios gastrointestinales durante un total de 3 días. Los 16 pacientes recibieron por separado 75 g de glucosa oral o D-tagatosa oral, después de lo cual se realizaron pruebas de tolerancia de 3 horas. Además, se les dio 75 g de D-tagatosa 30 min antes de una carga de 75 g de glucosa. Los resultados demostraron que no hubo un aumento en los niveles de glucosa o insulina en el grupo D-tagatosa, independientemente de que el paciente tuviera DM2. El pre tratamiento con D-tagatosa atenuó de manera significativa el aumento de los niveles de glucosa basal en plasma en el grupo de sujetos con DM2. Esta atenuación no fue estadísticamente significativa en el grupo de individuos sanos33.
Otro estudio que consideró ocho sujetos no diabéticos, a quienes se les administró 30 g de D-tagatosa en agua, 30 g de fructosa en agua, o agua pura como control, demostró que los niveles de glucosa post agua se atenuaron en el grupo D-tagatosa. La fructosa también demostró dicha atenuación, pero en menor medida28.
Respecto a la variable apetito-saciedad, en un estudio con 19 hombres normopeso se investigó la ingesta de alimentos ad libitum luego de consumir 29 g de sacarosa con 29 g de D-tagatosa en un desayuno. La ingesta de alimentos fue medida en diferentes tiempos de comida. El almuerzo fue medido 4 horas después del desayuno, durante la tarde tuvieron acceso a bocadillos abundantes y 9 horas después del desayuno se les ofreció un buffet. Dentro de los resultados obtenidos se encontró que la ingesta al almuerzo y cena fue un 15% menor con D-tagatosa en comparación con la sacarosa34. Factores gastrointestinales como los efectos osmóticos de la D-tagatosa no absorbida que causan distensión del intestino podrían mediar la supresión aguda del apetito35.
Efectos sobre el metabolismo del ácido úrico
Se ha documentado aumentos variables de los niveles de ácido úrico sérico con distintas dosis de D-fructosa. Dosis mayores a 100 y 200 g aumenta 0,5 mg dl-1 y entre un 6-24% los niveles séricos basales de ácido úrico, respectivamente36.
Tal como se mencionó anteriormente, D-tagatosa se metaboliza en el hígado a través de una ruta similar a la de la D-fructosa. Durante su metabolización se observa una disminución transitoria de las concentraciones de fosfato inorgánico (Pi) en hígados de rata y humanos sanos, como consecuencia de su participación en la reposición de ATP y posterior captura en la formación de fructosa-1-fosfato29. Por lo tanto, se propone que la ingesta de D-tagatosa también causa una reducción del Pi hepático, particularmente porque la degradación de D-tagatosa-1- fosfato ocurre a un ritmo más lento que la degradación de D-fructosa-1- fosfato. De esta forma, la D-tagatosa-1- fosfato puede acumularse transitoriamente y mantener capturado el Pi durante un tiempo más prolongado que D-fructosa-1- fosfato28,29.
De esta forma, la reducción hepatocelular de Pi conduce a un aumento de la actividad de la adenosina desaminasa y AMP desaminasa, enzima que participa en la desaminación de AMP a fosfato de inosina-mone (IMP) limitante en la velocidad de degradación de AMP que es inhibida por el Pi. Además, el aumento de la desfosforilación de ATP a ADP aumenta directamente el suministro de nucleótidos de purina para la degradación. Los efectos anteriores desencadenan un aumento de la activación de la ruta de degradación de nucleótidos de purina que genera un aumento de la liberación de ácido úrico plasmático (Figura 1)28,29.
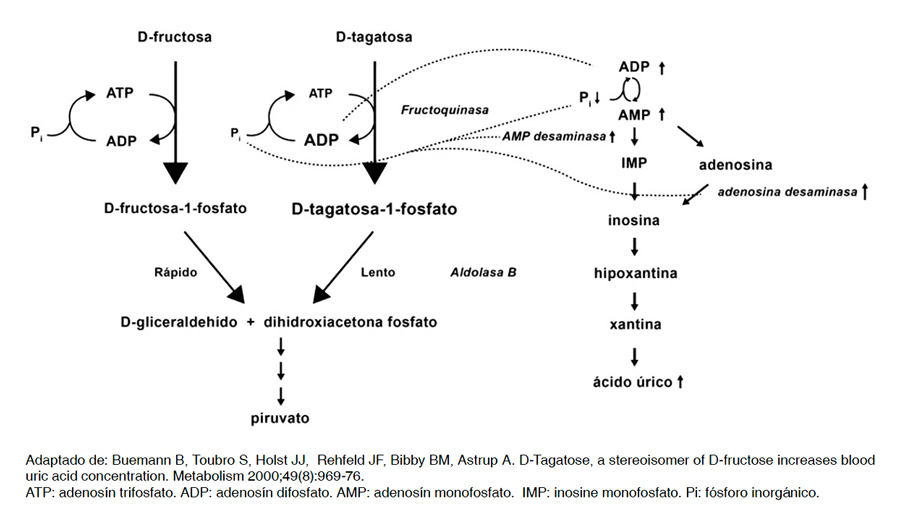 Figura 1. Mecanismo de D-Tagatosa en la síntesis de ácido úrico.
Figura 1. Mecanismo de D-Tagatosa en la síntesis de ácido úrico.Un estudio en hombres sanos reportó que una carga de 30 g de D-tagatosa resultó en una acumulación intracelular significativa de D-tagatosa-1- fosfato del orden de 1 mmol L-1 en el hígado humano luego de 30 min tras su ingesta. Además, el peak de D-tagatosa-1-fosfato coincidió con una disminución de ATP hepático del 12%, que corresponde a aproximadamente 0,30 mmol L-1 ATP37. En otro estudio similar se observó una disminución leve y transitoria del Pi sérico solo a los 50 y 400 min. post ingesta de 30 g de D-tagatosa28. Sin embargo, en otro estudio el nivel de fósforo plasmático no fue significativa tras la ingesta de 75 g de D-tagatosa29.
Se ha reportado que la ingesta de aproximadamente 1 g kg-1 de peso corporal de compuestos como fructosa, sorbitol y xilitol producen un efecto hiperuricémico en humanos29.
El efecto agudo del consumo de D-tagatosa sobre ácido úrico sérico fue evaluado hace algunos años por cuatro estudios. Todos incluyeron en su muestra adultos sanos y sólo uno de ellos sujetos con DM2. Las dosis de consumo evaluadas se encontraban en un rango de 15 a 75 g por tiempo y los controles eran fructosa o sacarosa en cantidades equivalentes. Tres de ellos encontraron efectos significativos28,29,37 y sólo uno no observó efectos sobre el ácido úrico38.
Un ensayo clínico encontró que la concentración máxima y el área bajo la curva (ABC) de ácido úrico sérico en cuatro horas fue significativamente mayor cuando ocho hombres sanos ingirieron 30 g de D-tagatosa, a diferencia de 30 g de D-fructosa disuelto en 400ml de agua o solo agua pura26. Esto concuerda con los resultados de otros dos estudios29,36. Sin embargo, en un estudio cruzado doble ciego la concentración de ácido úrico plasmático no se vio afectada cuando 12 hombres sanos ingirieron un desayuno estandarizado con 15 g de tagatosa para evaluar su efecto postprandial en un periodo de 7 horas, a diferencia del consumo de 15 g de sacarosa38.
El efecto crónico del consumo de D-tagatosa sobre ácido úrico sérico en humanos ha sido evaluado por dos estudios29,38, por un máximo de 8 semanas y ninguno encontró efectos. Uno de ellos evaluó la ingesta de tres dosis altas de D-tagatosa (25 g/día) durante ocho semanas, sin embargo, no se reporta información sobre seguimiento de ingesta de pruebas, fuentes adicionales de ingesta de sacarosa y monitoreo del tratamiento farmacológico de algunos sujetos con DM229. Al igual que el estudio anterior, la concentración de ácido úrico plasmático no se vio afectado cuando 12 hombres sanos ingirieron dosis moderadas de D-tagatosa (3x15g/día) durante 28 días, a diferencia del consumo de sacarosa38.
Estudios sugieren que el aumento agudo de ácido úrico sérico no posee relevancia clínica29, no obstante, otros autores indican que si bien, el efecto puede ser clínicamente insignificante en sujetos sanos, puede ser perjudicial en estados hiperuricémicos como en sujetos con gota o resistencia a la insulina, especialmente si en este último se ha observado una respuesta exagerada de ácido úrico sérico ante la ingesta de fructosa28.
Conclusión
Se ha demostrado, en modelos animales y humanos, el efecto positivo agudo de la ingesta de diferentes dosis de estevia sobre parámetros asociados al metabolismo de la glucosa y sobre el apetito y la saciedad, especialmente en presencia de DM2. Sin embargo, los estudios realizados a largo plazo han reportado nulos efectos sobre esos mismos parámetros.
La ingesta de D-tagatosa ha demostrado efectos positivos agudos sobre el metabolismo de la glucosa tanto en sujetos sanos como con DM2. Se recomienda su evaluación en términos crónicos. La D-tagatosa podría tener un efecto beneficioso al suprimir el apetito, causando mayor saciedad, sin embargo, los estudios son aún escasos en este ámbito. Por otro lado, la ingesta de D-tagatosa aumenta transitoriamente los niveles de ácido úrico sérico en sujetos sanos y con DM2, sin embargo, al no sobrepasar los valores de normalidad, no se considera un efecto clínicamente significativo. No obstante, este aumento transitorio podría ser relevante en sujetos con alteración del metabolismo del ácido úrico considerando que se declara una IDA “no especificada” para este edulcorante.
Debido a que el uso de ENN ha cobrado relevancia en el mercado alimenticio, con esta revisión se plantea la necesidad de continuar con el estudio de los efectos tanto agudos como crónicos de la ingesta de estevia y D-tagatosa, considerando una evaluación diferenciada dependiendo del modelo, la dosis y mezcla de ENN utilizada, puesto que los efectos metabólicos observados son distintos dependiendo de los parámetros mencionados anteriormente.
Referencias
- Franz M, Powers M, Leontos C, Holzmeister L, Kulkarni K, Monk A, et.al. The evidence for medical nutrition therapy for type 1 and type 2 diabetes in adults. J Am Diet Assoc 2010;110: 1852-1859.
- Academy of Nutrition and Dietetic. Position of the Academy of Nutrition and Dietetics: Use of nutritive and nonnutritive sweeteners. J Acad Nut Diet. 2012; 112: 739-758.
- Curi R, Alvarez M, Bazotte RB. Effect of Stevia rebaudiana on glucose tolerance in normal adult humans. Braz J Med Biol Res 1986; 19: 4-771.
- Bellisle F, Drewnowski A. Intense sweeteners, energy intake and the control of body weight. Eur J Clin Nutr. 2007; 61: 691-700.
- Chang JC, Wu MC, Liu IM, Cheng JT. Increase of insulin sensitivity by stevioside in fructose-rich chow-fed rats. Horm Metab Res 2005; 37: 610-616.
- Shirazi-Beechey SP, Daly K, Al-Rammahi M, Moran AW, Bravo D. Role of nutrient-sensing taste 1 receptor (T1R) family members in gastrointestinal chemosensing. Br J Nutr. 2014; 111(1): S8-15.
- Henquin JC. Do pancreatic β cells “taste” nutrients to secrete insulin? Sci Signal. 2012; 5(239): 36.
- American Diabetes Association. Nutrition Therapy Recommendations for the Management of Adults with Diabetes. Diabetes Care 2014; 37(1): S120-143.
- Katayama O, Sumnida T, Hayashi H, Mitsuhashi H. The practical application of Stevia and research and development data. edit. I.S.U. Company, Tokyo 1976; 747.
- García-Almeida M, Casado G, García J. Una visión global y actual de los edulcorantes. Aspectos de regulación. Nutr Hosp 2013; 28(4): 17-31.
- Momtazi-Borojeni AA, Esmaeili SA, Abdollahi E, Sahebkar A. A Review on the Pharmacology and Toxicology of Steviol Glycosides Extracted from Stevia rebaudiana. Curr Pharm Des. 2017; 23(11): 1616-1622.
- Gardana C, Simonetti, Canzi E, Zanchi R, Pietta P. Metabolism of Stevioside and Rebaudioside A from Stevia Rebaudiana extracts by Human Microflora. J Ag Food Chem 2003; 51(2): 6618-6622.
- European Food Safety Authority, Panel on Food Additives and Nutrient Sources added to Food. Scientific opinion on the safety of steviol glycosides for the proposed uses as a food additive. EFSA Journal 2010; 8(4): 1537.
- Lee CN, Wong KL, Liu JC, Chen YJ, Cheng JT, Chan P. Inhibitory effect of stevioside on calcium influx to produce anti-hypertension. Planta Med 2001; 67: 796-799.
- Chang JC, Wu MC, Liu IM, Cheng JT. Increase of insulin sensitivity by stevioside in fructose-rich chow-fed rats. Horm Metab Res 2005; 37: 610-616.
- Gregersen S, Jeppesen PB, Holst JJ, Hermansen K. Antihyperglycemic effects of stevioside in type 2 diabetic subjects. Metabolism 2004; 53: 73-76.
- Jeppesen PB, Gregersen S, Rolfsen SE, Jepsen M, Colombo M, Agger A et al. Antihyperglycemic and blood pressure-reducing effects of stevioside in the diabetic Goto-Kakizaki (GK) rat. Metabolism 2003; 52: 372-378.
- Jeppesen PB, Gregersen S, Alstrup KK, Hermansenet K. Stevioside induces antihyperglycaemic, insulinotropic and glucagonostatic effects in vivo: Studies in the diabetic Goto-Kakizaki (GK) rats. Phytomedicine 2002; 9: 9-14.
- Jeppesen PB, Gregersen S, Poulsen CR, Hermansen K. Stevioside acts directly on pancreatic beta cells to secrete insulin: actions independent of cyclic adenosine monophosphate and adenosine triphosphatesensitiveK+- channel activity. Metabolism 2000;49(2): 20.
- Anton SD, Martin CK, Han H, Coulon S, Cefalu WT, Geisselman et al. Effects of stevia, aspartame, and sucrose on food intake, saciety, and postprandial glucose and insulin levels. Appetite 2010; 55: 37-43.
- Barriocanal LA, Palacios M, Benitez G, Benitez S, Jimenez JT, Jimenez N et al. Apparent lack of pharmacological effect of steviol glycosides used as a sweeteners in humans. A pilot study of repeated exposures in some normotensive individuals with type 1 and type 2 diabetics. Regul Toxicol Pharmacol 2008; 51: 37-41.
- Maki KC, Curry LL, Reeves MS, Toth PD, McKenney JM, Farmer MV. Chronic consumption of rebaudioside A, a steviol glycoside, in men and women with type 2 diabetes mellitus. Food Chem Toxicol 2008; 46(7): S47-S53.
- Jeppesen PB, Barriocanal L, Meyer MT, Palacios M, Canete F, Benitez S et al. Efficacy and tolerability of oral stevioside in patients with type 2 diabetes: a long-term randomized, double-blinded, placebo-controlled study. Diabetologia 2006; 49(1): 511-512.
- Rizwan F, Rashid HU, Yesmine S, Monjur F, Chatterjee TK1. Preliminary analysis of the effect of Stevia (Stevia rebaudiana) in patients with chronic kidney disease (stage I to stage III). Contemp Clin Trials Commun 2018; 12:17-25.
- Ibrahim O, Spradlin J. Process for manufacturing D-tagatose 2000. Disponible en www.uspto.gov [Consultado el 23 de junio de 2019].
- Fifty-seventh meeting of the Joint FAOIWHO Expert Committee on Food Additives (JECFA). Safety evaluation of certain food additives and contaminants IPCS -International Programme on Chemical Safety. World Health Organization. Geneva; 2002. Disponible en http://www.who.int/ipcs/ publications/jecfa/en/Summary63final.pdf. [Consultado el 23 de junio de 2019].
- Joint FAO/WHO Expert Committee on Food Additives (JECFA) 2008. D-Tagatose: Chemical and Technical Assessment (CTA). 61st JECFA.
- Buemann B, Toubro S, Holst JJ, Rehfeld JF, Bibby BM, Astrup A. D-Tagatose, a stereoisomer of D-fructose increases blood uric acid concentration. Metabolism 2000;49(8):969-976.
- Saunders JP, Donner TW, Sadler JH, Levin G V, Makris NG. Effects of acute and repeated oral doses of d-tagatose on plasma uric acid in normal and diabetic humans. Regul Toxicol Pharmacol. 1999;29(2): S57-65.
- Ma J, Bellon M, Wishart J, Young R, Blackshaw L, Jones K, et al. Effect of the artificial sweetener, sucralose, on gastric emptying and incretin hormone release in healthy subjects. Am J of Physiol Gastrointest Liver Physiol 2009; 296: 735-739.
- Lu Y, Levin G, Donner T. Tagatose, a new antidiabetic and obesity control drug. Diabetes Obes Metab 2008; 10: 34-109.
- Ensor M, Williams J, Smith R, Banfield A, Lodder R. Effects of three low-doses of D-Tagatose on glycemic control over six months in subjects with mild type 2 diabetes mellitus under control with diet and exercise. J Endocrinol Diabetes Obes. 2014; 2(4): 1057.
- Donner TW, Wilbur JF, Ostrowski D. D-tagatose, a novel hexose: acute effects on carbohydrate tolerance in subjects with and without type 2 diabetes. Diabetes Obes Metab 1999; 1(5): 285-291.
- . Buemann B, Toubro S, Raben A, Blundell J, Astrup A. The acute effect of D-tagatose on food intake in human subjects. Br J Nutr. 2000; 84(2): 227-231.
- Little T, Gopinath A, Patel E, Mcglone A, Lassman D, D’Amato M, et al. Gastric emptying of hexose sugars: role of osmolality, molecular structure and the CCK1 receptor. Neurogastroenterol Motil 2010; 22(11): 1183-1190.
- Livesey G. Fructose ingestion: dose-dependent responses in health research. J Nutr. 2009;139(6): 1246S-1252S.
- Buemann B, Gesmar H, Astrup A, Quistorff B. Effects of oral D-tagatose, a stereoisomer of D-fructose, on liver metabolism in man as examined by 31P-magnetic resonance spectroscopy. Metabolism. 2000; 49(10): 1335- 1339.
- Boesch C, Ith M, Jung B, Bruegger K, Erban S, Diamantis I, et al. Effect of Oral D-Tagatose on Liver Volume and Hepatic Glycogen Accumulation in Healthy Male Volunteers. Regul Toxicol Pharmacol. 2001; 33(2): 257-267.