Hiperkalemia postoperatoria en síndrome de hueso hambriento post-paratiroidectomía por hiperparatiroidismo secundario en enfermedad renal crónica terminal
Magdalena Fuenzalida P1, Dalay Purto H1, Clara Rioseco R1, Sofía Kutscher C1, María Paz Amenábar M1, Rodrigo Tagle V2*, Aquiles Jara C2.
Hyperkalemia-associated hungry bone syndrome post-parathyroidectomy in end-stage denal disease
1. Estudiante de Escuela de Medicina. Facultad de Medicina. Pontificia Universidad Católica de Chile. Santiago, Chile.
2. Departamento de Nefrología. Escuela de Medicina. Facultad de Medicina. Pontificia Universidad Católica de Chile. Santiago, Chile.
*Correspondencia:
Rodrigo Tagle / rtagle@med.puc.cl
Departamento de Nefrología.
Escuela de Medicina. Facultad de
Medicina.
Pontificia Universidad Católica de Chile.
Santiago, Chile.
Teléfono: +56961581978.
Recibido: 18-05-2020
Aceptado: 26-06-2020
Resumen: Introducción: El hiperparatiroidismo secundario (HPTS) es una complicación de la enfermedad renal crónica terminal (ERCT). A pesar de nuevas terapias médicas como calcimiméticos, en HPTS refractarios la paratiroidectomía (PTX) continúa siendo necesaria. Una complicación frecuente en estos pacientes posterior a la PTX es el síndrome de hueso hambriento (SHH), caracterizado por una profunda y prolongada hipocalcemia asociada a hipofosfatemia, secundaria a un excesivo aumento de su captación ósea. Una complicación menos descrita, pero con consecuencias graves e incluso fatales, es la hiperkalemia. El propósito de este trabajo consiste en enfatizar el riesgo de hiperkalemia por SHH a partir de un caso clínico, señalar los mecanismos fisiopatológicos, factores de riesgo y consideraciones terapéuticas. Caso clínico: Mujer de 35 años, con ERCT de causa desconocida, HPTS refractario con PTX total e implante de glándulas en antebrazo hace 9 años. Ingresa por recurrencia de HPTS. Cintigrama MIBI SPECT/CT® evidenció implante hiperfuncionante, indicándose PTX del injerto. Exámenes preoperatorios: calcemia 8.6 mg/dL, fosfatasas alcalinas 1115 UI/L (VN <100), PTH intacta (PTHi) 3509 pg/ml y kalemia 4.8 mEq/L. Biopsia: hiperplasia paratiroidea nodular. En postoperatorio inmediato presentó hiperkalemia de 7.1 mEq/L con cambios electrocardiográficos, requiriendo hemodiálisis de urgencia. Posteriormente desarrolló hipocalcemia, hipofosfatemia e hipomagnesemia, de difícil control. Discusión: El SHH post HPTS puede coexistir con hiperkalemia postoperatoria inmediata grave, incluso fatal si no se identifica y corrige a tiempo. El mecanismo fisiopatológico aún no está bien dilucidado. Varios factores pudieran intervenir, incluyendo aumento del metabolismo celular, traumatismo tisular, fármacos anestésicos, fluidos perioperatorios y flujo de iones transmembrana. El nivel de potasio previo a la cirugía, menor edad, género masculino, tiempo entre la última hemodiálisis y la cirugía, y duración de la PTX, son factores de riesgo para hiperkalemia postoperatoria. El conocimiento de esta grave complicación permitirá estar preparado para monitorizar y eventualmente tratar.
Palabras clave: Hiperparatiroidismo secundario; Hiperkalemia; Hipocalcemia; Insuficiencia renal crónica; Paratiroidectomía.
Abstract: Introduction: Secondary Hyperparathyroidism (SHPT) is a complication of End-Stage Renal Disease (ESRD). Although new medical therapies (i.e.calcimimetics,) parathyroidectomy (PTX) continues to be necessary in refractory cases. A well-known complication after PTX is an entity called Hungry Bone Syndrome (HBS), characterized by deep and prolonged hypocalcemia associated with hypophosphatemia, secondary to an excessive increase in bone formation. A less reported complication, but with severe or even fatal consequences, is hyperkalemia. The purpose of this work consists of emphasizing the risk of hyperkalemia in HBS, reporting a clinical case that points out the physiopathological mechanisms, risk factors, and therapeutic considerations. Clinical case: 35-year-old woman with ESRD of unknown cause with refractory SHPT with total PTX and forearm gland grafts nine years ago. She presented SHPT recurrency. MIBI SPECT/CT® scan showed a hyperfunctioning implant, indicating graft PTX. Preoperative tests: calcemia 8.6 mg/dL, phosphatemia 7.3 mg/dL, alkaline phosphatases 1115 UI/L (VN<100), intact PTH (iPTH) 3509 pg/ml and kalemia 4.8 mEq/L. Biopsy: parathyroid nodular hyperplasia. In the immediate postoperative period, she presented hyperkalemia at 7.1 mEq/L with electrocardiographic changes, requiring emergency hemodialysis. Later she developed hypocalcemia, hypophosphatemia, and hypomagnesemia of difficult control. Discussion: HBS post PTX can coexist with severe immediate postoperative hyperkalemia, which can be even fatal if not detected and corrected. The physiopathological mechanism is still not entirely elucidated. Various factors could interfere, including an increase in cell metabolism, tissue traumatism, anesthetic drugs, intraoperative fluids, and transmembrane ion flow. Preoperative potassium levels, younger age, male gender, the time elapsed between last hemodialysis and surgery, and duration of PTX are risk factors for post-surgical hyperkalemia. Knowing this severe complication will allow the medical team to be prepared for monitoring and eventually treating it.
Key words: Chronic Renal Insufficiency; Hyperkalemia; Hypocalcemia; Parathyroidectomy; Secondary hyperparathyroidism.
El hiperparatiroidismo secundario (HPTS) es una complicación frecuente de la enfermedad renal crónica terminal (ERCT)1,2. Constituye el principal trastorno óseo-mineral en la población chilena en hemodiálisis crónica, donde el 67% tiene niveles de hormona paratiroidea intacta (iPTH) sobre los niveles máximos recomendados por KDOQI, y un 19% presenta HPTS grave (iPTH > 1.000 pg/ml)3. La terapia actual consiste en dieta baja en fósforo, quelantes de fósforo, optimización de la diálisis, calcitriol y calcimiméticos. Sin embargo, la paratiroidectomía (PTX) continúa siendo un procedimiento necesario en HPTS refractarios2.
Comúnmente, se produce un descenso leve a moderado en la calcemia luego de la PTX en pacientes con HPTS. Algunos pacientes desarrollan una disminución pronunciada y persistente de la concentración de calcio sérico, asociado a hipofosfatemia, lo que se denomina síndrome de hueso hambriento (SHH), el cual requiere importantes aportes de calcio y fósforo. Ocurre a consecuencia de una rápida remineralización ósea debido al descenso abrupto de la iPTH, luego de un período sostenido de estimulación de la resorción y formación ósea1. La incidencia comunicada del SHH es variable y oscila entre un 27,4% y un 86,6%4. Contribuye a la mortalidad y morbilidad asociada a la PTX por arritmias y convulsiones1. Se han estudiado distintos marcadores que pueden predecir mayor riesgo de desarrollar SHH. Estos pacientes generalmente presentan niveles de fosfatasas alcalinas tres veces superior al límite normal y niveles de iPTH mayor a 1.000 pg/ml. Sin embargo, aún no se han establecido puntos de corte para estos parámetros2.
La hiperkalemia post PTX es otra complicación descrita, pero poco conocida. La incidencia reportada oscila entre un 25 y 80%5 y se asocia a mortalidad si no se identifica y corrige a tiempo. Los factores de riesgo y mecanismos subyacentes no se han establecido claramente5.
El propósito de este trabajo consiste en enfatizar el riesgo de hiperkalemia asociada a SHH posterior a la PTX en pacientes con HPTS en ERCT. Señalar los posibles mecanismos fisiopatológicos, factores de riesgo y algunas consideraciones del manejo perioperatorio.
Caso clínico
Mujer de 35 años, con antecedente de ERCT de causa desconocida, en hemodiálisis desde hace 19 años. A los 6 años de ERCT, desarrolló HPTS requiriendo PTX parcial. Luego de 4 años requirió una PTX total con autoimplante de glándulas en antebrazo.
Nueve años después, presentó ascenso progresivo y persistente de iPTH refractario a terapia con dieta baja en fósforo, optimización de la diálisis, calcimiméticos (cinacalcet) y calcitriol. El cintigrama MIBI SPECT/CT® reveló un implante hiperfuncionante (Figura 1). Por lo anterior, se indicó PTX del injerto.
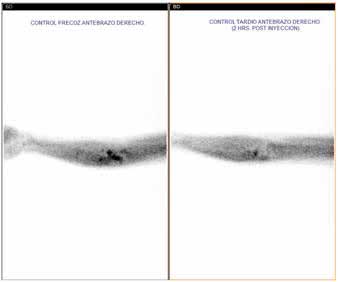 Figura 1: Cintigrama SESTAMIBI® implantes paratiroides de antebrazo.
Figura 1: Cintigrama SESTAMIBI® implantes paratiroides de antebrazo. Exámenes preoperatorios: calcemia 8.6 mg/dL, fosfatemia 7.3 mg/dL, fosfatasas alcalinas 1115 UI/L (VN <100), iPTH 3509 pg/ml, bicarbonato plasmático 20.8 mEq/L y kalemia 4.8 mEq/L.
Al día siguiente de su última sesión de hemodiálisis, se realizó implantectomía con reimplante de 4 fragmentos. La iPTH disminuyó en el intraoperatorio (iPTH 4255 pg/ml post incisión y 915, 551, 425 y 368 pg/ml a los 5, 10, 15 y 20 minutos respectivamente), considerándose una PTX exitosa1. Biopsia intraoperatoria informó hiperplasia nodular paratiroidea, que posteriormente se confirmó.
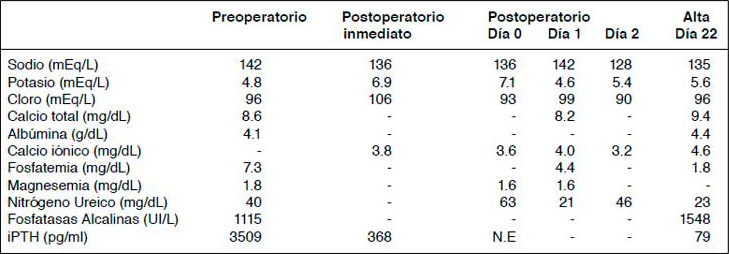
En el postoperatorio inmediato cursó con hiperkalemia hasta 7.1 mEq/L con cambios electrocardiográficos, que requirió traslado a Unidad de Cuidados Intensivos y hemodiálisis de urgencia. Posteriormente, persistió con tendencia a la hiperkalemia y precozmente desarrolló SHH con hipocalcemia, hipofosfatemia e hipomagnesemia de difícil manejo (Tabla 1).
Tras 3 semanas con infusiones endovenosas de calcio, hemodiálisis frecuentes con calcio alto en el dializado (4.0 mEq/L), elevados aportes orales de calcio elemental (12 gr/ día), fósforo (19 gr/día), y calcitriol (4 ug/día), logró estabilizar parámetros y fue dada de alta.
Tabla 1. Exámenes preoperatorios, postoperatorios y al alta.
Discusión
El SHH aumenta la morbimortalidad asociada al procedimiento, prolonga la estadía hospitalaria y puede coexistir con hiperkalemia grave2,5.
Estos pacientes pueden presentar grados variables de hipocalcemia, por lo que sería óptimo contar con protocolos de suplementación de calcio individualizados. Yang y col proponen 4 ecuaciones que permiten predecir la velocidad media de descenso en la calcemia postoperatoria y la dosis de suplementación de calcio a partir de parámetros preoperatorios: fosfatasas alcalinas, iPTH y hemoglobina4. Sin embargo, resultan difíciles de aplicar en la práctica clínica. La suplementación de magnesio debe ser considerada según los niveles plasmáticos y los quelantes de fósforo en general deben suspenderse, pues la fosfatemia disminuye. Incluso, se debe considerar suplementar fósforo cuando desciende bajo 1 mg/dl1.
La hiperkalemia es una complicación de aparición más precoz que la hipocalcemia. Factores de riesgo tradicionalmente descritos en pacientes en hemodiálisis son: kalemia mayor a 4,4 mEq/L previo a la cirugía5, edad menor de 50 años, género masculino6, uso de inhibidores de enzima convertidora angiotensina (IECA) o antagonistas del receptor de angiotensina II (ARAII), tiempo transcurrido entre la última hemodiálisis y la cirugía5, duración de la PTX7 y un aumento mayor a 0.5 mEq/L de la kalemia posterior a la inducción anestésica8. Adicionalmente, aumentan el riesgo tanto de SHH e hiperkalemia los niveles preoperatorios de fosfatasas alcalinas y la dosis total de suplemento de calcio endovenoso9. En consecuencia, los pacientes con mayor riesgo de SHH tienen también mayor riesgo de hiperkalemia. Esto último, de gran relevancia clínica para el control y seguimiento de pacientes post PTX.
Se plantea que el mecanismo fisiopatológico detrás de la hiperkalemia en estos pacientes es multifactorial, incluyendo: aumento del metabolismo celular con acidosis metabólica y respiratoria que afecta la redistribución del potasio, traumatismo tisular, fármacos anestésicos, manejo de fluidos intraoperatorios y flujo de iones transmembrana7.
Una vez realizada la PTX, se produce un secuestro del calcio por parte del hueso. La hipocalcemia generada promovería la entrada de sodio en células del músculo esquelético, mediante la bomba Na-K ATPasa, con la subsiguiente salida de potasio y aumento de la kalemia durante y después de la PTX9.
Cabe destacar que la hiperkalemia post PTX puede ocurrir en el intraoperatorio, postoperatorio inmediato o hasta dentro de 24 horas luego de la cirugía10. Debido a esto, es oportuno realizar un monitoreo precoz y frecuente de la kalemia en estos pacientes. En contraparte, la hipocalcemia comienza a manifestarse desde el día 1 posterior a la cirugía11.
La hiperkalemia post PTX en este caso podría atribuirse a los siguientes factores: a) traumatismo tisular, b) inductor anestésico, c) fluidos perioperatorios, d) acidosis metabólica.
En cuanto al traumatismo tisular, los implantes de paratiroides se encontraban en los músculos del antebrazo, tejido con alto contenido en potasio.
Respecto al manejo anestésico de pacientes con ERCT y considerando el riesgo de desarrollar hiperkalemia, se recomienda el uso de propofol y relajantes musculares no depolarizantes por sobre otros anestésicos12,13,14,15. En cambio, el uso de succinilcolina se asocia a un aumento de la kalemia en 0,5 a 1 mEq/L y no es recomendado de primera línea16. En nuestro caso, no puede atribuirse la hiperkalemia al uso de inductores anestésicos, pues se utilizó propofol y atracurio.
En relación a la volemización perioperatoria existe evidencia contradictoria respecto a su rol en las variaciones plasmáticas de potasio. Diversos autores señalan que el uso de suero Ringer Lactato (SRL) no se asocia a un aumento de la kalemia en pacientes con ERCT17,18,19. El volumen de distribución se equilibrará entre el espacio intra y extracelular, por lo que el aporte con una infusión de 4 mEq/L de potasio no generaría un efecto acumulativo en el extracelular17,18,19. Adicionalmente, se menciona que la volemización con NaCl 0,9% se asocia a mayor incidencia de hiperkalemia, ya que la solución potencia la generación o perpetuación de acidosis metabólica17,18,19. Por el contrario, Gkotmi y col señalan que el SRL sí generaría un efecto aditivo en la concentración de potasio extracelular en pacientes con ERCT20. Es importante destacar que en pacientes con ERCT el aporte de volumen está restringido, y en este caso se aportaron 500 mL SRL (2 mEq totales de potasio), por lo que el trastorno determinado por volemización es menos probable.
Respecto a la acidosis metabólica, tal como se mencionó en el caso, previo al procedimiento la paciente cursaba con leve acidosis, propia de los pacientes en hemodiálisis, pero con normokalemia. Durante el intraoperatorio no hubo cambios en su estado ácido base (Tabla 1). Por ende, este mecanismo no influyó en el desarrollo de hiperkalemia.
Por último, la paciente no recibió ARAII ni IECA. En definitiva, el grave trastorno electrolítico tuvo relación directa con el desarrollo de SHH, como ha sido descrito en la literatura.
En conclusión, el SHH es un trastorno que aumenta la morbimortalidad asociada a la PTX, cuyas alteraciones metabólicas (hipocalcemia, hipofosfatemia, hipomagnesemia e hiperkalemia) pueden tener repercusiones clínicas graves. La hiperkalemia es una complicación poco conocida, que ocurre precozmente en el postoperatorio inmediato. Para prevenirla es importante tener en cuenta los factores predisponentes, realizar una adecuada diálisis preoperatoria, estudiar el potasio preoperatorio y considerar los fármacos anestésicos y fluidos perioperatorios. Se debe monitorizar rigurosamente la kalemia de estos pacientes en el postoperatorio inmediato y estar preparado para tratar esta complicación de manera oportuna.
Agradecimientos
Se agradece al equipo quirúrgico y de imagenología por su contribución a esta publicación.
Referencias
- Jain N, Reilly R. Hungry bone syndrome. Current Opinion in Nephrology and Hypertension. 2017; 26(4): 250-255.
- Ho L, Wong P, Sin H, Wong Y, Lo K, Chan S et al. Risk factors and clinical course of hungry bone syndrome after total parathyroidectomy in dialysis patients with secondary hyperparathyroidism. BMC Nephrology. 2017; 18(1): 12.
- Quintero N, Parra D, Jara A. Hiperparatiroidismo secundario es el trastorno óseo-mineral predominante en pacientes en hemodiálisis crónica en Chile. XLVII Congreso Nacional de la Sociedad Española de Nefrología, 6-9 de octubre de 2017, Burgos, España.
- Yang G, Zha X, Mao H, Yu X, Wang N, Xing C. Hypocalcemia-based prediction of hungry bone syndrome after parathyroidectomy in hemodialysis patients with refractory secondary hyperparathyroidism. J Int Med Res. 2018; 46(12): 4985-4994.
- Li S, Liu S, Chen Q, Ge P, Jiang J, Sheng X et al. Clinical predictor of postoperative hyperkalemia after parathyroidectomy in patients with hemodialysis. Int J Surg 2018; 53: 1-4.
- Yang YL, Lu HF, Chung KC, Jawan B, Chou FF. Young age, male sex, and end-stage renal disease with secondary hyperparathyroidism as risk factors for intraoperative hyperkalemia during parathyroidectomy. J Clin Anesth 2015; 27(3): 195-200.
- Pauling M, Lee JC, Serpell JW, Wilson S. Severe hyperkalaemia complicating parathyroidectomy in patients with end-stage renal disease. Anaesth. Intensive Care 2017; 45(3): 365-368.
- Bajaj Y, Roberts S, Simon D, Snowden C, Gianopoulos I, England RJ. Intra-operative hyperkalemia: a serious but under recognised complication of renal parathyroidectomy a prospective study: how we do it. Clin Otolaryngol 2011; 36: 69-72.
- Yang G, Wang J, Sun J, Zha X, Wang N, Xing C. Perioperative hyperkalemia in hemodialysis patients undergoing parathyroidectomy for renal hyperparathyroidism. Intern Emerg Med 2019; 14(7): 1065-1071.
- Song YH, Cai GY, Xiao YF, Wang YP, Yang ST, Chen XM. Can we predict who will develop postoperative hyperkalaemia after parathyroidectomy in dialysis patients with secondary hyperparathyroidism? BMC Nephrol. 2019; 20(1): 225.
- Ho LY, Wong PN, Sin HK, Wong YY, Lo KC, Chan SF et al. Risk factors and clinical course of hungry bone syndrome after total parathyroidectomy in dialysis patients with secondary hyperparathyroidism. BMC Nephrol. 2017; 18(1): 12.
- Ickx B, Cockshott D, Byttebier L, De Pauw L, Vandesteene A, D’Hollander AA. Propofol infusion for induction and maintenance of anaesthesia in patients with end-stage renal disease. Br J Anaesthesia 1998; 81: 854- 860.
- Fahey M, Rupp S, Fisher D, Miller, R, Sharma M, Canfell C et al. The pharmacokinetics and pharmacodynamics of atracurium in patients with and without renal failure. Anesthesiology. 1984; 61: 699-702.
- Bryson H, Faulds D. Cistracurium Bessilate. A review of its pharmacology and clinical potential in anesthetic practice. Drugs. 1997; 53: 848-866.
- Sparr H, Beaufort T, Fuchs-Buder T. Newer neuromuscular blocking agents. How do they compare with established agents? Drugs. 2001; 61: 919-942.
- Thapa S, Brull S J. Succinylcholine-induced hyperkalemia in patients with renal failure: an old question revisited. Anesth Analg 2000; 91: 237-241.
- Singh S, Kerndt CC, Davis D. Ringer’s Lactate. In: StatPearls. Treasure Island (FL): StatPearls Publishing; 2020 Jan. Available from: https://www. ncbi.nlm.nih.gov/books/NBK500033/
- O’Malley CM, Frumento RJ, Hardy MA, Benvenisty AI, Brentjens TE, Mercer JS et al. A randomized, double-blind comparison of lactated Ringer’s solution and 0.9% NaCl during renal transplantation. Anesth. Analg. 2005; 100: 1518-1524.
- Modi MP, Vora KS, Parikh GP, Shah VR. A comparative study of impact of infusion of Ringer’s Lactate solution versus normal saline on acid-base balance and serum electrolytes during live related renal transplantation. Saudi J Kidney Dis Transpl. 2012; 23: 135-137.
- Gkotmi N, Kosher C, Filippatos TD, Elisaf MS. Use of intravenous fluids/ solutions: a narrative review. Current Medical Research and Opinion. 2016; 33: 459-471.