Variación de dosis de radioyodo en pacientes con cáncer diferenciado de tiroides post implementación de guías ATA 2015
Lucas Fuenzalida M1, Tomás González A1, Marcelo Portilla R1, Patricio Gac E2, Francisco Rodríguez M2, Patricio
Cabané T2, Daniel Rappoport W.2,3*.
Variation of radioiodine dose in patients with differentiated thyroid cancer after implementation of the ATA 2015 guidelines
1. Interno de Medicina, Universidad de Chile. Santiago, Chile.
2. Unidad de Cirugía de Cabeza y Cuello, Hospital Clínico Universidad de Chile. Santiago, Chile
3. Departamento de Cirugía, Clínica Alemana de Santiago. Santiago, Chile.
*Correspondencia: Daniel Rappoport Wurgaft. dr.rappoport@gmail.com Teléfono: +56992360724.
Recibido: 08-05-2020
Aceptado: 26.06-2020
Resumen: Introducción: El cáncer diferenciado de tiroides (CDT), es actualmente la neoplasia endocrina más frecuente. Su tratamiento estándar es la resolución quirúrgica, asociado a ablación con radioyodo (RI) según la clasificación propuesta por la American Thyroid Association (ATA). Las indicaciones y dosis de este último, han ido variando en los últimos años según avanzan las investigaciones en este ámbito. Objetivo: En el siguiente estudio se compararon las dosis de RI utilizadas previo y posterior a la implementación de las últimas guías de la ATA. Materiales y métodos: Estudio retrospectivo observacional de 70 pacientes con diagnóstico de CDT del Hospital Clínico de la Universidad de Chile entre 2012 y 2017. Se agruparon los pacientes en dos cohortes, los operados entre los años 2012-2015 y los 2016-2017 clasificándolos según riesgo ATA, TNM y riesgo de recurrencia. Se consignaron las dosis de RI utilizadas y se compararon entre las cohortes. Análisis estadístico: Mann Whithney. Resultados: Al comparar la dosis de RI entre ambas cohortes, según TNM y riesgo ATA, se obtuvo los siguientes resultados: los pacientes T1b de la cohorte 2012-2015 presentaron dosis de RI significativamente mayores que los de la cohorte 2016-2017; también se evidenció que en pacientes N0 hubo una diferencia estadísticamente significativa, mostrando una tendencia a disminuir la dosis de RI; además, en los pacientes de la cohorte 2012-2015 con riesgo ATA intermedio, se obtuvo que las dosis de RI fueron significativamente mayores que las utilizadas en la cohorte 2016-2017. Conclusión: Se concluye que las variaciones de las dosis de RI utilizadas en pacientes con CDT en un hospital universitario van acorde a las recomendaciones internacionales actuales, particularmente la publicación de la guía ATA 2015, aplicándose radioablación con menor dosis de RI. Dado este cambio, se ha evidenciado igualdad de efectos con dosis menores de RI y consecuentemente menos efectos adversos.
Palabras clave: Cáncer diferenciado de tiroides; Radioyodo. Abstract:
Introduction: Differentiated thyroid cancer (CDT) is currently the most frequent endocrine neoplasia. Its standard of care is surgical treatment, associated with radioiodine ablation (IR) according to the classification proposed by the American Thyroid Association (ATA). The indications and doses of the latter have changed in recent years as research in this area advances. Objective: In the following study, the doses of IR used before and after the implementation of the latest ATA guidelines were compared. Materials and methods: Retrospective observational study of 70 patients with a diagnosis of CDT from the Clinical Hospital of the University of Chile between 2012 and 2017. Patients were grouped into two cohorts, those surgically intervened between the years 2012-2015 and 2016-2017, classifying them according to ATA risk, TNM and recurrence risk. The IR doses used were reported and compared between the cohorts. Statistical analysis: Mann Whithney. Results: When comparing the IR dose between both cohorts, according to TNM and ATA risk, the following results were obtained: T1b patients in the 2012-2015 cohort had significantly higher IR doses than those in the 2016-2017 cohort; It was also evidenced that N0 patients showed a statistically significant tendency to decrease the IR dose; In addition, the 2012-2015 cohort with intermediate ATA risk, revealed IR doses significantly higher than those used in the 2016-2017 cohort. Conclusion: It is concluded that the variations in IR doses, used in patients with CDT in a university hospital, are in accordance with current international recommendations, particularly the publication of the ATA 2015 guidelines, applying radioablation with a lower dose of IR. Given this change, equality of effects has been evidenced with lower doses of IR and consequently fewer adverse effects.
Key words: Differentiated thyroid cancer; Radioiodine.
Se estima que un 5% de los nódulos tiroideos puncionados corresponden a cáncer de tiroides, siendo actualmente la neoplasia endocrina más frecuente1. De ellos, el cáncer diferenciado de tiroides (CDT) representa el 95% del total, pudiendo identificarse dos subtipos histológicos principales en este grupo: papilar (92%) y folicular (5%)2. En menor proporción, pueden corresponder a cáncer medular de tiroides o tumores anaplásicos (2-3% y 2% respectivamente), sin olvidar la existencia de linfomas y metástasis en menor frecuencia2.
El tratamiento estándar del CDT corresponde a la resolución quirúrgica con posterior ablación con radioyodo (RI) en caso de requerirse3. Lo anterior es definido mediante la clasificación propuesta por la American Thyroid Association (ATA), la cual estratifica a los pacientes en 3 grupos (alto, intermedio y bajo riesgo) según el riesgo de recurrencia o persistencia de enfermedad (Tabla 1)4. El RI, continúa siendo el tratamiento adyuvante de elección para el CDT, en los casos necesarios. Las indicaciones y dosis, han ido variando el los últimos años según avanzan las investigaciones en este ámbito, con una tendencia a menores dosis5,6,7.
Esto debido en parte, a que en la última guía ATA publicada el 2015, se postulan los grupos de riesgo, y que en el grupo de bajo riesgo, dosis menores de hasta 30 mci, podrían ser igual de efectivas que las dosis mayores utilizadas previamente en este grupo de pacientes4.
En el siguiente estudio se compararon las dosis de RI utilizadas previo y posterior a la implementación de las últimas guías de la ATA4. Materiales y métodos Estudio retrospectivo observacional, entre los años 2012 y 2017, tratados en el Hospital Clínico de la Universidad de Chile (HCUCH) con el diagnóstico de cáncer diferenciado de tiroides (CDT).
Como criterios de inclusión del estudio se utilizó: diagnóstico de CDT operado y que hayan recibido adyuvancia con radioyodo en nuestra institución. Además, que tuvieran al menos una toma de valores plasmáticos de pTg, TSH y valores de Anti Tg. Se excluyeron los pacientes con títulos de anticuerpos antitiroglobulinas positivos (>20 ng/mL).
Se agruparon los pacientes en dos cohortes, los operados entre los años 2012-2015 y los 2016 y 2017 clasificándolos según riesgo ATA, TNM y riesgo de recurrencia4. Se consignaron la edad, el sexo de los pacientes, la histología y el tipo de cirugía. De la misma manera se consignaron las dosis de radioyodo utilizadas y se compararon entre las cohortes. Análisis estadístico: Mann Whithney. Se consideró un p-value 0.05 como valor significativo.
Resultados
De los 700 pacientes recopilados, solo 70 cumplieron los criterios de inclusión. En la tabla 2. Se exponen las características de los pacientes separados por cohortes.
Se agruparon los pacientes según la clasificación TNM y etapa, separados por cohorte. Es importante considerar que las etapas cambian según si los pacientes son menores o mayores de 45 años. En nuestra muestra, en ambas cohortes los menores de 45 años fueron clasificados como etapa I ya que ninguno de ellos presentó metástasis a distancia (Tabla 3).
Se agruparon los pacientes según riesgo de recurrencia de acuerdo a la clasificación de la guía ATA y según las dosis de RI utilizadas (Tabla 4).
Tabla 1. Estratificación de riesgo de recurrencia. Adaptado de 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid
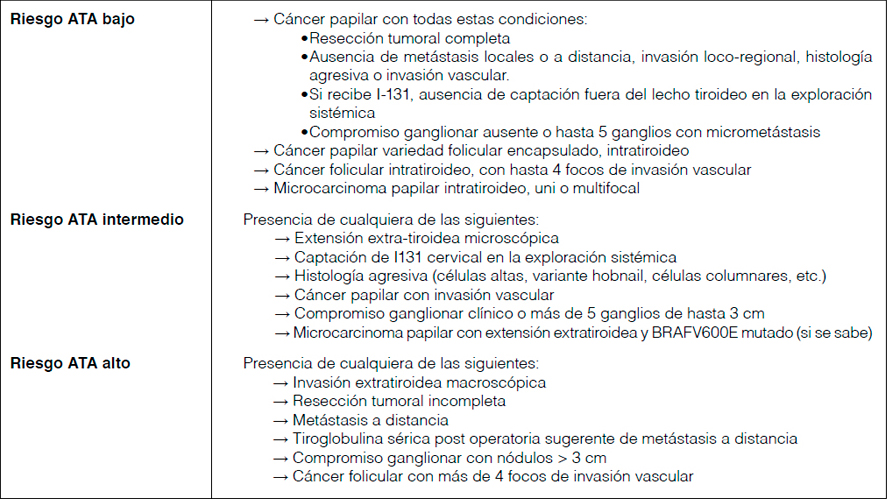
Tabla 2. Características de los pacientes. TT+V: Tiroidectomía total más vaciamiento de algún grupo ganglionar.
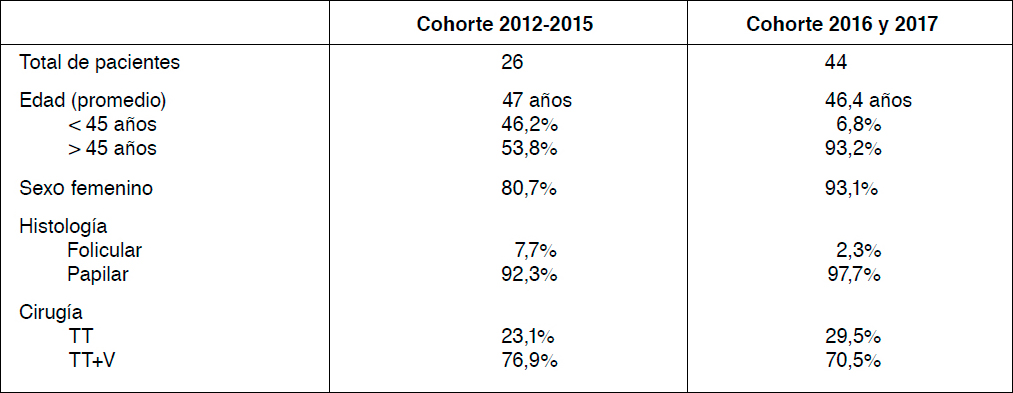
Tabla 3. TNM y etapa TNM.
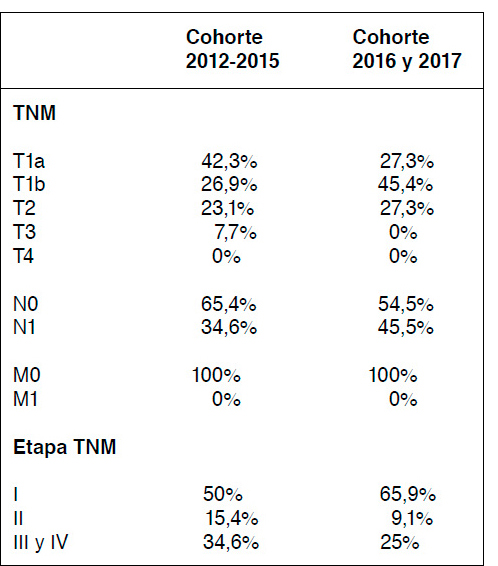
Tabla 4. Riesgo de recurrencia según la ATA y dosis de radioyodo. S/d: sin datos.
Se analizaron las dosis de radioyodo utilizadas en ambas cohortes según la clasificación TNM para CDT de forma separada según T (tamaño tumoral), N (metástasis linfonodal) y M (metástasis a distancia)4. En los pacientes con T1a no hubo diferencias significativas entre las dosis de RI administradas (p-value: 0,31) (Gráfico 1). Por el contrario, los pacientes T1b de la cohorte 2012-2015 presentaron dosis de RI significativamente mayores que los de la cohorte 2016-2017 (p-value: 0,02) (Gráfico 2). Por otro lado, en los pacientes con tumores T2 no hubo diferencias significativas entre ambas cohortes (p-value: 0,47) (Gráfico 3). Dado que en la muestra no hubo los suficientes pacientes T3 y T4 no se realizó el análisis correspondiente.
Analizando la presencia de metástasis linfonodal se evidenció que en pacientes N0 hubo una diferencia estadísticamente significativa de la dosis de RI entre las cohortes con un p-value: 0,0001 (Gráfico 4). Por el contrario, se compararon los pacientes N1 entre ambas cohortes, sin resultados estadísticamente significativos (p-value: 0,08) (Gráfico 5).
Se analizaron las dosis de radioyodo entre ambas cohortes según la clasificación de riesgo ATA4. En el grupo de pacientes de bajo riesgo, se obtuvo que a pesar de que en la cohorte 2012-2015 se utilizaron mayores dosis de RI esta diferencia no fue estadísticamente significativa (p-value: 0,16) (Gráfico 6). En cambio, en los pacientes de la cohorte 2012-2015 con riesgo intermedio se obtuvo que las dosis de RI fueron mayores y estadísticamente significativas (p-value: 0,006) (Gráfico 7). Dado que en la muestra solo existe un paciente con riesgo alto, no se pudo realizar el análisis estadístico correspondiente.
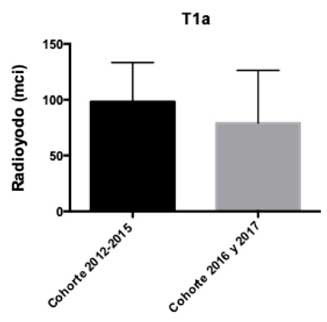 Gráfico 1: Dosis de radioyodo utilizada en pacientes estadio
T1a, según cohortes.
Gráfico 1: Dosis de radioyodo utilizada en pacientes estadio
T1a, según cohortes.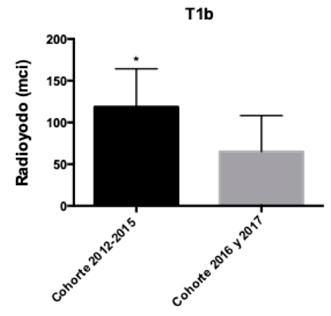 Gráfico 2: Dosis de radioyodo utilizada en pacientes estadio
T1b, según cohortes.
Gráfico 2: Dosis de radioyodo utilizada en pacientes estadio
T1b, según cohortes.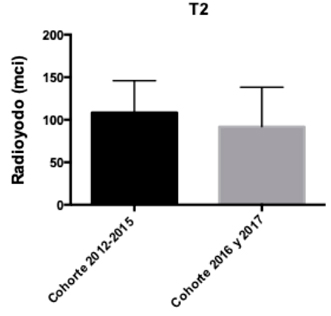 Gráfico 3: Dosis de radioyodo utilizada en pacientes estadio
T2, según cohortes.
Gráfico 3: Dosis de radioyodo utilizada en pacientes estadio
T2, según cohortes.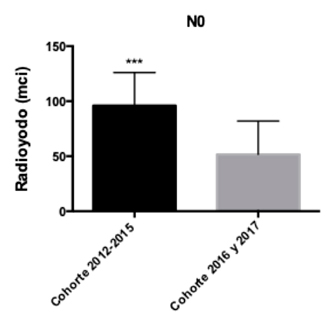
Gráfico 4: Dosis de radioyodo utilizada en pacientes N0, según cohortes.
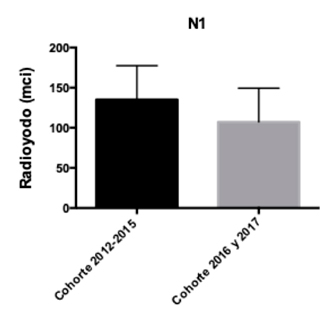 Gráfico 5: Dosis de radioyodo utilizada en pacientes N1,
Gráfico 5: Dosis de radioyodo utilizada en pacientes N1,según cohortes.
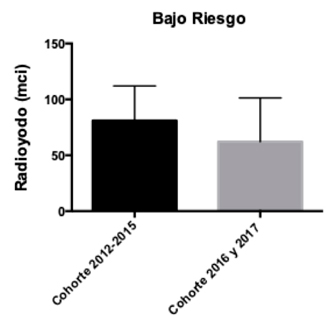 Gráfico 6: Dosis de radioyodo utilizada en pacientes de bajo
Gráfico 6: Dosis de radioyodo utilizada en pacientes de bajoriesgo, según cohortes.
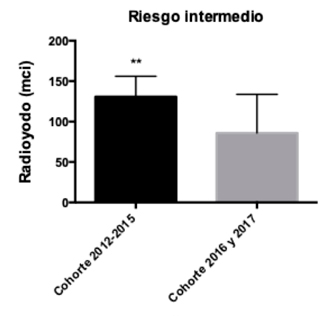 Gráfico 7: Dosis de radioyodo utilizada en pacientes de riesgo
Gráfico 7: Dosis de radioyodo utilizada en pacientes de riesgointermedio, según cohortes.
Discusión
En la literatura se describe una serie de recomendaciones generales para la indicación de ablación con RI, dependiendo del riesgo, con dosis entre 30 y 150 mci, evidenciándose en distintos artículos rangos variables en las dosis administradas3. En la actualidad, destaca la tendencia a la utilización de dosis cada vez menores de RI, particularmente en individuos de bajo riesgo, donde se ha evidenciado igualdad de efectos con dosis menores de RI y menos efectos adversos4,5.
La publicación de las guía ATA 2015, en donde se cambia el análisis de los grupos de riesgo y por consiguiente se cambia la mirada de estos pacientes, incorporando otros factores a la evaluación multidisciplinaria post operatoria, para definir la necesidad y dosis de la ablación con RI.
En nuestro estudio se analizaron cohortes de pacientes con CDT previos a la guía ATA 2015 y posterior a ésta, considerando los cambios previamente descritos con respecto a las dosis de radioyodo a utilizar. Como era de esperar, en el grupo de pacientes de la cohorte 2012-2015 la dosis de RI fue superior a la de la cohorte 2016 y 2017 independiente del tamaño tumoral (T), siendo significativamente mayor en los T1b. De la misma manera, en pacientes de la cohorte pre guía ATA 2015 se utilizaron dosis mayores de RI independiente de la presencia de metástasis linfonodal, siendo significativamente mayores en pacientes N0 pre guía ATA 2015.
Vemos en nuestros resultados, que el mayor cambio se observa en los pacientes con enfermedad menos agresiva (T1b y n0), lo que podría explicarse por una mayor resistencia a la disminución de las dosis de RI, en pacientes con mayor carga tumoral o enfermedad más agresiva. En los pacientes de cohorte 2012-2015 se utilizaron dosis mayores de RI independiente del riesgo de recurrencia, siendo significativamente mayores en el grupo de riesgo intermedio. Al comparar las dosis de RI, se observa un aumento de la utilización de dosis de 30 y 50 mci, en la cohorte 2016 y 2017, lo sigue la relación observada al analizar los diferentes subgrupos entre las cohortes.
Llama la atención que de nuestra base de datos de 700 pacientes, solo 70 cumplieran los criterios de inclusión. Esto podría explicarse, por un número elevado de casos que completan su tratamiento adyuvante en otras instituciones y a la falta de mayor prolijidad, en el registro clínico. Se concluye que las variaciones de las dosis de RI utilizadas en pacientes con CDT en un hospital universitario van acorde a las recomendaciones internacionales actuales; utilizando radioablación con menor dosis de RI.
Referencias
- Majlis S, Tala H. Novedades según Patologías Específicas: Cáncer de Tiroides. Innovacion Oncologica en Clinica Alemana. 188-194.
- Programa de Cáncer del Adulto 2020. Protocolo Clínico: Cáncer Diferenciado de Tiroides. Subsecretaría de Salud Pública, Ministerio de Salud de Chile. 2020
- Rosario P, Xavier A, Calsolari M. Value of Postoperative Thyroglobulin and Ultrasonography for the Indication of Ablation and131I Activity in Patients with Thyroid Cancer and Low Risk of Recurrence. Thyroid. 2011; 21(1): 49-53.
- Haugen B. et al. 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid. 2016; 26(1): 1-92.
- Feldt-Rasmussen U, Petersen PH, Date J, et al. Serum thyroglobulin in patients undergoing subtotal thyroidectomy for toxic and nontoxic goiter. J Endocrinol Invest 1982; 5(3): 161-164.
- Schlumberger M, Catargi B, Borget I, Deandreis D, Zerdoud S, Bridji B, et al. Strategies of Radioiodine Ablation in Patients with Low-Risk Thyroid Cancer. N Engl J Med. 2012; 366(18): 1663-1673.
- Medina S, Garcia F, Granados M. Impacto de la Medicina Nuclear en el Diagnóstico y Tratamiento del Cáncer Diferenciado de Tiroides. Gac Med Mex. 2018; 154: 509-519.