Vitamina D, miR-21 y marcadores de apoptosis en pacientes con diabetes tipo 1
Lissette Duarte-Silva1,2+, Francisca Salas-Pérez3+, Diego García-Díaz1, Francisco Pérez-Bravo1,4*.
Vitamin D, miR-21 and apoptosis markers in patients with type 1 diabetes
- Laboratorio de Nutrigenómica. Departamento de Nutrición. Facultad de Medicina. Universidad de Chile. Santiago, Chile.
- Escuela de Nutrición y Dietética. Facultad de Medicina. Universidad Finis Terrae. Santiago, Chile
- Instituto de Ciencias de la Salud. Universidad de O’Higgins. Rancagua, Chile.
- Instituto de Nutrición y Tecnología de
los Alimentos (INTA). Universidad de Chile.
Santiago, Chile.
+Igual contribución en autoría
*Correspondencia:
PhD. Francisco Pérez-Bravo. INTA. Universidad de Chile. Santiago, Chile.
E-mail: fperez@inta.uchile.cl
Financiamiento: FONDECYT 1130240
Recibido: 14-05-2021
Aceptado: 26-06-2021
Resumen: La diabetes Tipo 1 (DT1) es una compleja enfermedad autoinmune con una etiología aún desconocida. La vitamina D ha sido ampliamente estudiada debido a su potencial terapeútico en los potenciales nuevos casos de DT1. Por otra parte, los microARNs (miRs) han sido propuestos como posibles biomarcadores en diversos procesos biológicos como en la apoptosis e inflamación. El objetivo de este estudio fue evaluar el efecto de la suplementación con vitamina D sobre el perfil de expresión del miR-21 y marcadores de apoptosis tales como: BCL2, STAT3, TIPE2 y DAXX, en células mononucleares periféricas provenientes de pacientes con DT1 y sujetos controles. Resultados: El perfil de expresión de miR-21 se encontró disminuido en los pacientes con DT1 en comparación con los controles. La expresión relativa de BCL2 se encontró aumentada en controles al comparar con pacientes DT1 en todas las condiciones experimentales. La expresión relativa de DAXX mostró un perfil de expresión diferencial al comparar pacientes con DT1 versus controles (p=0.006). Conclusión: El estímulo con vitamina D parece tener un posible efecto regulador sobre los genes BCL2 y DAXX.
Palabras clave: Apoptosis; Diabetes tipo 1 (DT1); miR-21; Vitamina D.
Abstract: Type 1 diabetes (T1D) is a complex chronic autoimmune disease. Vitamin D has been one of the most studied therapeutic potential outbreaks related to T1D. Specific miRNAs have been proposed as potential biomarkers in several biological processes as apoptosis and inflammation. The aim of this study was to evaluate the effect of vitamin D on the expression profiles of miR-21 and apoptotic markers BCL2, STAT3, TIPE2 and DAXX, in PBMCs from T1D patients and control subjects. Results: miR-21 expression was increased in controls regarding T1D patients. BCL2 was increased in controls compared to T1D patients in all experimental conditions. DAXX showed different expression patterns between T1D patients and controls (p=0.006). Conclusion: Vitamin D showed a possible regulation effect on apoptosis markers mainly through the regulation of BCL2 and DAXX.
Keywords: Apoptosis; miR-21; Type 1 diabetes; Vitamin D.
La diabetes tipo 1 (DT1) es una enfermedad autoinmune donde se describe una destrucción selectiva y progresiva de las células beta pancreática1. La DT1 aparece principalmente en la niñez y la mayoría de los casos son diagnosticados antes de los 15 años de edad2. La desregulación inmune observada en los pacientes con DT1 se traduce en la infiltración de linfocitos T autorreactivos en las células beta pancreáticas, en un escenario complejo que involucra componentes genéticos, ambientales y epigenéticos3. Los microRNAs (miRs) son pequeñas moléculas de ARN de simple hebra no codificante (22-25 nucleótidos), cuya principal función es la regulación negativa de la expresión génica4. Los miRs pueden regular la expresión génica de diversos genes, y a su vez, un gen puede estar regulado por un conjunto de miRs5. En este contexto, los miRs son críticos para mantener la homeostasis y han sido asociados a múltiples patologías6.
El fenómeno de apoptosis es un proceso crítico que está involucrado en la destrucción de la célula beta pancreática, lo que facilita la presentación cruzada de antígenos de los islotes y a su vez, la activación de las células T7. Algunas de las proteínas involucradas en la vía intrínseca son BCL-2, BCLXL, BAX y Casp9, mientras que en la vía extrínseca se han descrito las proteínas FAS, TNFR1, DAXX y Casp8. Diversos estudios han descrito el rol de los mecanismos de apoptosis en enfermedades autoinmunes9.
Dentro de los miRs más estudiados, se encuentra el miR- 21 dado que tiene un rol clave en la proliferación y muerte celular10. miR-21 es capaz de suprimir la apoptosis inducida por IFN-γ, a través de un aumento en los niveles de STAT310. En DT1 se ha descrito que la expresión de miR-21 es capaz de proteger a células endoteliales de la citotoxicidad inducida por hiperglicemia, a través de la inhibición de DAXX11. En ratones B6, miR-21 puede regular negativamente la expresión de Tipe2 y NF-kB, inhibiendo la apoptosis de las células T activadas12.
La vitamina D está involucrada en la regulación de diversos componentes del sistema inmune, esta regulación permite la inhibición de la diferenciación y de esta forma, la maduración de las células dendríticas que conlleva a una menor capacidad de presentar antígenos13,14. Además, la vitamina D inhibe la síntesis, secreción y liberación de citoquinas anti-inflamatorias en las células Th1 y puede suprimir la producción de IL-17, lo que puede promover la tolerancia inmunitaria15. La vitamina D puede inhibir la señalización anti-apoptótica mediada por AKT, donde participan las proteínas STAT3, FAS, Bcl-2 y Tipe210,11,12,16,17. El objetivo de este estudio fue evaluar los niveles de expresión de miR-21, BCL2, DAXX, TIPE2 y STAT3 en células mononucleares periféricas de pacientes con DT1 y controles, y determinar el efecto de la estimulación con glucosa y vitamina D en los marcadores descritos.
Materiales y métodos
Participantes del estudio
Este estudió incluyó 12 niños (16,8 años ± 2,4) con DT1 provenientes del Instituto de Investigación Materno Infantil (IDIMI), del Hospital San Borja Arriarán en Santiago de Chile. Se obtuvo una muestra de 10 mL de sangre periférico y un cuestionario que registró los antecedentes clínicos y familiares de los pacientes con DT1. Los pacientes se encontraban en tratamiento con insulina de acción rápida y prolongada, al momento del estudio. Por otra parte, se reclutaron 12 sujetos controles sanos (grupo control: 33,8 años ± 5,8) sin historia familiar de diabetes u otras enfermedades autoinmunes. Todos los sujetos reclutados en este estudio firmaron un consentimiento u asentimiento informado, de acuerdo con los principios éticos para la investigación en humanos (Declaración de Helsinki), previamente aprobado por el Comité de Ética de la Universidad de Chile (IRB 050-2012).
Determinaciones séricas
Se determinaron los niveles de los auto-anticuerpos anti- GAD65, anti-IA-2 y anti-ZnT8, a través de ensayos de ELISA comerciales (Medizym® Diagnostic, Berlin, Germany). La evaluación de los marcadores inflamatorios IL-6, TNFα y vCAM se realizó a través de ensayos de ELISA comerciales de acuerdo con las instrucciones del fabricante (R&D Quantikine Human, UK). Finalmente, los niveles de 25-hidroxivitamina D (25(OH)2D3) fueron determinados a través de un inmunoensayo de quimioluminiscencia.
Cultivo celular
A partir de muestras de sangre total heparinizada, se aislaron células mononucleares periféricas (CMPs) utilizando una gradiente de densidad de Ficoll (Lymphocyte Separation Medium, density 1,077 g/mL, Cellgro) y posteriormente, fueron lavadas dos veces con medio de cultivo RPMI 1640 (Gibco-BRL, Grand Island, NY, USA). Las CMPs (1x106) fueron cultivadas en placas de 24 pocillos con medio RPMI 1640 suplementado con suero fetal de ternera al 10% (FCS), antibióticos y glucosa en dos concentraciones: basal (sin glucosa) e hiperglicemia (11 mM), como ha sido previamente descrito9, mientras que la estimulación con vitamina D fue realizada con 50 mM de 1,25 (OH)2D3. Todos los tratamientos se mantuvieron por 20 horas y en una atmósfera controlada de 5% CO2.
Ensayo de viabilidad celular
Para determinar la dosis de 1,25 (OH)2D3, se realizaron ensayos de viabilidad celular con MTT (Promega) siguiendo las instrucciones del fabricante. Brevemente, las CMPs fueron sembradas en placas de 96 pocillos e incubadas con 11 mM de glucosa por 12 horas. Posteriormente, las células fueron tratadas con 1,25 (OH)2D3 en las siguientes concentraciones: 0, 10, 30, 50 y 100 nM por 24 horas. Una vez transcurrido este tiempo, se adicionó en cada pocillo una alícuota de 100 mL de MTT (0,5 mg/mL). Para todos los ensayos de este estudio, se determinó a través de una curva de viabilidad que una concentración de 50 nM de 1,25 (OH)2D3 no afecta la sobrevida celular.
Extracción de ARN y expresión génica
Las células después de ser estimuladas con los distintos tratamientos fueron lavadas con PBS y almacenadas en TRIzol (Invitrogen) a -80 ºC, para su posterior procesamiento. Para la extracción de ARN (total y miRs), se siguió el protocolo de TRIzol de acuerdo con las instrucciones del fabricante. Posteriormente, el ARN fue cuantificado y a partir de 300 ng de ARN total, se realizó la transcripción reversa para obtener cADN utilizando un kit comercial (ImProm-IITM Reverse Transcriptase, Promega Corporation, Madison, USA). Para los análisis de expresión génica, se cuantificó la expresión de los siguientes genes: BCL2, STAT3, TIPE2 y DAXX, utilizando partidores específicos para cada gen (Tabla 1). Brevemente, la reacción de PCR se realizó en un volumen total de 20 mL, de los cuales 2 mL correspondieron al cADN, 10 mL de MasterMix SYBR Green II (Stratagene), 1 mL del mix de primers (250 nM) y 7 mL de agua libre de nucleasas. Para estudiar la expresión del miR- 21-5p, se realizó un PCR stem-loop RT (Applied Biosystems, Foster City, CA, USA), con sondas específicas TaqMan MGB, utilizando el master mix TaqMan Universal PCR Master Mix II (2x). Como control endógeno de la expresión de miARNs se utilizó el ARN pequeño RNU48. Todos los experimentos de expresión génica se realizaron en el equipo Agilent Mx3005P (Agilent Technologies, CA, USA equipment).
Análisis estadístico
Para el análisis de variables numéricas, se utilizaron test de Student o el test de Mann-Whitney, en función de la distribución de los datos. Para evaluar el efecto de los distintos tratamientos se realizó el test de Kruskal-Wallis seguido de un test post-hoc de Dunn. Para los análisis de expresión génica, se utilizó el programa REST (Relative Expression Software Tool). Todos los cálculos fueron realizados en el programa SPSS 15.0.1 (SPSS Inc, Chicago, IL) y GraphPad Prism 5 (GraphPad Software, Inc. San Diego CA, USA). Para todos los análisis, un valor de p>0,05 fue considerado estadísticamente significativo.
Resultados
Los datos clínicos, inmunológicos e inflamatorios en pacientes con DT1 y sujetos controles aparecen descritos en la tabla 2. Ambos grupos fueron comparables en todas las categorías excepto la edad, debido a que los sujetos controles no están pareados por edad para descartar la presencia de DT1. Se puede observar la presencia de auto-anticuerpos en DT1 (Anti-GAD65, Anti-IA2 y Anti-ZNT8) y no se encontraron diferencias significativas en los niveles de usPCR, TNF-α, IL-6 y vitamina D, al inicio del estudio.
Tabla 1. Secuencias de los partidores específicos.
Tabla 2. Parámetros clínicos, inmunológicos e inflamatorios en pacientes con DT1 y sujetos controles.
Para evaluar los niveles de expresión de miR-21 y de genes involucrados en la apoptosis en presencia distintos estímulos, se aislaron CMPs provenientes de pacientes con DM1 y sujetos controles y fueron cultivadas en presencia de glucosa y/o vitamina D. Se puede observar en condiciones basales que las CMPs provenientes de pacientes con DM1 presentan una expresión de miR-21 significativamente menor en comparación a los controles, sin embargo, este patrón de expresión no se modificó con los otros tratamientos (Figura 1). Al analizar la expresión de BCL2 se puede observar que basalmente existe una menor expresión génica en CMPs de pacientes con DT1 en comparación a los controles. Este patrón de expresión sólo se conserva de manera significativa cuando las células son estimuladas en conjunto con glucosa y vitamina D (Figura 2). Con respecto a la expresión de DAXX, se observa que, en ausencia de estímulo, los niveles de DAXX son menores en CMPs de pacientes con DT1 en comparación a los controles (Figura 3), además, la expresión relativa de DAXX no se modificó en los distintos tratamientos. Finalmente, al analizar la expresión relativa de STAT3 y TIPE2 no se encontraron diferencias significativas tanto en ausencia como en presencia de estímulo (Figura 4 y 5).
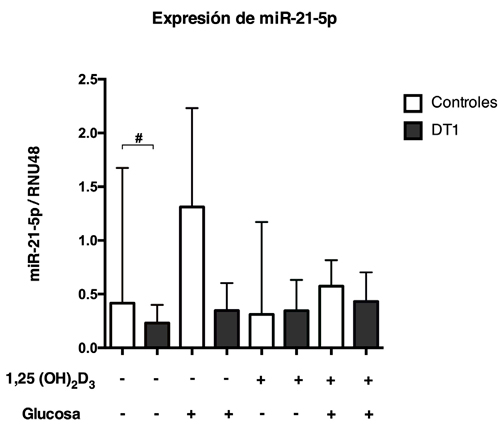
Figura 1: Expresión de miR-21-5p en CMP provenientes de pacientes con DT1 y sujetos controles (n=9-12/condición). # p>0,05; Mann-Whitney test. 1,25 (OH)2D3: 1,25 Dihidroxivitamina D.
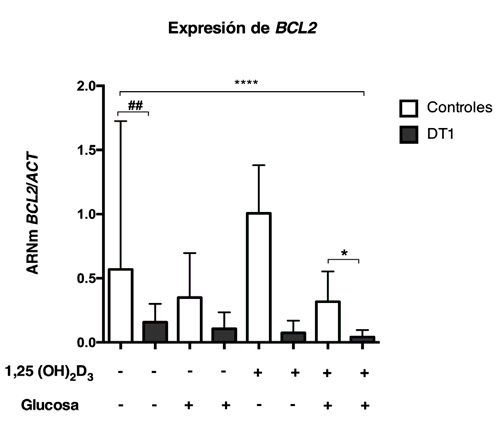
Figura 2: Expresión de Bcl2 en CMP provenientes de pacientes con DT1 y sujetos controles (n=9-12/condición). *p>0,05 Kruskal-Wallis y Post-hoc Dunn test; # p>0,05; 1,25 (OH)2D3: 1,25 Dihidroxivitamina D.
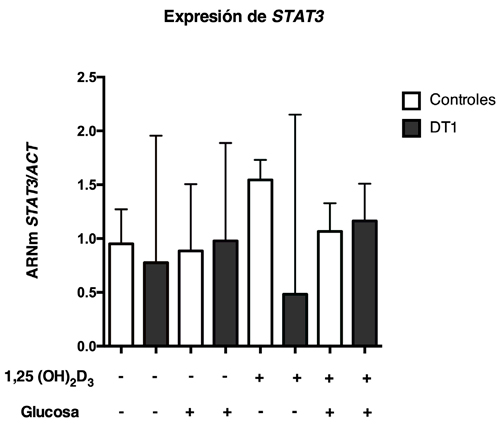
Figura 3: Expresión de DAXX en CMP provenientes de pacientes con DT1 y sujetos controles (n=9-12/condición). ** p>0,01; Kruskal-Wallis y Post-hoc Dunn test; # p>0,05; Mann-Whitney test. 1,25 (OH)2D3: 1,25 Dihidroxivitamina D.
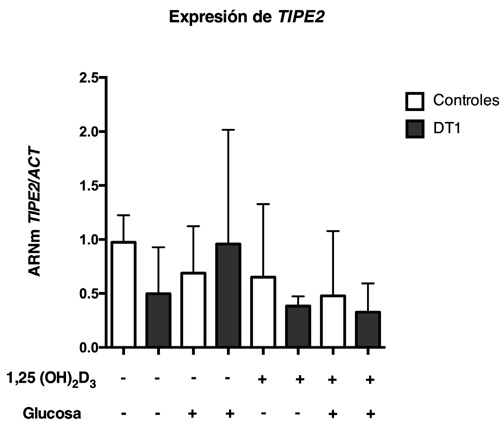
Figura 4: Expresión de STAT3 en CMP provenientes de pacientes con DT1 y sujetos controles (n=9-12/condición). 1,25 (OH)2D3: 1,25 Dihidroxivitamina D.
Discusión
La DT1 es una enfermedad autoinmune caracterizada por la destrucción de las células beta en los islotes pancreáticos de Langerhans por las células T diabetogénicas2,3. Se ha descrito previamente que las células T mueren en la periferia principalmente a través de la apoptosis, la cual puede ser activada a través de la vía mediada por el receptor de muerte celular (extrínseca) o mediada por la mitocondria (intrínseca), las cuales convergen en la en la activación de la Caspasa 38. El proceso de muerte celular sólo se producirá cuando existen mayores niveles de proteínas pro-apoptóticas que anti-apoptóticas8. Ha sido descrito que los factores ambientales pueden estar involucrados en el desarrollo de DT1, lo que permite identificar nuevos mecanismos asociados a la destrucción autoinmune de la célula beta18. Sin embargo, los mecanismos de destrucción de las células beta en la DT1 siguen siendo poco conocidos19.
En investigaciones previas hemos reportado en CMPs provenientes de pacientes con DT1 que existe una expresión diferencial de genes que codifican para las proteínas reguladoras de la apoptosis tales como BAD, BAX y XIAP, en comparación con sujetos controles9. En esta misma línea, hemos reportado la existencia de patrones diferenciales de expresión de diversos microARNs relacionados con DT1 y apoptosis, tales como miR-21, miR-93, miR-22 y miR-150, sugiriendo un rol en la regulación de las células T20,21.
En este estudio, evaluamos el posible efecto de la estimulación con vitamina D y glucosa en la expresión relativa de miR-21 y de genes apoptóticos en CMPs de pacientes DT1 y sujetos controles. Dentro de los principales resultados observamos que la expresión relativa de miR-21 se encuentra disminuida en pacientes DT1, en comparación a los controles. La función de miR-21 ha sido bien establecida en los fenómenos de cáncer e inflamación relacionados con STAT3 en células MCF-10a(22). Además, estudios en diabetes han demostrado un aumento de la expresión de miR-21 en células beta en respuesta a citoquinas inflamatorias23,24. Por otra parte, se ha reportado que la expresión de miR-21 puede ser inducida por inflamación o hiperglicemia, y que el uso de un estímulo antiinflamatorio como la vitamina D, podría estar relacionado con un efecto negativo sobre la sobreexpresión de miR-2125. A diferencia de los estudios en células beta o en suero de pacientes con DT1, en nuestro estudio realizado en CMPs se detectó una menor expresión de miR-21 como ha sido descrito previamente por nuestro grupo26. Las diferencias en los patrones de expresión para DT1 podrían estar asociadas al tipo celular utilizado, por lo que sería interesante estudiar cómo se correlaciona la expresión en el órgano blanco y en células circulantes como las CMPs. Al analizar la expresión génica de BCL2, que codifica para la proteína anti-apoptótica Bcl2, se observaron menores niveles en pacientes con DT1, en comparación con los controles. Ha sido descrito que miR-21 se relaciona con BCL2, incrementando la apoptosis en células beta humanas y de rata, a través de un mecanismo donde miR-21 reduce la estabilidad del ARNm de BCL2, explicando el fenotipo proapoptótico que presenta la célula beta17.
El análisis de la expresión del gen DAXX (Death domain-associated protein) muestra una menor expresión relativa en CMPs de pacientes con DM1. El gen DAXX, codifica para una proteína multifuncional que modula la muerte celular27. Varios estudios han indicado que DAXX es un mediador de la muerte de linfocitos y/o supresión del crecimiento y que DAXX interactúa con STAT311,28. Un estudio mostró que el miR-21 produce un efecto de pro-supervivencia en un ambiente con alto contenido de glucosa, probablemente por un efecto inhibidor sobre la expresión de DAXX en un modelo de células endoteliales11. De manera interesante, en nuestro estudio CMPs de sujetos controles tienen una mayor expresión relativa de DAXX que los pacientes DT1, pero no se observa un efecto inhibidor de la glucosa sobre el perfil de expresión de DAXX en PBMC.
En cuanto a la expresión génica de STAT3, no se observaron diferencias significativas en CMPs de pacientes con DT1. Sin embargo, se ha descrito previamente que la expresión de miR-21 regula al alza la expresión de STAT3 y que existe una regulación positiva de miR-21 en enfermedades inflamatorias como la psoriasis y la colitis ulcerosa17. Además, otros autores han descrito una alta actividad de STAT3 en la promoción de la proliferación celular e inhibición de la apoptosis celular29. De manera similar, no se encontraron diferencias en el patrón de expresión para el gen TIPE2 entre pacientes con DT1 y controles. Se ha reportado que Tipe2 está significativamente regulado a la baja en pacientes con enfermedades infecciosas o inflamatorias crónicas30. Sin embargo, un estudio demostró una posible asociación directa entre Tipe2 y miR-2112. En nuestro estudio, este posible efecto fue solo detectado en sujetos controles cuando se realizó un análisis de correlación.
En este trabajo se ha descrito un patrón de expresión diferencial para miR-21, BCL2 y DAXX en pacientes con DT1 y su modulación ante estímulos con glucosa y vitamina D. Sin embargo, debemos declarar las limitaciones debido a que se utilizaron CMPs que corresponden a células circulantes y no al órgano blanco. Por otra parte, existe una diferencia significativa en la edad de los pacientes respecto de los controles debido al diseño experimental que reclutó sujetos adultos para disminuir la variable riesgo de desarrollar DT1.
La vitamina D podría tener un efecto regulador en estos marcadores de apoptosis, a través de cambios en la expresión génica. Esta vitamina es un potente regulador de varios marcadores inmunológicos, y su relevancia en DT1 debe ser profundizada, de la misma forma que el miR-21 y su potencial como biomarcador en esta patología.
Agradecimientos: Los autores agradecen a todos los participantes en esta investigación por su cooperación.
Conflicto de interés: Ninguno
Referencias
- Buckner J, Nepom G. Obstacles and opportunities for targeting the effector T cell response in type 1 diabetes. Journal of Autoimmunity 2016; 71(7): 44-50.
- Van Belle T, Coppieters K, Von Herrath M. Type 1 diabetes: etiology, immunology, and therapeutic strategies. Physiol Rev 2011; 91(1): 79-118.
- Stankov K, Benc D, Draskovic D. Genetic and epigenetic factors in etiology of diabetes mellitus type 1. Pediatrics 2013; 132(6): 1112-1122.
- Ceribelli A, Satoh M, Chan E. MicroRNAs and autoimmunity. Current Opinion in Immunology 2012; 24(6): 686-691.
- Small E, Olson E. Pervasive roles of microRNAs in cardiovascular biology. Nature 2011; 469(7330): 336-342.
- Ha T-Y. MicroRNAs in Human Diseases: From Autoimmune Diseases to Skin, Psychiatric and Neurodegenerative Diseases. Immune Netw 2011; 11(5): 227-244.
- Atkinson M, Bluestone J, Eisenbarth G, Hebrok M, Herold K, Accili D et al. How does type 1 diabetes develop? The notion of homicide or β-cell suicide revisited. Diabetes 2011; 60(5): 1370-1379.
- Tomita T. Apoptosis of pancreatic β-cells in Type 1 diabetes. Bosnian Journal of Basic Medical Sciences 2017; 17(3): 183-193.
- Valencia E, Codner E, Salas-Pérez F, Pizarro C, Carrasco E, Arredondo M et al. High glucose concentration in T1D patients modulates apoptotic protein expression: Down regulation of BAX and FAS and up regulation of XIAP. Hum. Immunol 2012; 73(8): 801-804.
- Yang C, Yue J, Fan M, Pfeffer L. IFN induces miR-21 through a signal transducer and activator of transcription 3-dependent pathway as a suppressive negative feedback on IFN-induced apoptosis. Cancer Res 2010; 70(20): 8108-8116.
- Zeng J, Xiong Y, Li G, Liu M, He T, Tang Y, et al. MiR-21 is overexpressed in response to high glucose and protects endothelial cells from apoptosis. Exp. Clin. Endocrinol. Diabetes 2013; 121 (7): 425-430.
- Ruan Q, Wang P, Wang T, Qi J, Wei M, Wang S et al. MicroRNA-21 regulates T-cell apoptosis by directly targeting the tumor suppressor gene Tipe2. Cell Death Dis 2014; 5(2): e1095.
- Cooper J, Smyth D, Walker N, Stevens H, Burren O, Wallace C, et al. Inherited variation in vitamin D genes is associated with predisposition to autoimmune disease type 1 diabetes. Diabetes 2011; 60(5): 1624-1631.
- Hyppönen E, Läärä E, Reunanen A, Järvelin M, Virtanen S. Intake of vitamin D and risk of type 1 diabetes: A birth-cohort study. Lancet 2001; 358(9292): 1500-1503.
- Bivona G, Agnello L, Ciaccio M. The immunological implication of the new Vitamin D metabolism. Central European Journal of Immunology 2018; 43(3): 331-334.
- Deeb K, Trump D, Johnson C. Vitamin D signalling pathways in cancer: Potential for anticancer therapeutics. Nature Reviews Cancer 2007; 7(9): 684-700.
- Sims E, Lakhter A, Anderson-Baucum E, Kono T, Tong X, Evans-Molina C. MicroRNA 21 targets BCL2 mRNA to increase apoptosis in rat and human beta cells. Diabetologia 2017; 60(6): 1057-1065.
- Xia Y, Xie Z, Huang G, Zhou Z. Incidence and trend of type 1 diabetes and the underlying environmental determinants. Diabetes. Metab. Res. Rev 2019; 35(1): e3075.
- Wilcox N, Rui J, Hebrok M, Herold K. Life and death of β cells in Type 1 diabetes: A comprehensive review. Journal of Autoimmunity 2016; 71(7): 51-58.
- Salas-Pérez F, Codner E, Valencia E, Pizarro C, Carrasco E, Pérez-Bravo F. MicroRNAs miR-21a and miR-93 are down regulated in peripheral blood mononuclear cells (PBMCs) from patients with type 1 diabetes. Immunobiology 2013; 218(5): 733-737.
- Estrella S, Garcia-Diaz D, Codner E, Camacho-Guillén P, Pérez-Bravo F. Expresión de miR-22 y miR-150 en diabetes mellitus tipo 1: posible asociación con autoinmunidad y características clínicas de la enfermedad. Med. Clin. (Barc) 2016; 147(6): 245-247.
- . Iliopoulos D, Jaeger S, Hirsch H, Bulyk M, Struhl K. STAT3 Activation of miR-21 and miR-181b-1 via PTEN and CYLD Are Part of the Epigenetic Switch Linking Inflammation to Cancer. Mol. Cell 2010; 39(4): 493-506.
- Roggli E, Britan A, Gattesco S, Lin-Marq N, Abderrahmani A, Meda P, et al. Involvement of microRNAs in the cytotoxic effects exerted by proinflammatory cytokines on pancreatic β-cells. Diabetes 2010; 59(4): 978-986.
- Bravo-Egana V, Rosero S, Klein D, Jiang Z, Vargas N, Tsinoremas N et al. Inflammation-Mediated Regulation of MicroRNA Expression in Transplanted Pancreatic Islets. J. Transplant. 2012; 2012(5): 1-15.
- Backe M, Novotny G, Christensen D, Grunnet L, Mandrup-Poulsen T. Altering β-cell number through stable alteration of miR-21 and miR-34a expression. Islets 2014; 6(1): e27754.
- Salas-Pérez F, Codner E, Valencia E, Pizarro C, Carrasco E, Pérez-Bravo F. MicroRNAs miR-21a and miR-93 are down regulated in peripheral blood mononuclear cells (PBMCs) from patients with type 1 diabetes. Immunobiology 2013; 218(5): 733-737.
- Li J, Qian L, Dowling J, Curcione C, Kurup D, Zhang J. Daxx plays a novel role in T cell survival but is dispensable in Fas-induced apoptosis. PLoS One 2017; 12(3): e0174011.
- Matsuda T. Signal transducer and activator of transcription 3 regulation by novel binding partners. World J. Biol. Chem. 2015; 6(4): 324.
- Sonkoly E, Wei T, Janson P, Sääf A, Lundeberg L, Tengvall-Linder M, et al. MicroRNAs: Novel Regulators Involved in the Pathogenesis of Psoriasis? PLoS One 2007; 2(7): e610.
- Bordoloi D, Banik K, Shabnam B, Padmavathi G, Monisha J, Arfuso F, et al. TIPE family of proteins and its implications in different chronic diseases. International Journal of Molecular Sciences 2018; 19(10): 2974.