Evolución postparto a largo plazo de mujeres con diagnóstico de diabetes mellitus gestacional
María del Mar Fandiño1*, Victoria Alcázar2, Marina Bueno4, Concepción García3.
Long term postpartum evolution in gestational diabetes mellitus diagnosed women
- Servicio de Endocrinología y Nutrición, Hospital Severo Ochoa, Leganés, Madrid, España.
- Servicio de Endocrinología y Nutrición, Hospital Severo Ochoa, Leganés, Madrid, España.
- Servicio de Bioquímica, Hospital Severo Ochoa, Leganés, Madrid, España.
- Alumno de Medicina, Universidad Alfonso X el Sabio, Madrid, España.Médico cirujano general. Clínica Quirúrgica “A”. Hospital de Clínicas, Universidad de la República. Montevideo, Uruguay.
*Correspondencia: María del Mar Fandiño Garcia / mdmfandi@gmail.com Hospital Universitario Severo Ochoa, Avenida Orellana s/n CP: 28914, Leganés, Madrid.
Conflicto de intereses: No existe conflicto de intereses en este manuscrito.
Financiación: recursos propios, no hubo apoyo financiero.
Recibido: 22-06-2022. Aceptado: 12-08-2022.
Resumen: Resumen: Introducción: la diabetes mellitus gestacional (DMG) es una complicación común del embarazo siendo su prevalencia muy variable según la población estudiada y los criterios diagnósticos empleados. Sabemos que la DMG se asocia con un aumento de numerosas complicaciones a nivel materno-fetal, así como a un aumento del riesgo de DMG en futuros embarazos y de diabetes tipo 2 a largo plazo. Objetivos: nuestro objetivo es investigar de forma retrospectiva la evolución a largo plazo (9 años) de las 225 pacientes diagnosticadas de DMG en el Hospital Severo Ochoa en el año 2013 en el screening prenatal. Determinar la incidencia a largo plazo de alteración del metabolismo hidrocarbonado (AMH) y su relación con parámetros clínicos y bioquímicos en la gestación. Métodos: se ha realizado la revisión de Historias Clínicas informatizadas en el programa Selene y en papel del archivo hospitalario. Se han revisado las analíticas en los programas infinity/ Omega y la evolución en el programa Horus de Atención Primaria. Se ha revisado los tratamientos en el módulo de prescripción única (MUP). Conclusiones: la incidencia de AMH en nuestra serie a 9 años de seguimiento es del 22%. El porcentaje de screening postparto es bajo (41%). Los factores asociados independientemente con el desarrollo de AMH son la glucemia basal en el screening, la existencia de obesidad pregestacional y la aparición de trastornos hipertensivos durante la gestación.
Palabras clave: Diabetes gestacional; Gestación; Hipertensión; Síndrome metabólico.
Abstract: Introduction: gestational diabetes mellitus (GDM) is a common complication of pregnancies with a variable prevalence depending on the studied population and the diagnostic criteria used. We know that GDM is associated to numerous complications for the mother and the baby as well as a higher risk of GDM in future pregnancies and type 2 diabetes on the long term. Objective: our objective is to investigate retrospectively the long term (9 years) evolution of 225 patients diagnosed with GDM in the Hopital Severo Ochoa along 2013 in the prenatal screening. To determinate the long term incidence of hydrocarbonate metabolism alterations (HMA) and its relationship with clinical and biochemical parameters in the pregnancy. Methods: we have search the Medical Records computerized in the Selene program and in paper in the hospital Archives. The analyses in the programs Infinity and Omega have been reviewed as well as the clinical evolution in the Primary Care program Horus. The actual treatments have been searched in the Madrid system of electronical prescription (MUP). Conclusions: HMA incidence in our patients series is 22% at 9 years. After delivery the screening is low (41%). Basal glucose at screening during pregnancy, pregestational obesity and the ocurrence of hypertensive alterations during pregnancy were the independent factors associated to HMA at long term.
Keywords: Gestational diabetes; Gestation; Hypertension; Metabolic syndrome.
La diabetes mellitus gestacional (DMG) es una complicación común del embarazo, definida como la diabetes diagnosticada por primera vez en cualquier trimestre de la gestación en ausencia de una diabetes preexistente conocida1. Presenta una frecuencia muy variable según las características de la población estudiada y los criterios diagnósticos2.
La DMG se asocia con numerosas complicaciones maternofetales. Además, se asocia con un aumento de riesgo de DMG en futuros embarazos y de desarrollo de alteración del metabolismo hidrocarbonado (AMH)3,4.
Dicho riesgo se ha relacionado con las semanas de gestación a la que se diagnosticó la DMG, el grado de intolerancia en el test diagnóstico5, la necesidad de insulina durante la gestación y el tiempo desde el parto hasta el screening de diabetes. También se ha asociando con un aumento del riesgo de síndrome metabólico, hipertensión arterial y complicaciones cardiovasculares4,5,6,7.
Los criterios para el diagnóstico de la DMG han ido variando con los años, sin existir un criterio único estandarizado. Según la guía de la Sociedad Endocrina de Práctica Clínica y la Organización Mundial de la Salud (OMS) una glucemia basal en ayunas entre 92-125 mg/dl, o un valor a la hora de la sobrecarga oral de glucosa de 75 g ≥180 mg/dl o a las 2 horas ≥153 mg/dl en el primer trimestre diagnostican DMG8. Actualmente, en España se prefiere la estrategia diagnóstica en 2 pasos (test de O´Sullivan seguido de sobrecarga oral de 100 g de glucosa).
De esta manera, este trabajo está realizado con el objetivo primario de conocer la incidencia de AMH (diabetes y prediabetes) tras el parto a largo plazo de las pacientes diagnosticadas de DMG en el año 2013 en el Hospital Severo Ochoa (Leganés, Madrid).
Como objetivos secundarios hemos postulado:
- Conocer en qué porcentaje de pacientes se realiza el screening postparto.
- Ver en qué momento tras la gestación se realizó el mismo.
- Averiguar con qué factores clínicos se asoció la progresión a AMH.
Material y métodos
Se trata de un estudio retrospectivo del total de 225 pacientes diagnosticadas de DMG en el Hospital Severo Ochoa en el año 2013. Se han tenido en cuenta las pacientes diagnosticadas con el screening en dos pasos y aquellas que presentaban en el screening neonatal una glucemia ≥92 mg/dl. la revisión de las herramientas informáticas Horus de la Comunidad de Madrid y Selene.
Se han excluido las pacientes de las que no se disponía de datos.
Se consideró que la paciente no tenía DM 2 ni prediabetes, cuando no figuraba diagnosticada como tal ni en el sistema informático del hospital, ni en el de atención primaria, cuando las analíticas realizadas tras el parto no cumplían criterios de DM 2 ni prediabetes y cuando la paciente no llevaba tratamiento con fármacos antidiabéticos.
El registro de datos se realizó hasta febrero-marzo de 2022.
1. Variables
- Antecedentes familiares de DM 2.
- Datos demográficos: edad, peso en kg, talla en cm, IMC pregestacional (kg/m2), IMC ≤25 Kg/m2 o mayor, existencia de factores de riesgo para DMG (HTA, obesidad, macrosomía previa, DMG previa).
- Datos de diagnóstico de DMG: valores de glucemia basal, O‘Sullivan, SOG 100 g, SOG 75 g.
- Tratamiento durante la gestación: derivación a endocrinología, HbA1c en la gestación, tratamiento en la gestación (ninguno, dieta y ejercicio, insulina rápida, insulina lenta, ambas o metformina), dosis máxima de insulina.
- Complicaciones durante el embarazo: problemas obstétricos, preeclampsia, proteinuria/edemas, polihidramnios, prematuridad.
- Datos del parto: semanas de gestación, tipo de parto (eutócico, instrumental, cesárea, motivo de finalización (espontáneo, inducido, interrupción voluntaria del embarazo o aborto espontáneo), peso del recién nacido, macrosomía, causa del parto inducido.
- Datos del recién nacido: peso en gramos, presencia de macrosomía, necesidad de ingreso en neonatos y motivo de ingreso.
- Datos del postparto:
- Tipo de screening (curva 75 g, glucosa basal en
ayunas o glicada postparto)
- Meses tras el parto en que se realizó.
- Peticionario de la prueba (médico de atención
primaria, endocrinólogo, otros).
- Peso e IMC de la paciente en la primera visita
postparto.
- Diagnóstico en la primera visita postparto: normal, intolerancia o prediabetes, diabetes.
- Tipo de screening (curva 75 g, glucosa basal en
ayunas o glicada postparto)
- Diagnóstico de DM 2 o prediabetes en el primer año de seguimiento.
- Diagnóstico de alteración del metabolismo hidrocarbonadolo (DM 2 o prediabetes al final de seguimiento).
2. Pruebas estadísticas
- Estudio descriptivo de las variables.
- Estadística bivariada (chi cuadrado en variables cualitativa; t de Student en variables cuantitativas). En el caso de no cumplir la normalidad, se utilizó la prueba no paramétrica U de Mann-Whitney.
- Regresión logística binaria.
- Para el análisis de los datos se utilizó el paquete estadístico de IBM SPPS 21, considerando un nivel de significación estadística cuando p es <0,05.
- El estudio fue aprobado con fecha 29 de septiembre de 2021 por el Comité de Ética del Hospital Severo Ochoa.
Resultados
1. Diferencias entre las pacientes excluidas o no del estudio
De las 225 pacientes, 9 pacientes fueron excluidas por falta de datos en el seguimiento.
Existe una diferencia estadísticamente significativa en la derivación a Endocrinología durante el embarazo de forma que ninguna paciente de las excluidas por falta de seguimiento había sido derivada a Endocrinología durante la gestación.
Hemos encontrado una tendencia estadística a la ausencia de datos del parto en aquellas pacientes a las que no se siguieron tras el parto y por tanto fueron excluidas (11,1% vs 1,4%, p 0,08).
También se encontró una diferencia estadísticamente significativa entre la incidencia de macrosomía en las pacientes que continuaron seguimiento frente a las que no (7,7% vs 0% p <0,01).
2. Estadística descriptiva de las 214 pacientes incluidas en el estudio
- Datos demográficos La edad media fue 33,97 años ± 4,35. El 50,4% de las pacientes presentaban sobrepeso (un 30%) y obesidad (un 20,4%). Al diagnóstico encontramos un 3,4% de pacientes con hipertensión arterial y un 40,7% con factores de riesgo para DMG.
- Datos diagnósticos de diabetes gestacional El 83,5% de las pacientes presentaron una glucosa basal patológica (92 mg/dl). El test de O’Sullivan fue positivo en el 47,7% de las pacientes, confirmándose posteriormente el diagnóstico con la sobrecarga oral de 100 g de glucosa en un 22% y en un 16% (según criterios de Carpenter y Coustan y del National Diabetes Data Group respectivamente).
- Datos de gestación y parto Existió un 2,4% de abortos y únicamente una paciente con amenaza de aborto. Hubo un 12% de pacientes que presentaron problemas obstétricos (3,4% edema/ proteinuria, polihidramnios 2%, prematuros 16,2%). La semana de parto media fue 38±4, de los cuales fueron espontáneos el 60% e inducidos el 40%. Encontramos un 10,6% de partos instrumentales y un 29,3% de cesárea. Hubo un 7,8% de macrosomía y un 6,5% de fetos con crecimiento intrauterino retardado. Existió un 22,8% de recién nacidos que precisaron ingreso en neonatología.
- Datos del postparto
Tras el parto, se realizó analítica en el primer año a 89 pacientes (41,6%), con una media de 4,97 ± 3,18 meses. Al 58,4% de las pacientes con DMG no se le había realizado ningún estudio. Dentro del 41,6% estudiado, objetivamos que el 14,6% de las gestantes ya presentaban prediabetes y el 1,1% diabetes.
3. Datos a largo plazo
La media de tiempo a la que se realizó una analítica en el seguimiento fue de 19,38 ± 20 meses. Al final del seguimiento en un 22,9% de las pacientes encontramos AMH considerando los distintos criterios (18,2% prediabetes y 3,7% DM2).
4. Comparativa entre las pacientes que desarrollan AMH respecto a las que no al final del seguimiento
Tras realizar la comparación cualitativa y cuantitativa sólo se encontró una significación estadística en las variables expuestas en tabla 1.
5. Regresión logística
Las variables que adquirieron significación fueron la obesidad, la glucemia basal en el cribado como valor cuantitativo y la existencia de hipertensión, proteinuria o edemas en la gestación.
Tabla 1. Comparación entre pacientes con AMH y sin AMH al final del seguimiento
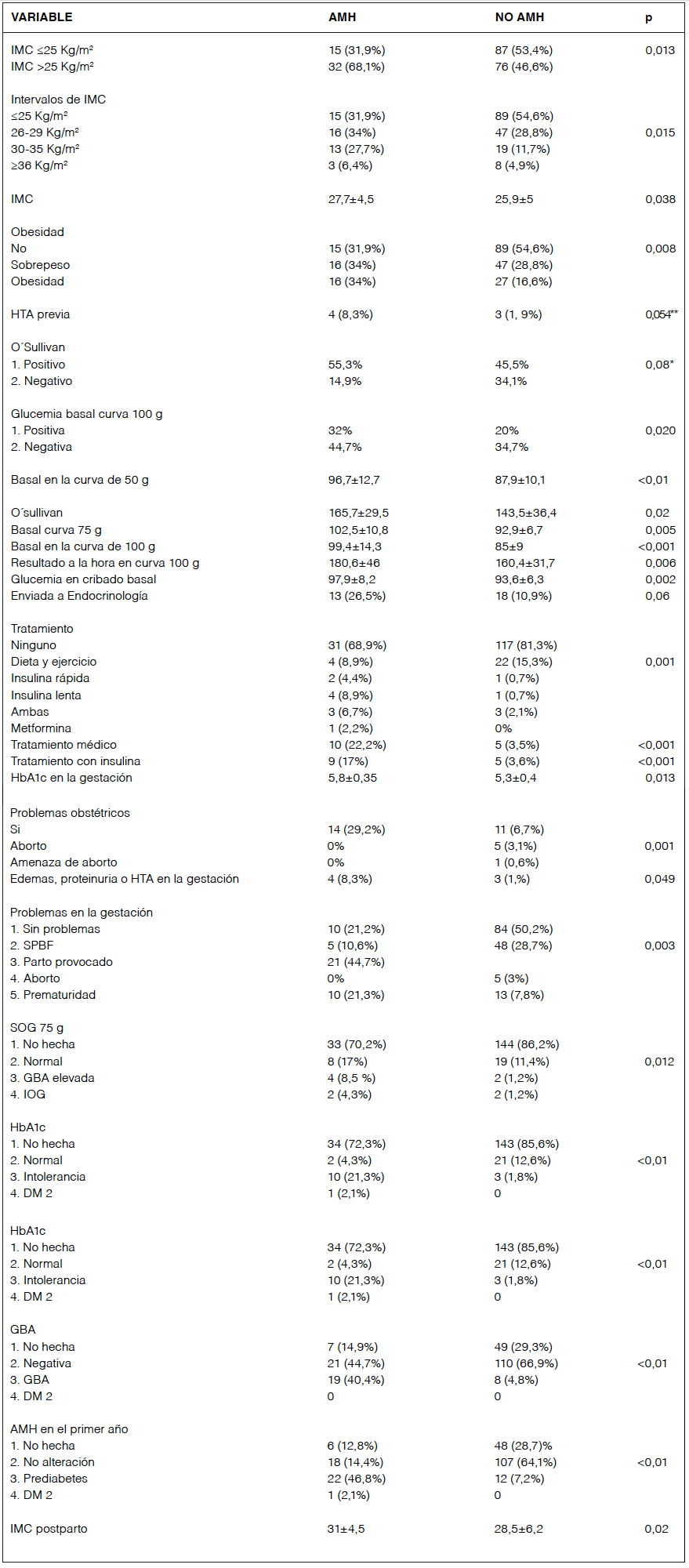
**Tendencia sin significación estadística. Las glucemias se expresan en mg/dl. IMC: índice de masa corporal. AMH: alteración del metabolismo hidrocarbonado. SPBF: sospecha de pérdida de bienestar fetal. SOG 75: Sobrecarga oral de glucosa de 75 g. GBA: glucemia basal alterada. IOG: intolerancia oral a la glucosa (glucemia a las 2 horas de la curva entre 140-200 mg/dl).
Discusión
- Pacientes excluidas: Las pacientes de las que no consta ningún seguimiento fueron excluidas del estudio. Dadas las diferencias encontradas entre las pacientes excluidas o no, podemos especular que las pacientes que tuvieron complicaciones en la gestación o que fueron derivadas a endocrinología, llevaron a cabo más seguimiento postparto que aquellas que no tuvieron complicaciones.
- Control en el primer año postparto:
La dificultad de seguimiento tras el parto en las pacientes
con DMG no es nada nuevo; los estudios postgestacionales
suelen estar limitados a los primeros 3-18 meses postparto
con pocos estudios de seguimiento a largo plazo.
En 2019, una revisión sistemática encontró una gran
disparidad en las tasas de control postparto. Esta
disparidad dependía de la raza, el nivel educacional,
las enfermedades mentales y el lugar de realización de
screening9,10.
Dentro de las pacientes de nuestra serie, hemos considerado no sólo a aquellas que tenían diagnóstico de DMG en dos pasos, sino también a aquellas que tenían una glucemia basal ≥92 mg/dl como consideran otras guías internacionales (IADPGS o OMS)11.
El bajo seguimiento postparto obtenido en nuestro estudio puede ser explicado porque en España no está aceptado oficialmente el diagnóstico de DMG según los criterios IADPSG, por lo que una glucemia basal ≥92 mg/dl en el primer trimestre no se considera patológica y por tanto las pacientes que sólo tenían una glucemia elevada en el screening neonatal no eran diagnosticadas de DMG. Entre las pacientes que se realizaron la SOG con 75 g en el primer año postparto, encontramos que un 4% tenían intolerancia hidrocarbonada, datos muy comparables a los de otros autores5. - Respecto al seguimiento a largo plazo:
De acuerdo con la bibliografía disponible, encontramos
una tasa de DM 2 del 20-50% a los 10 años en algunos
estudios12,13.
El estudio postparto a largo plazo en nuestra serie de pacientes se realizó en más de la mitad de la muestra. Se encontró una incidencia de AMH del 22% (18,2% prediabetes y 3,7% diabetes) similar a otros trabajos encontrados en la literatura15,16.
Respecto a los factores de riesgo para la aparición de AMH en el postparto, algunos estudios encuentran una relación con el tratamiento durante la gestación15,16. En nuestro trabajo, encontramos relación entre la necesidad de tratamiento farmacológico, especialmente insulina, con el desarrollo posterior de AMH. - Factores de riesgo independientes:
La obesidad, los valores de glucemia en la analítica basal y los estados hipertensivos en la gestación son los factores de riesgo independientes en nuestra serie para el desarrollo de AMH a largo plazo.
Vamos a analizar cada uno de estos factores de riesgo:
- La obesidad ha sido ampliamente asociada con el desarrollo de AMH en todos los estudios realizados, por lo que distintos autores postulan con la educación terapéutica durante y tras la gestación como medida contra el desarrollo futuro de resistencia a la insulina y síndrome metabólico a largo plazo15,16,17. Estos datos apoyan la realización de screening durante la gestación, especialmente en mujeres con obesidad.
- Cuando consideramos el aspecto de diagnóstico
analítico, la única variable que mantiene su significación
es la glucemia basal en el screening prenatal como
variable continua.
- Algunos autores postulan que la existencia en un
futuro de HTA y enfermedad cardiovascular pueden
predecirse por la aparición de DMG previa. Entienden
la DMG como una manifestación de una disfunción
metabólica más compleja, esperando una relación
con estados hipertensivos del embarazo18,19.
- Esta relación se ha encontrado así mismo a la inversa; es decir, las mujeres hipertensas presentan un aumento del riesgo de DMG. Esto se debe a que la HTA de la gestación está asociada a más resistencia a la insulina; y la resistencia a la insulina, de forma independiente al grado de obesidad, contribuye a la HTA en la gestación transitoria y tardía.
Conclusiones
La incidencia de AMH en nuestra serie es del 22% (18,2% prediabetes y 3,7% diabetes) a los 9 años de seguimiento.
El porcentaje de pacientes que se realiza screening postparto en el primer año es bajo (41%).
Los factores que encontramos relacionados de forma independiente con el desarrollo de AMH en el seguimiento son la glucemia basal en el screening gestacional como un continuo, la existencia de obesidad pregestacional y la aparición de trastornos hipertensivos durante la gestación.
Referencias
- Kjos SL, Buchanan TA. Gestational diabetes mellitus. N Engl J Med. 1999 Dec 2; 341(23): 1749-1756.
- Sweeting A, Wong J, Murphy HR, Ross GP. A clinical update on gestational diabetes mellitus. Endocr Rev. 2022 Jan 18: bnac003.
- Diabetes in pregnancy: Management from preconception to the postnatal period. London: National Institute for Health and Care Excellence (NICE); 2020 Dec 16.
- Sociedad Española de Ginecología y Obstetricia, Grupo español de diabetes y embarazo. Diabetes mellitus y embarazo. Guía de práctica clínica actualizada 2021. Prog Obstet Ginecol 2022; 65: 35-41.
- . Masuko N, Tanimura K, Kojima N, Imafuku H, Deguchi M, Okada Y, et al. Predictive factors for postpartum glucose intolerance in women with gestational diabetes mellitus. J Obstet Gynaecol Res. 2022 Mar; 48(3): 640-646.
- Kousta E, Kontogeorgi A, Robinson S, Johnston DG. Long-Term Metabolic Consequences in Patients with a History of Gestational Diabetes. Curr Pharm Des. 2020; 26(43): 5564-5572.
- López Del Val T, Alcázar Lázaro V, García Lacalle C, Torres Moreno B, Castillo Carbajal G, Alameda Fernandez B. Fasting glucose in the first trimester: An initial approach to diagnosis of gestational diabetes. Endocrinol Diabetes Nutr (Engl Ed). 2019 Jan; 66(1): 11-18.
- Jones EJ, Hernandez TL, Edmonds JK, Ferranti EP. Continued Disparities in Postpartum Follow-Up and Screening Among Women With Gestational Diabetes and Hypertensive Disorders of Pregnancy: A Systematic Review. J Perinat Neonatal Nurs. 2019 Apr/Jun; 33(2): 136-148.
- Jones EJ, Hernandez TL, Edmonds JK, Ferranti EP. Continued Disparities in Postpartum Follow-Up and Screening Among Women With Gestational Diabetes and Hypertensive Disorders of Pregnancy: A Systematic Review. J Perinat Neonatal Nurs. 2019 Apr/Jun; 33(2): 136-148.
- Corcoy R, Lumbreras B, Bartha JL, Ricart W. Nuevos criterios diagnósticos de diabetes mellitus gestacional a partir del estudio HAPO. ¿Son válidos en nuestro medio? Elsevier España. 2010; 361-363.
- Corcoy R, Lumbreras B, Bartha JL, Ricart W. Nuevos criterios diagnósticos de diabetes mellitus gestacional a partir del estudio HAPO. ¿Son válidos en nuestro medio? Gac Sanit. 2010; 24(4): 361-363. 1
- Hinkle SN, Bao W, Wu J, Sun Y, Ley SH, Tobias DK, et al. Association of Habitual Alcohol Consumption With Long-term Risk of Type 2 Diabetes Among Women With a History of Gestational Diabetes. JAMA Netw Open. 2021 Sep 1; 4(9): e2124669.
- Vounzoulaki E, Khunti K, Abner SC, Tan BK, Davies MJ, Gillies CL. Progression to type 2 diabetes in women with a known history of gestational diabetes: Systematic review and meta-analysis. BMJ. 2020 May 13; 369: m1361.
- Wei Y, Juan J, Su R, Song G, Chen X, Shan R, et al. Risk of gestational diabetes recurrence and the development of type 2 diabetes among women with a history of gestational diabetes and risk factors: a study among 18 clinical centers in China. Chin Med J (Engl). 2022 Mar 20; 135(6): 665-671.
- Nabi T, Rafiq N, Trigotra S, Mishra S. Clinical Characteristics, Outcomes, and Progression to Type 2 Diabetes in Women with Hyperglycemia in Pregnancy. Indian J Endocrinol Metab. 2021 Nov-Dec; 25(6): 538-544.
- Herrick CJ, Keller MR, Trolard AM, Cooper BP, Olsen MA, Colditz GA. Factors Associated With Postpartum Diabetes Screening in Women With Gestational Diabetes and Medicaid During Pregnancy. Am J Prev Med. 2021 Feb; 60(2): 222-231.
- Choi MJ, Choi J, Chung CW. Risk and Risk Factors for Postpartum Type 2 Diabetes Mellitus in Women with Gestational Diabetes: A Korean Nationwide Cohort Study. Endocrinol Metab (Seoul). 2022 Feb; 37(1): 112-123.
- Nicolaou V, Soepnel L, Huddle K, Klipstein-Grobusch K, Levitt NS, Norris SA. Cardiometabolic outcomes of women exposed to hyperglycaemia first detected in pregnancy at 3-6 years post-partum in an urban South African setting. PLoS One. 2022 Feb 9; 17(2): e0263529
- Carpenter MW. Gestational diabetes, pregnancy hypertension, and late vascular disease. Diabetes Care. 2007 Jul; 30 Suppl 2: S246-50.