Microcarcinoma papilar de tiroides: Vigilancia activa. Revisión de la bibliografía
Ulises Parada1*, Valentina Elicegui2, Carolina Guarneri1, Gabriela Mintegui3, Rubens Neirotti1.
Papillary thyroid microcarcinoma: Active surveillance. Literature review
- Cirujano. Círculo Católico de Obreros del Uruguay. Montevideo, Uruguay.
- Residente. Cirugía Círculo Católico de Obreros del Uruguay. Montevideo, Uruguay.
- Endocrinología y Metabolismo. Hospital de Clínicas. Montevideo, Uruguay.
*Correspondencia: Ulises Parada
ulisesparada@montevideo.com.uy
Recibido: 20-06-2023.
Aceptado: 21-08-2023.
Resumen: El cáncer de tiroides ha aumentado en incidencia, sin embargo, la mortalidad se mantiene estable. Muchas de estas lesiones son a expensas de un microcarcinoma papilar de tiroides definido por la OMS como aquel carcinoma papilar de tiroides que en su diámetro máximo no sobrepasa los 10 mm. El avance de la imagenología sobre todo la ecografía de alta resolución y el hallazgo en pieza de anatomía patológica por lesiones benignas son las principales causas del aumento en el diagnóstico de esta entidad. La vigilancia activa surge entonces como alternativa de manejo para pacientes portadores de microcarcinoma papilar con bajo riesgo de progresión, obteniendo resultados oncológicos comparables. Independiente de su tratamiento el pronóstico de estos pacientes es excelente con sobrevida cercana al 100% en 10 años. A pesar de lo dicho la morbilidad de las distintas opciones tera- péuticas es muy distinta. Será fundamental buscar elementos clínicos y paraclínicos que permitan tomar una decisión práctica, con el fin de determinar qué pacientes con microcarcinomas papilares que podrán entrar en un protocolo de vigilancia activa. Esta revisión pretende examinar la bibliografía publicada al respecto como alternativa de manejo, y su eventual aplicación en Uruguay.
Palabras clave: Microcarcinoma papilar de tiroides; Vigilancia activa.
Abstract: Thyroid cancer has increased in incidence; however, mortality remains stable. Many of these lesions are at the expense of papillary thyroid microcarcinoma defined by the WHO as papillary thyroid carcinoma that in its maximum diameter does not exceed 10 mm. The advance of imaging, especially high-resolution ultra- sound and the finding of benign lesions in pathological anatomy specimens are the main causes of the increase in the diagnosis of this entity. Active surveillance arises then as a management alternative for patients with papillary microcarcinoma with low risk of progression, obtaining comparable oncologic results. Regardless of their treatment, the prognosis of these patients is excellent with a survival rate close to 100% in 10 years. In spite of what has been said, the morbidity of the different thera- peutic options is very different. It will be essential to look for clinical and paraclinical elements that will allow making a practical decision, in order to determine which patients with papillary microcarcinomas will be able to enter an active surveillance protocol. This review aims to examine the literature published on this subject as a management alternative, and its eventual application in Uruguay.
Keywords: Active surveillance; Micro papillary carcinoma of the thyroid.
Introducción
El cáncer de tiroides ha aumentado en incidencia, sin embargo, la mortalidad se mantiene estable1,2. Muchas de estas lesiones son a expensas de un microcarcinoma papilar de tiroides (MCP), definido por la OMS como aquel carcinoma papilar de tiroides que en su diámetro máximo no sobrepasa los 10 mm3. Esta definición no toma en cuenta si se trata de tumores con compromiso locorregional, presencia de adenopatías, o metástasis a distancia.
La mayoría de los casos se presenta como un hallazgo incidental, tanto en pruebas diagnósticas por imagen o en los estudios anatomopatológicos de piezas quirúrgicas, llevados a cabo por indicación diferente a esta patología. En nuestro país, Mintegui et al.4 objetiva una incidencia de 4,2 casos al año de MCP, con tendencia al aumento en los últimos 40 años.
Se destaca que en un mismo término MCP se engloban 2 formas de presentación totalmente diferentes. Por un lado, al MCP indolente que no evoluciona al aumento de tamaño, ni progresión tumoral y por otro menos frecuentemente, al que se comporta de una manera más agresiva.
Estos tumores, han tenido a lo largo de la historia cambios en su tratamiento, que iban desde la tiroidectomía total con o sin vaciamientos linfáticos, yodo 131 complementario, a tratamientos menos agresivos como lobectomías.
La vigilancia activa (VA) surge como alternativa de manejo para grupos de bajo riesgo de progresión, con resultados oncológicos comparables. Consiste en aplicar por largo plazo, modalidades de diagnóstico periódicos y regulares, para evaluar los cambios en el estado de la enfermedad sin tratamiento hasta que la progresión de la misma resulte clínicamente evidente.
Independiente de su tratamiento el pronóstico de estos pacientes es excelente con sobrevida cercana al 100% en 10 años5. A pesar de lo dicho la morbilidad de las distintas opciones terapéuticas es muy distinta lo cual desarrollaremos a lo largo del texto. Esta revisión pretende examinar la bibliografía publicada acerca de la VA como alternativa de manejo, y su eventual aplicación en Uruguay.
Importancia del tema
El avance de la imagenología sobre todo la ecografía de alta resolución y el hallazgo en pieza de anatomía patológica por lesiones benignas son las principales causas del aumento en el diagnóstico del MCP1.
La realización de cirugía “innecesaria” aumenta la morbilidad. Las complicaciones no son frecuentes en centros especializados, con un número alto de pacientes. La lesión recurrencial, e hipoparatiroidismo definitivo ocurre en solo el 1%6. Sin embargo, en lugares donde la cirugía tiroidea es realizada no sólo por cirujanos dedicados a esta patología, (como podría ser el caso de algunos sectores de nuestro país) estas incidencias aumentan, alcanzando cifras de 5% en lesiones recurrenciales, y 20% en hipoparatiroidismo definitivo4.
El diagnóstico de MCP constituye un problema terapéutico que no termina con el estudio anatomopatológico, como sucede con el nódulo tiroideo mayor al centímetro. Si bien en el MCP la malignidad está determinada, el problema radica en diferenciar cuál será el que progresará y cuál no tendrá cambios o incluso desaparecerá.
En 1993, Miyauchi propuso observar, a pacientes de bajo riesgo (ampliaremos más adelante en el texto acerca de este importante concepto) en el Hospital de kuma Japón. Este programa de observación sin cirugía llegó más tarde a denominarse “vigilancia activa”. En 1995, el Instituto del Cáncer Hospital (CIH; Tokio) también inició un programa de seguimiento, para pacientes de bajo riesgo. Ambas instituciones han publicado datos prometedores utilizando grandes series de pacientes7.
Será fundamental buscar elementos clínicos y paraclínicos que permitan tomar una decisión práctica, con el fin de determinar qué pacientes con MCP podrán entrar en un protocolo de VA. Esto no implica bajo ningún concepto influir negativamente en la sobrevida de los pacientes sino todo lo contrario, disminuyendo los riesgos de la cirugía en MCP. Es conocido por estudios epidemiológicos que en su enorme mayoría no progresaron bajo seguimiento, y solo un 10 a 15% lo hará en los primeros 5 años8,9.
Diagnóstico y su marco actual
El MCP de tiroides en su mayoría se presenta de manera asintomática, detectados incidentalmente por imágenes ecográficas sospechosas y confirmados por la citología1. Solo un pequeño porcentaje presentan síntomas como disfonía, adenopatías palpables y más raro aún, elementos de diseminación a distancia.
Es importante indagar factores de riesgo como la historia familiar de cáncer de tiroides, y antecedentes de irradiación de cuello.
La presencia de síntomas es un pilar diagnóstico, además define la conducta y establece un pronóstico. Los pacientes con MCP sintomático con metástasis en ganglios linfáticos y/o el grupo con parálisis de cuerdas vocales mostraron una recurrencia del 30% y una tasa de 74,1% de supervivencia a los 10 años, mientras que las MCP asintomáticos presentaron tasas correspondientes al 3% de recidiva y el 100% sobrevida, respectivamente9. La ecografía es un estudio técnico dependiente, inocuo, accesible que permite ver lesiones de hasta 2-3 mm tiene sensibilidad y especificidad cercana al 100% para la detección de nódulos tiroideos1,10. La clasificación se hace de acuerdo TI RADS determinando el riesgo de malignidad del nódulo que va en una escala de I a VI. Las características que orientan a malignidad son: nódulo único, tamaño, microcalcificaciones, bordes irregulares, pérdida del halo, y presencia de vascularización central. Permite además de valorar la característica de la glándula tiroidea, topografiar el nódulo lo cual va a tener implicancias terapéuticas, así como valorar la presencia de adenopatías.
El avance de la tecnología médica y su fácil accesibilidad hace que aumente la identificación de los nódulos tiroideos en general y particularmente de los subcentimétricos8,11.
La ecografía tiroidea no está indicada como método de screening, ya que los nódulos tiroideos son frecuentes sin que ello implique necesariamente un tratamiento o tenga alguna implicación clínica. Por el contrario, genera ansiedad tanto en el médico como en el paciente12.
En la población mayor a 60 años la prevalencia de nódulos tiroideos es de 50-70% siendo malignos un 5 a 10%12. Frente al hallazgo ecográfico de un nódulo menor o igual a 1 cm. ¿Se debe puncionar?
En los menores de 5 mm las guías de la ATA recomiendan no puncionar por su escasa probabilidad de invasión locorregional y a distancia. Los nódulos entre 5 y 10 mm solo se puncionan si presentan elementos de sospecha ya mencionados (microcalcificaciones, bordes irregulares pérdida del halo, etc.13
La citología por punción aspiración con aguja fina (PAAF) confirma el diagnóstico de MCP. El sistema Bethesda establece 6 categorías que agrupan lesiones según su potencial de malignidad, donde la categoría VI corresponde a carcinoma, con riesgo de malignidad mayor al 95%10.
Elementos que orientan a malignidad en la citología son: formación de papilas, cuerpo de Psamomma, núcleos en ojos de la huérfana Annie y pseudo inclusiones citoplasmáticas. También podemos realizar la punción y citología de adenopatías sospechosas, así como el lavado de la aguja con identificación de tiroglobulina que nos permitan conocer el estatus ganglionar.
En Uruguay, se ha publicado un trabajo que demuestra una sensibilidad de 96% y especificidad de 98% en cuanto a rendimiento diagnóstico histopatológico del nódulo10.
Historia natural: características MCP
Miyauchi7, plantea como hipótesis que la mayoría MCP no crecen y los que lo hagan, será en forma lenta (meses o incluso años). Este planteo surge de la diferencia entre la incidencia MCP en autopsias y en estudios de cribado y la prevalencia de carcinoma de tiroides (mayor al centímetro) la cual es francamente menor. Especuló, que como solo una minoría crecería, un seguimiento atento, estricto, riguroso podría detectar los MCP que progresaron. La cirugía “de rescate” después de la detección de los signos de progresión de MCP, permitiría controlar el carcinoma sin afectar sobrevida, sabiendo que la cirugía inmediata podría resultar en más daños que beneficios14.
Si se piensa al cáncer tiroideo como una enfermedad evolutiva simplemente y siguiendo un razonamiento “lógico” (cualquier cáncer avanzado es por supuesto un pequeño cáncer al principio) los MCP serían en todos los casos enfermedades iniciales de carcinomas papilares, que, al ser diagnosticados en etapas más tempranas, su tratamiento quirúrgico precoz mejoraría su pronóstico. Sin embargo, esto no es aplicable debido a que la enorme mayoría de estos micro tumores no invade y más aún, ni siquiera aumentará de tamaño. Sabiendo esto: ¿sería necesaria entonces la cirugía inmediata a todos los pacientes?, conociendo varios estudios de grandes series que apoyan lo dicho5,14,15.
Ahora bien ¿Qué características tienen los MCP que hacen su historia natural tan particular? (Cáncer que no invade y no crece)
En cuanto a su crecimiento se sabe que a medida que aumentan de tamaño se van encapsulando y se produce cierta fibrosis y esclerosis en el nódulo que van limitando su crecimiento. Saber qué nódulo va crecer e invadir y cuál no cambiará de tamaño, es el gran reto de esta entidad. Hoy en día nos basamos en elementos clínicos, imagenológicos, citológicos y anatomopatológicos e incluso genéticos para definir su conducta. Se estima que la progresión de esta entidad bajo VA se observa entre un 1 a 15% según las series7. La no existencia hasta la fecha de un método de certeza evolutiva del MCP da nacimiento a la VA, la cual tiene un rol fundamental identificando pacientes de bajo riesgo, evitando cirugías innecesarias y su morbilidad, sin cambiar la recidiva ni la sobrevida de los pacientes16.
¿Qué elementos son tenidos en cuenta a la hora de tomar decisiones terapéuticas?
1. Clínica
Desde el punto de vista clínico sin lugar a duda la presencia de síntomas como disfonía o adenopatías orienta a una conducta quirúrgica. Debemos recordar cómo se planteó con anterioridad que la mayoría de estos pacientes son asintomáticos. Por tanto, este punto si bien puede ser determinante, son muy pocos los que se presentan sintomáticos, llevando a que impacte poco a la hora de determinar conductas en la mayoría de los MCP.
Otros factores importantes en la toma de decisiones son: edad menor de 40 años (presentan más riesgo de crecimiento) antecedentes personales de irradiación en cabeza y/o cuello, antecedentes familiares de cáncer papilar tiroideo.
2. Imagenología: Ecografía tiroidea
Como hemos señalado es el método imagenológico por excelencia para diagnóstico, seguimiento del nódulo y guía para punción. El aumento de tamaño, la topografía cercana al trayecto del nervio laríngeo recurrente (NLR) y la presencia de adenopatías sospechosas (que deben ser puncionadas y confirmadas) son elementos a favor de la cirugía. Por el contrario, la presencia de macrocalcificaciones, ausencia de modificaciones en el tamaño, topografía lejana al trayecto del NLR y sin adenopatías estaría a favor de la VA.
Otros métodos diagnósticos que pueden ayudar sobre todo en caso particulares son la tomografía computada y la resonancia nuclear magnética, para identificar la cercanía con NLR y la tráquea. Esta relación es importante ya que no serían los mejores candidatos para iniciar VA debido a que su crecimiento podría conllevar a una cirugía gravadas de mayor morbimortalidad (resección traqueal y/o NRL).
En la figura 1 se muestra a modo esquema como valorar el posible compromiso traqueal según el ángulo formado por el nódulo y la tráquea5.
3. Citología (PAAF)
¿Debe solicitarse a todos los pacientes con nódulos subcentimetricos? Si bien no existe un protocolo único de diagnóstico la recomendación de la ATA13 sugiere no puncionar nódulos menores o iguales a 5 milímetros. Esta conducta se debe a la muy baja probabilidad de invasión locorregional y a distancia de dichos nódulos en caso de ser MCP. Sin embargo, los mayores a 5 mm se puncionan en caso de tener sospecha por elementos clínicos e imagenológicos.
Existen elementos en la citología que alejan a la indicación de VA, como la presencia de variantes de mayor riesgo. Estos son: variante de células altas, (ya que se presentan en un porcentaje significativamente mayor de tumores multicéntricos y mayor tamaño tumoral) y esclerosante difusa (por presentar mayor índice de invasión extratiroidea y metástasis ganglionares locorregionales) El principal problema radica en que es difícil la sospecha y diagnóstico confirmatorio únicamente por PAAF7,17.
4. Marcadores moleculares
Si bien se cree que la respuesta a este problema está en un futuro en marcadores moleculares, actualmente no podemos predecir que MCP aumentará y dará metástasis y cuales no cambiarán, con elevado grado certeza.
De todas formas, es un elemento importante a tener en cuenta en la toma decisiones en aquellos centros que cuentan con los mismos. Conocemos marcadores asociados a mal pronóstico como Ki-67, mutación de gen BRAF, promotor TERT entre otros. En la actualidad, no se encuentran disponibles en todos los centros y su costo es elevado, con un bajo impacto a nivel de salud pública. Tanto es así que uno de los factores que influyen en el nacimiento de la VA es justamente no contar con marcadores disponibles que puedan predecir con certeza el crecimiento o no del MCP.
Manejo
De lo expuesto hasta el momento, podemos decir que la dificultad del manejo y la terapéutica no culmina demostrando la malignidad, sino determinar cuál de esos MCP tendrá potencial para invadir.
El tratamiento será manejado con equipo interdisciplinario con experiencia en patología tiroidea, fundamentalmente individualizado, teniendo en cuenta elementos a favor o en contra de cada opción terapéutica, según las características del paciente, del nódulo, y su evolución5.
Las diferentes guías (ATA, JAES)13,17 en las cuales no nos extenderemos dan lugar al manejo no operatorio bajo VA.
Para entrar en VA se tiene que cumplir con el concepto de MCP de bajo riesgo detallado en tabla 1.
La presencia de signos de progresión, que puede determinar un cambio en la conducta terapéutica frente al microcarcinoma tiroideo son: aumento de tamaño >3 mm o nódulo >12 mm y/o compromiso ganglionar o metástasis a distancia. La presencia de alguno de estos durante la vigilancia activa son elementos que llevan a suspender y optar por una conducta quirúrgica.
La figura 2, esquematiza el manejo de los MCP.
La multicentricidad tumoral y los antecedentes familiares del carcinoma de tiroides no son contraindicaciones para la VA. Se resume en la figura 3 el perfil ideal la misma.
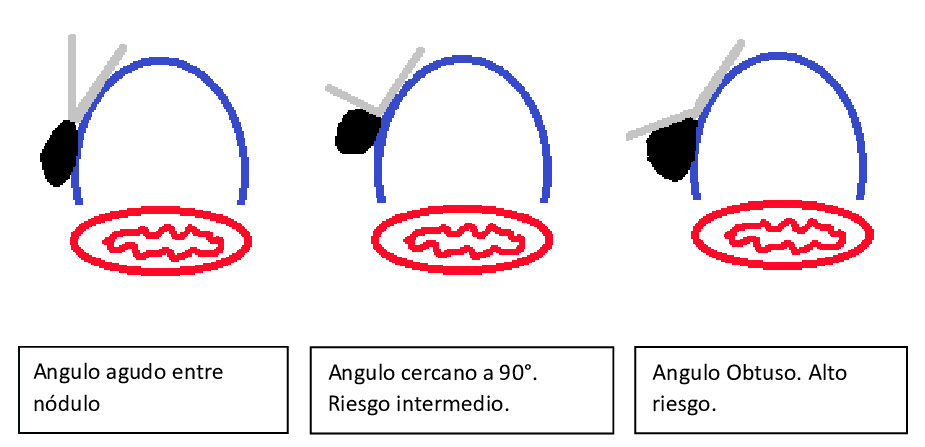 Figura 1: Perfil ideal VA.
Figura 1: Perfil ideal VA.
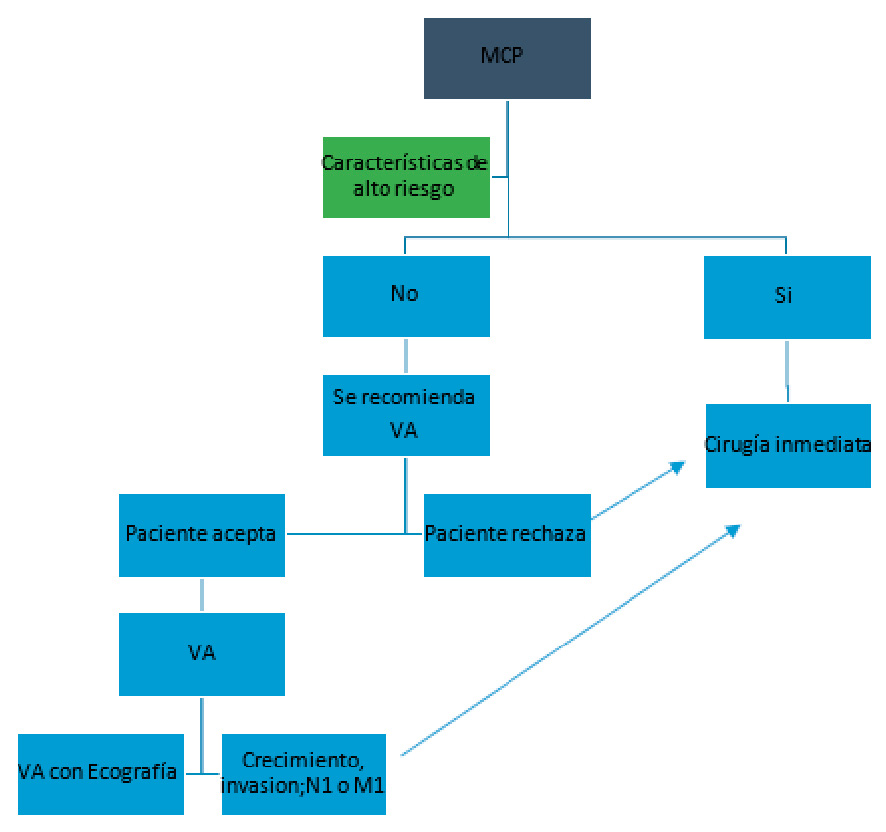 Figura 2: Algoritmo de manejo de MCP.
Figura 2: Algoritmo de manejo de MCP.
 Figura 3: Resumen, perfil ideal para plantear VA.
Figura 3: Resumen, perfil ideal para plantear VA.
Tabla 1. Evaluación del riesgo del MCP.
¿Qué condiciones debemos tener en cuenta para manejar a estos pacientes dando seguridad y confiabilidad?
1. Equipo interdisciplinario
Se debe contar con un equipo interdisciplinario dedicado a la patología tiroidea, formado por endocrinología, citología, laboratorio, cirugía general, imagenología, anatomía patológica, medicina nuclear, anestesia.
Los pacientes deben ser discutidos en forma integral abarcando todas las posibilidades diagnósticas y terapéuticas de cada una de las especialidades actuantes.
La VA también genera ansiedad en el médico tratante (responsabilidad, incertidumbre), por lo que el manejo en equipo interdisciplinario es fundamental para disminuirla, dando como resultado una mayor eficacia en la terapéutica.
2. Manejo individualizado
Cada tratamiento debe ser adaptado al paciente teniendo en cuenta los elementos a favor y en contra de la VA y de la cirugía inmediata (CI).
3. Selección de los pacientes
Los pacientes de bajo riesgo son los que podrán entrar en un plan de VA. Por el contrario, los pacientes de alto riesgo deben manejarse con CI.
4. Manejo de la información
La información debe ser lo más objetiva posible, estableciendo los pros y los contras de cada conducta. La comprensión de la enfermedad ayuda al paciente a calmar la ansiedad y mejora la adherencia al tratamiento.
5. Decisión del paciente
Es un punto clave. Los pacientes que no pueden tolerar la idea de tener una lesión con potencial invasivo en cierta medida “azaroso” puede que repercuta a tal punto que altere su calidad de vida. Estos pacientes no pueden ser manejados con VA, debido a su cancerofobia. En un artículo realizado en el 2019 en el Hospital de Clínicas de Buenos Aires, Argentina, se valora la VA en pacientes con MCP, fue aceptada solo por un 25% del total9.
6. Experto
Además del manejo en equipo interdisciplinario, cada uno de sus integrantes debe ser especializado en la patología tiroidea. De esta forma se le brinda al paciente una mayor solidez diagnóstica y terapéutica disminuyendo la morbimortalidad.
7. Seguimiento
Los pacientes que sean seleccionado para VA deben contar con una estructura de seguimiento institucional que facilite la adhesión al mismo, con acceso a la paraclínica y equipo tratante que permitan la rápida toma de decisiones.
Seguimiento clínico, pero sobre todo basado en la ecografía realizada seis meses después del diagnóstico y luego una vez al año8.
Si bien no existe un protocolo único, el mismo debe ser adaptado a cada paciente. El resto de exámenes paraclínicos surgirá de la propia evolución del paciente.
Conclusiones
Los datos apoyan que la vigilancia activa en los microcarcinomas papilar tiroideos de bajo riesgo debe ser la modalidad de gestión de primera línea.
Porque solo un pequeño porcentaje de bajo riesgo progresa (10-15%).
La cirugía de rescate después que se detectan signos de progresión no muestra una recurrencia significativa, ni cambios en la sobrevida.
Referencias
- Dideban S, Abdollahi A, Meysamie A, Sedghi S, Shahriari M. Thyroid papillary microcarcinoma: Etiology, clinical manifestations,diagnosis, follow-up, histopathology and prognosis. Iran J Pathol. invierno de 2016 (citado el 21 de abril de 2023); 11(1): 1-19. Disponible en: https://pubmed. ncbi.nlm.nih.gov/26870138/
- Tunca F, Sormaz İC, İşcan AY, Şenyürek YG. Surgical treatment in papillary thyroid microcarcinoma. SiSli Etfal Hastan Tip Bul / Med Bull Sisli Hosp. 2018 (citado el 21 de abril de 2023); 52(4): 244-248. Disponible en: http:// dx.doi.org/10.14744/SEMB.2018.45452
- Moon JH, Kim J-H, Lee EK, Lee KE, Kong SH, Kim YK, et al. Study protocol of multicenter prospective cohort study of active surveillance on papillary thyroid microcarcinoma (MAeSTro). Endocrinol Metab (Seoul). 2018 (citado el 21 de abril de 2023); 33(2): 278. Disponible en: https:// pubmed.ncbi.nlm.nih.gov/29947183/
- Mintegui G, Casamayou F, Arciénega C, Mendoza B, Ronco A. Caracterización de pacientes con microcarcinoma papilar de tiroides en el Hospital de Clínicas (UDELAR) en los últimos 10 años. Rev Med Urug (Montev). 2021 (citado el 21 de abril de 2023); 37(4). Disponible en: http:// www.scielo.edu.uy/scielo.php?pid=S1688-03902021000401204&script=sci_ arttext
- Oda H, Miyauchi A, Ito Y, Yoshioka K, Nakayama A, Sasai H, et al. Incidences of unfavorable events in the management of low-risk papillary microcarcinoma of the thyroid by active surveillance versus immediate surgery. Thyroid. 2016 (citado el 21 de abril de 2023); 26(1): 150-155. Disponible en: https://pubmed.ncbi.nlm.nih.gov/26426735/
- López F, García-Cabo P, Fernández-Vañes L, Coca-Pelaz A, Rodrigo JP, Llorente JL. Microcarcinoma papilar de la glándula tiroides: controversias y manejo actuales. Rev ORL. 2021 (citado el 21 de abril de 2023); 12(4): 325-340. Disponible en: https://scielo.isciii.es/scielo.php?script=sci_art text&pid=S2444-79862021000400005
- Sugitani I, Ito Y, Takeuchi D, Nakayama H, Masaki C, Shindo H, et al. Indications and strategy for active surveillance of adult low-risk papillary thyroid microcarcinoma: Consensus statements from the Japan Association of Endocrine Surgery task force on management for papillary thyroid microcarcinoma. Thyroid. 2021 (citado el 21 de abril de 2023); 31(2): 183-192. Disponible en: https://pubmed.ncbi.nlm.nih.gov/33023426
- Tuttle RM, Fagin JA, Minkowitz G, Wong RJ, Roman B, Patel S, et al. Natural history and tumor volume kinetics of papillary thyroid cancers during active surveillance. JAMA Otolaryngol Head Neck Surg. 2017 (citado el 21 de abril de 2023); 143(10): 015. Disponible en: https:// pubmed.ncbi.nlm.nih.gov/28859191/
- Smulever A, Pitoia F. Active surveillance in papillary thyroid carcinoma: not easily accepted but possible in Latin America. Arch Endocrinol Metab. 2019 (citado el 21 de abril de 2023); 63(5): 462-469. Disponible en: https://pubmed.ncbi.nlm.nih.gov/31482955/
- Guarneri C, Parada U, Fernández L, Taruselli R, Cazabán L. Rendimiento del Sistema Bethesda en el diagnóstico cito-patológico del nódulo tiroideo en un centro universitario (Hospital de clínicas) de Uruguay, diez años de experiencia. Rev Med Urug (Montev). 2022 (citado el 21 de abril de 2023); 38(2). Disponible en: http://www.scielo.edu.uy/scielo. php?pid=S1688-03902022000201207&script=sci_arttext&tlng=es
- Mehanna H, Al-Maqbili T, Carter B, Martin E, Campain N, Watkinson J, et al. Differences in the recurrence and mortality outcomes rates of incidental and nonincidental papillary thyroid microcarcinoma: A systematic review and meta-analysis of 21 329 person-years of follow-up. J Clin Endocrinol Metab. 2014 (citado el 21 de abril de 2023); 99(8): 2834-2843. Disponible en: https://pubmed.ncbi.nlm.nih.gov/24828487/
- Burman KD, Wartofsky L. CLINICAL PRACTICE. Thyroid nodules. N Engl J Med. 2015 (citado el 21 de abril de 2023); 373(24): 2347-2356. Disponible en: https://pubmed.ncbi.nlm.nih.gov/26650154/
- Haugen BRM, Alejandro EK, Biblia KC, et al. Pautas de manejo de la Asociación Americana de la Tiroides de 2015 para pacientes adultos con nódulos tiroideos y cáncer de tiroides diferenciado: Grupo de trabajo sobre nódulos tiroideos y cáncer de tiroides diferenciado de las pautas de la Asociación Americana de la Tiroides.Tiroides. 2016; 26(1): 1-133.
- Molinaro E, Campopiano MC, Pieruzzi L, Matrone A, Agate L, Bottici V, et al. Active surveillance in papillary thyroid microcarcinomas is feasible and safe: Experience at a single Italian center. J Clin Endocrinol Metab. 2020; 105(3): e172-e180. Disponible en: https://europepmc.org/article/ med/31652318
- Sanabria A, Kowalski LP, Shah JP, Nixon IJ, Angelos P, Williams MD, et al. Growing incidence of thyroid carcinoma in recent years: Factors underlying overdiagnosis. Head Neck. 2018 (citado el 21 de abril de 2023); 40(4): 855-866. Disponible en: https://pubmed.ncbi.nlm.nih.gov/29206325/
- Oh H-S, Ha J, Kim HI, Kim TH, Kim WG, Lim D-J, et al. Active surveillance of low-risk papillary thyroid microcarcinoma: A multi-center cohort study in Korea. Thyroid. 2018 (citado el 21 de abril de 2023); 28(12): 1587-1594. Disponible en: https://pubmed.ncbi.nlm.nih.gov/30226447/
- Takami H, Ito Y, Noguchi H (eds) 2010. Tratamiento del tumor tiroideo. Pautas clínicas japonesas. Springer, Tokio.