Influencia de la deficiencia de estradiol en la respuesta del receptor de mineralocorticoides en mujeres posmenopáusicas: Un estudio transversal
Alejandra Martínez-García1,3, Jorge A. Pérez1,3, Alejandra Tapia-Castillo1,2,3, María P. Hernández1,3, Marlin Solórzano1,3, Pablo Carrión1,3, Carlos E. Fardella1,2,3, Cristian A Carvajal1,2,3,*.
Influence of estradiol deficiency on the mineralocorticoid receptor
- Departamento de Endocrinología, Facultad de Medicina, Pontificia Universidad Católica de Chile.
- Instituto Milenio de Inmunología e Inmunoterapia (IMII), Facultad de Medicina, Pontificia Universidad Católica de Chile, Santiago, Chile.
- Centro Traslacional de Endocrinología (CETREN), Pontificia Universidad Católica de Chile, Santiago, Chile.
*Correspondencia:
Cristian A. Carvajal / ccarvaja@med.puc.cl
Departamento de Endocrinología, Facultad de Medicina. Pontificia Universidad Católica de Chile.
Diagonal Paraguay 362, 4° piso, Comuna de Santiago, 8330077, Santiago, Chile.
Declaración: Los autores declaran no tener conflictos de interés. Los autores Alejandra Martínez García y Jorge A. Pérez contribuyeron de igual manera en esta publicación.
Fuentes de financiamiento: Este trabajo fue apoyado por Proyecto SOCHED [2022-06]; ICM-ANID ICN2021_045, ANID-FONDECYT [1212006]; ANID-FONDECYT Postdoctoral [3200646].
Recibido: 08-04-2025.
Aceptado: 29-05-2025.
Resumen
Objetivo: Las mujeres en etapa premenopáusica (PreM) presentan una ventaja cardiovascular atribuida a la acción estrogénica. Sin embargo, la interacción entre el estrógeno y la vía del receptor de mineralocorticoides (MR) sigue siendo escasamente comprendida. Este estudio se propuso identificar alteraciones en los niveles de aldosterona, renina y esteroides sexuales, así como en biomarcadores indirectos de la actividad de MR en mujeres posmenopáusicas (PostM) que pudieran justificar cambios en la presión arterial y daño renal. Métodos: Se llevó a cabo un estudio transversal en 47 mujeres chilenas, tanto normotensas como hipertensas, clasificadas según su estado menopáusico. Se evaluaron parámetros clínicos, antropométricos y bioquímicos, incluyendo aldosterona, actividad de renina plasmática (ARP) y biomarcadores indirectos de la activación del MR. Resultados: Las mujeres PostM presentaron una presión arterial sistólica (PAS) significativamente más elevada (p<0.001) que las PreM. Se observó una correlación negativa entre los niveles de estradiol y la excreción fraccional de potasio (FEK) (ρ= –0.29; p= 0.023), ajustada por edad y PAS. En comparación con las PreM hipertensas (preM-HT), las PostM hipertensas (PostM-HT) mostraron una ARP reducida (p= 0.045) y un aumento en la FEK (p= 0.04). Las PostM normotensas (PostM-NT) presentaron mayores niveles de PAS (p= 0.03), lipocalina asociada a la gelatinasa de neutrófilos (NGAL) (p= 0.04) y FEK (p= 0.03) que las PreM-NT. Conclusión: Estos hallazgos sugieren una mayor sensibilidad del MR no sólo en las PostM-HT, como lo evidencian la disminución de la ARP y el incremento de la FEK, sino también en las PostM-NT, quienes mostraron FEK y NGAL elevados, biomarcadores indirectos de la activación del MR. Estos datos apoyan un rol novedoso de la activación mineralocorticoidea en el riesgo cardiovascular de las mujeres posmenopáusicas.
Palabras clave: Hipertensión; Menopausia; Estradiol; Mineralocorticoides.
Abstract
Premenopausal (PreM) women exhibit a cardiovascular protection largely attributed to
estrogenic action. However, the interaction between estrogen and the mineralocorticoid
receptor (MR) pathway remains poorly understood. Aim: This study aimed to identify
alteration in aldosterone, renin, and sex steroid levels, as well as in indirect biomarkers
of MR activity, in postmenopausal (PostM) women that could explain changes in blood
pressure and renal damage. Methods: A cross-sectional study was conducted in 47
Chilean women, both normotensive and hypertensive, stratified according to menopausal
status. Clinical, anthropometric, and biochemical parameters were assessed,
including aldosterone, plasma renin activity (PRA), and indirect biomarkers of MR
activation. Results: PostM women exhibited significantly higher systolic blood pressure
(SBP) (p < 0.001) compared with PreM women. A negative correlation was observed
between estradiol levels and fractional excretion of potassium (FEK) (ρ = –0.29; p =
0.023), adjusted for age and SBP. Compared with hypertensive PreM women (PreMHT),
hypertensive PostM women (PostM-HT) showed reduced PRA (p = 0.045) and
increased FEK (p = 0.04). Normotensive PostM women (PostM-NT) displayed higher
SBP (p = 0.03), neutrophil gelatinase-associated lipocalin (NGAL) (p = 0.04), and FEK
(p = 0.03) compared with normotensive PreM women (PreM-NT). Conclusion: These
findings suggest greater MR sensitivity not only in PostM-HT women, as evidenced by
decreased PRA and increased FEK, but also in PostM-NT women, who exhibited elevated
FEK and NGAL—both indirect biomarkers of MR activation. Collectively, these results
support a novel role for mineralocorticoid receptor activation in the cardiovascular
risk of postmenopausal women.
Keywords: Estradiol; Hypertension; Menopause; Mineralocorticoid.
Keywords: Estradiol; Hypertension; Menopause; Mineralocorticoid.
Introducción
En mujeres premenopáusicas (PreM), la acción de los estrógenos ejerce una reconocida función cardioprotectora. Por ello, la incidencia de hipertensión arterial, enfermedades cardiovasculares y renales es menor en PreM que en mujeres posmenopáusicas (PostM) o en varones de edad similar1,2. No obstante, esta protección se pierde tras la menopausia3. La incidencia ajustada de hipertensión en mujeres PostM es cuatro veces mayor que en PreM y un 20% más elevada que en los varones, lo que incrementa considerablemente su riesgo cardiovascular4,5,6,7. Diversos estudios han propuesto mecanismos subyacentes a este fenómeno, en los cuales destaca el sistema renina–angiotensina II–aldosterona (SRAA) como vía principal8,9,10,11.
Se ha demostrado que los estrógenos endógenos modulan la expresión y función de distintos componentes del SRAA3,9,12. En modelos experimentales, se ha observado que niveles normales de estradiol (E2) activan vías antiinflamatorias del SRAA, mientras que su deficiencia favorece rutas proinflamatorias8,9. Esta inflamación crónica de bajo grado y el estrés oxidativo aceleran la disfunción cardiovascular en mujeres PostM13,14,15.
Aunque se ha sugerido que la capacidad moduladora del E2 sobre el SRAA podría depender en parte de su efecto sobre la sensibilidad cardiovascular a la angiotensina II16,17, el conocimiento sobre la interacción entre estrógenos y la vía mineralocorticoidea sigue siendo limitado.
Estudios previos en modelos murinos han demostrado que, en condiciones fisiopatológicas, la activación del receptor de mineralocorticoides (MR) endotelial tiene un impacto más perjudicial en la función vascular de las mujeres que en los hombres18. Además, dado que la señalización del E2 y del MR se inhiben mutuamente, la reducción de los niveles de E2 favorece la activación crónica de la vía del MR, intensificando sus efectos cardiovasculares adversos en mujeres19,10. En este sentido, investigaciones recientes han mostrado que mientras los niveles de aldosterona y renina permanecen relativamente estables a lo largo de la vida en hombres, en mujeres posmenopáusicas (PostM) la actividad de la renina plasmática (ARP) disminuye, con cambios mínimos en los niveles de aldosterona, lo que resulta en índices de actividad de la renina y aldosterona (ARR) más elevados en comparación con mujeres premenopáusicas (PreM) y hombres de la misma edad21. Estas diferencias concuerdan con estudios in vivo e in vitro que sugieren mecanismos reguladores del sistema renina-angiotensina-aldosterona (RAAS) distintos entre ambos sexos10,12,20. Sin embargo, aún se desconoce el impacto del E2 en la interacción entre aldosterona y MR en humanos, especialmente en aspectos como la homeostasis hidroelectrolítica y la función renal.
Para profundizar en la comprensión de la fisiología femenina y el impacto del E2 en la salud cardiovascular de la mujer, resulta esencial examinar cómo su deficiencia tras la menopausia influye en la regulación de la presión arterial y en la actividad del receptor de mineralocorticoides. En este contexto, nuestro objetivo fue explorar un posible nuevo rol del MR en la posmenopausia, identificando alteraciones en los niveles de aldosterona, renina, esteroides sexuales y biomarcadores indirectos de la activación del MR, que pudieran contribuir a explicar las variaciones en la presión arterial y el daño renal observados en esta etapa.
Sujetos y Métodos
Se realizó un estudio transversal en una cohorte inicial de 394 mujeres seleccionadas de centros ambulatorios pertenecientes a la Red de Salud UC-Christus en Santiago, Chile. El protocolo fue aprobado por el Comité de Ética de la Facultad de Medicina de la Pontificia Universidad Católica de Chile (CEC-MEDUC 190823001114, 200619004 y 221122003), cumpliendo los principios de la Declaración de Helsinki.
El estudio incluyó mujeres normotensas e hipertensas, homogéneas en términos de nivel socioeconómico y etnicidad. Se excluyeron aquellas menores de 18 años, con un índice de masa corporal (IMC) superior a 30 kg/ m² o con antecedentes de enfermedades crónicas como nefropatías, insuficiencia cardíaca, hepatopatías crónicas o trastornos endocrinos.
Asimismo, se descartaron pacientes bajo tratamiento antihipertensivo que pudiese interferir con el SRAA (β-bloqueadores, inhibidores de la enzima convertidora de angiotensina, bloqueadores de receptores de angiotensina II o antagonistas del MR). Sólo se incluyeron mujeres tratadas con bloqueadores alfa o bloqueadores de canales de calcio, dada su baja influencia sobre el SRAA.
Se excluyeron además aquellas bajo terapia hormonal sustitutiva, uso de glucocorticoides, anticonceptivos orales, u otros fármacos que alteran la secreción de hormonas adrenales. También se excluyeron mujeres menores de 40 años con insuficiencia ovárica prematura (E2<50 pg/mL y FSH> 5 mUI/mL) o con menopausia precoz (<45 años y ≥ 1 año de amenorrea con E2<50 pg/mL y FSH>25 mUI/ mL). Dado el impacto conocido de la progesterona sobre el SRAA22, se excluyeron mujeres en fase lútea (progesterona > 3 ng/mL).
Tras aplicar estos criterios de exclusión, la muestra final consistió en 47 mujeres: 21 premenopáusicas en fase folicular (E2>50 pg/mL, FSH<25 mUI/mL) y 26 posmenopáusicas (E2 < 50 pg/mL, FSH>25 mUI/mL). Posteriormente, se estratificaron según su estatus hipertensivo: 11 PreM normotensas (PreM-NT), 11 PostM normotensas (PostM-NT), 14 PreM hipertensas (PreM-HT) y 15 PostM hipertensas (PostM-HT) (Figura 1).
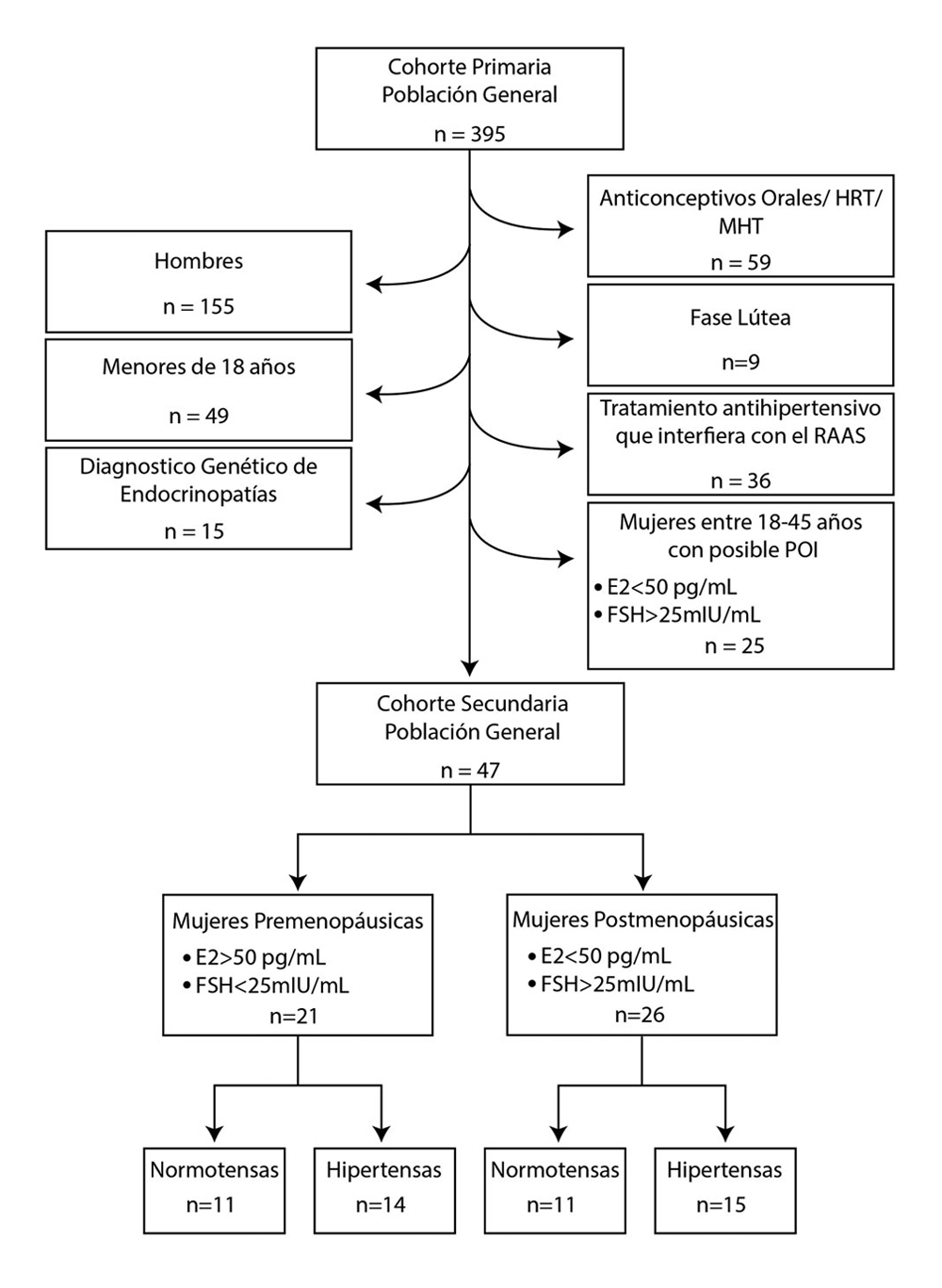
Evaluación clínica y antropométrica
Se recopiló información clínica a través de registros médicos que incluyeron historia clínica, examen físico y perfil bioquímico23,24,25. La presión arterial fue medida mediante un esfigmomanómetro oscilométrico (Dinamap Carescape V100; GE Healthcare, EE.UU.), realizando tres registros consecutivos de presión sistólica (PAS) y diastólica (PAD) en el brazo derecho, con intervalos de 5 minutos en posición sentada. La clasificación de normotensas e hipertensas se realizó siguiendo las directrices de la American Heart Association (AHA)25,26.
El peso corporal y la composición de masa grasa fueron determinados por bioimpedancia eléctrica (Tanita, EE.UU.).
Análisis bioquímicos
Se obtuvieron muestras sanguíneas basales entre las 8:00 y 10:00 h para la determinación de aldosterona y ARP, y posteriormente se calculó la relación aldosterona/ ARP (ARR). Las determinaciones de aldosterona y ARP se realizaron según protocolos previamente establecidos27.
Se solicitaron muestras de orina aislada y de 24 horas para la evaluación de creatinina, sodio, potasio y albúmina urinaria. La creatinina urinaria fue cuantificada mediante el método cinético colorimétrico de Jaffe (Modular Roche, Alemania).
Se calculó la excreción fraccional de sodio (FENa) y de potasio (FEK) en las muestras de 24 horas. La tasa de filtración glomerular estimada (TFGe) se calculó utilizando la ecuación MDRD-4. Las concentraciones séricas de FSH, hormona luteinizante (LH), E2, testosterona, progesterona y prolactina fueron determinadas por inmunoensayo de electroquimioluminiscencia (Cobas, Roche Diagnostics, Suiza).
Se midieron también los niveles séricos de NGAL mediante ELISA (DLcN20; R&D Systems, EE.UU.), la proteína C reactiva ultrasensible (PCR-us) mediante nefelometría (BN ProSpec®, Siemens, EE.UU.), y leptina por radioinmunoanálisis (Diasource, Bélgica).
Análisis estadístico
Las variables continuas fueron expresadas como mediana e intervalo intercuartílico [Q1–Q3], y las variables categóricas como porcentajes. La normalidad de los datos fue verificada mediante las pruebas de Shapiro–Wilk y Kolmogórov– Smirnov. Las variables categóricas se analizaron mediante chi-cuadrado y las comparaciones entre grupos con t de Student o U de Mann–Whitney, según correspondiera.
Resultados
La frecuencia de hipertensión fue similar entre las mujeres PostM (32%) y PreM (30%) (p= 0.97) (Tabla 1). No se observaron diferencias significativas en el índice de masa corporal (IMC) entre ambos grupos (p= 0.12); sin embargo, las mujeres PostM presentaron un mayor porcentaje de masa grasa (p= 0.03) y cifras más elevadas de PAS (p<0.001) en comparación con las PreM (Tabla 1).
Respecto a los parámetros bioquímicos, no se encontraron diferencias significativas en los niveles plasmáticos de aldosterona (p= 0.38), ARP (p= 0.9) ni en la relación ARR (p= 0.38) entre PostM y PreM. No obstante, las PostM presentaron niveles más elevados de sodio sérico (p= 0.024), albúmina urinaria (p= 0.04) y FEK (p= 0.003). Además, se evidenció una menor tasa de filtración glomerular estimada (TFGe) en las PostM (p= 0.03) (Tabla 1).
Al analizar la cohorte completa, se identificó una correlación negativa entre los niveles de E2 y la FEK (ρ= –0.29; p= 0.023), la cual se mantuvo significativa tras ajustar por edad y PAS.
Con el fin de determinar si la hipertensión era responsable de las diferencias observadas en las PostM, se realizó una subclasificación según estatus hipertensivo. Las mujeres PostM-HT mostraron cifras más altas de PAS (p= 0.025), sodio sérico (p= 0.045), albúmina urinaria (p= 0.04) y FEK (p= 0.04) en comparación con las PreM-HT. Además, presentaron una ARP reducida (p= 0.045), un menor TFGe (p= 0.035) y una excreción urinaria de sodio a 24 horas inferior (p= 0.03) respecto al grupo PreM-HT.
Por otra parte, las mujeres PostM-NT exhibieron mayores valores de PAS (p= 0.02), niveles séricos de NGAL (p= 0.02) y FEK (p= 0.033) que las PreM-NT, lo que refuerza la hipótesis de una mayor actividad mineralocorticoidea en la población posmenopáusica, incluso en ausencia de hipertensión (Figura 2).
Tabla 1. Características clínicas, antropométricas y bioquímicas de la población general de mujeres premenopáusicas y posmenopáusicas.
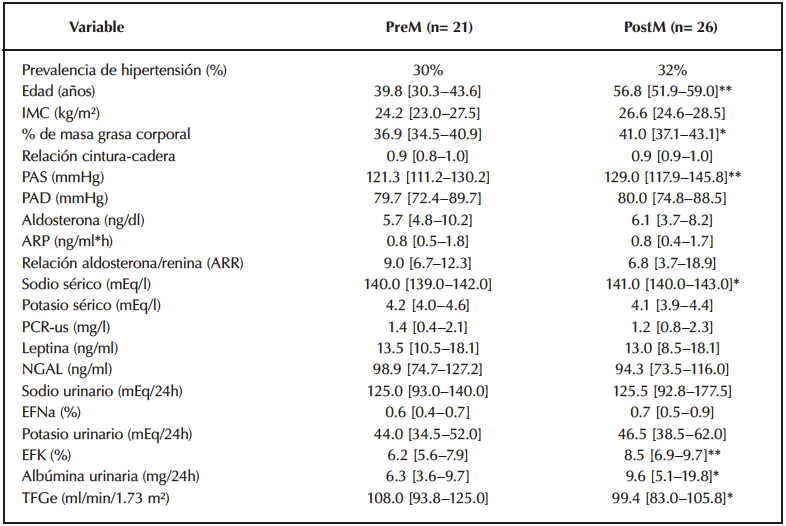
Datos expresados como mediana [Q1–Q3]. Comparaciones mediante t de Student o prueba de Mann–Whitney según la naturaleza de los datos. p < 0.05, ** p<0.001. PreM, mujeres premenopáusicas; PostM, mujeres posmenopáusicas; PAS, presión arterial sistólica; PAD, presión arterial diastólica; ARR, relación aldosterona/renina; ARP, actividad de renina plasmática; EFNa, excreción fraccional de sodio; EFK, excreción fraccional de potasio; NGAL, lipocalina asociada a gelatinasa de neutrófilos; PCR-us, proteína C reactiva ultrasensible; TFGe, tasa de filtración glomerular estimada.
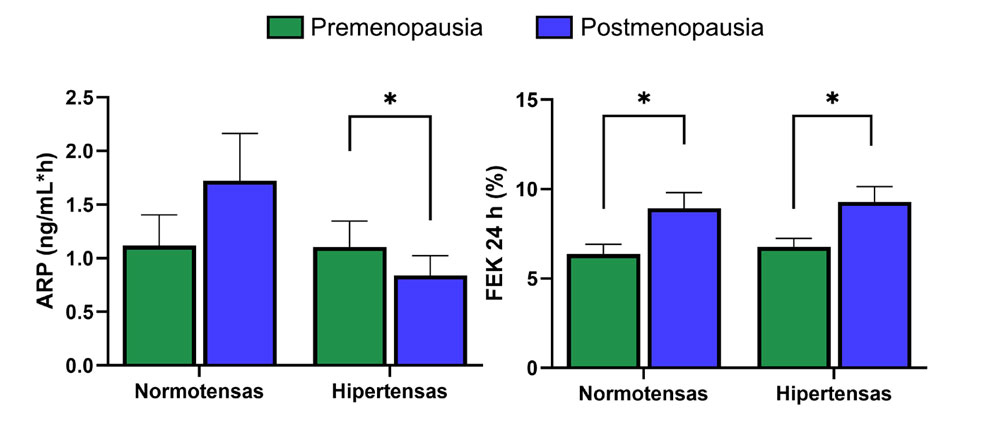 Figura 2: Determinación de la actividad
de renina plasmática (PRA) y la excreción
fraccional de potasio (FEK) en la cohorte del
estudio. Niveles de PRA y FEK en mujeres
premenopáusicas (PreM) y posmenopáusicas
(PostM) según el estado de presión arterial.
La comparación entre grupos se realizó
mediante la prueba de Mann-Whitney. Los
datos se presentan como mediana y rango
intercuartílico [Q1-Q3]. Un valor de p<0.05
se indica con (*).
Figura 2: Determinación de la actividad
de renina plasmática (PRA) y la excreción
fraccional de potasio (FEK) en la cohorte del
estudio. Niveles de PRA y FEK en mujeres
premenopáusicas (PreM) y posmenopáusicas
(PostM) según el estado de presión arterial.
La comparación entre grupos se realizó
mediante la prueba de Mann-Whitney. Los
datos se presentan como mediana y rango
intercuartílico [Q1-Q3]. Un valor de p<0.05
se indica con (*).
Tabla 2. Variables clínicas y bioquímicas en la población de mujeres premenopáusicas y posmenopáusicas según sean normotensas o hipertensas.
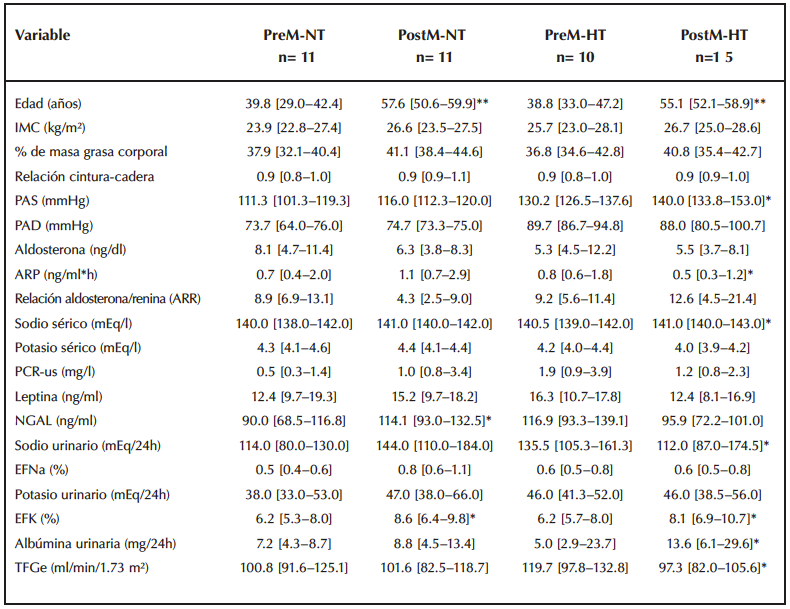
Datos expresados como mediana [Q1–Q3]. Comparaciones entre grupos mediante t de Student o U de Mann–Whitney según la naturaleza de los datos. p<0.05, ** p<0.001. PreM-NT, premenopáusicas normotensas; PostM-NT, posmenopáusicas normotensas; PreM-HTA, premenopáusicas hipertensas; PostM-HTA, posmenopáusicas hipertensas; PAS, presión arterial sistólica; PAD, presión arterial diastólica; ARP, actividad de renina plasmática; ARR, relación aldosterona/renina; EFNa, excreción fraccional de sodio; EFK, excreción fraccional de potasio; NGAL, lipocalina asociada a gelatinasa de neutrófilos; PCR-us, proteína C reactiva ultrasensible; TFGe, tasa de filtración glomerular estimada.
Discusión
El presente estudio transversal evidenció que las mujeres PostM-HT presentan un mayor FEK y una menor ARP que sus pares PreM-HT, a pesar de tener concentraciones similares de aldosterona. Asimismo, se observó que las PostM-NT presentaron niveles elevados de FEK y NGAL, ambos considerados marcadores indirectos de la activación del receptor de mineralocorticoides (MR). Estos hallazgos apuntan a una mayor sensibilidad o activación del MR en la etapa posmenopáusica20,28.
En el grupo PostM-HT se identificó una disminución de la ARP junto a un aumento de la FEK (Figura 2, Tabla 2), lo que sugiere una mayor respuesta renal al estímulo mineralocorticoideo. Esta exacerbada sensibilidad podría explicarse por la deficiencia de E2 característica de la posmenopausia, ya que estudios previos han demostrado que la activación del receptor de estrógenos alfa (ERα) inhibe la transcripción mediada por el MR. Además, se ha descrito que la señalización mediada por ERα y ERβ ejerce efectos opuestos sobre la actividad no genómica del MR19,29.
Llama la atención que, aunque la reducción de E2 fue similar entre las mujeres PostM-NT y PostM-HT, sólo las PostM-HT mostraron una ARP significativamente menor (Figura 2, Tabla 2). Una posible explicación es la participación de factores adicionales, como la activación de la proteína RAC1, la cual ha sido vinculada a la modulación de la sensibilidad del MR30,31. Adicionalmente, observamos una asociación negativa entre los niveles de E2 y la FEK en la cohorte estudiada. Sin embargo, serán necesarios estudios adicionales para confirmar esta hipótesis.
Por otro lado, la menor TFGe observada en las mujeres PostM-HT podría estar relacionada con un proceso de daño renal crónico asociado a la activación sostenida del MR, un fenómeno bien documentado en la literatura32,33.
En el grupo PostM-NT, el aumento de NGAL y FEK podría representar una fase inicial de disfunción mineralocorticoidea previa a la aparición de hipertensión o a la disminución de la ARP. Hallazgos similares han sido reportados en otras condiciones endocrinas, como el síndrome aparente de exceso mineralocorticoideo no clásico, donde la ARP no resulta un biomarcador eficaz en etapas tempranas de la enfermedad34.
Cabe destacar que no se observaron diferencias en la relación cintura-cadera ni en los niveles de leptina entre PreM y PostM, aun considerando su clasificación según hipertensión (Tabla 1 y 2). Esto es relevante, ya que el aumento de la adiposidad central posmenopáusica ha sido previamente asociado a niveles elevados de aldosterona35, hecho que no se evidenció en nuestra cohorte, posiblemente debido al perfil antropométrico homogéneo y la exclusión de pacientes obesas (Tablas 1 y 2).
Por último, los valores bajos y similares de proteína C reactiva ultrasensible (PCR-us) entre ambos grupos sugieren que la inflamación sistémica de bajo grado no influyó de manera significativa en los resultados de esta muestra.
Un aspecto destacable de este estudio es la inclusión exclusiva de mujeres PreM en fase folicular, evitando la confusión que podría generar la progesterona elevada durante la fase lútea, dado su conocido efecto antagonista sobre el MR y su capacidad para elevar la aldosterona36. En este trabajo identificamos que las mujeres PostM, tanto normotensas como hipertensas, presentan una mayor sensibilidad al receptor de mineralocorticoides (MR), reflejada en el incremento de la excreción fraccional de potasio y de los niveles de NGAL, aun en presencia de concentraciones de aldosterona similares a las observadas en mujeres premenopáusicas.
Además, la correlación negativa entre los niveles de E2 y la FEK, independiente de la edad y la presión arterial, refuerza la hipótesis que la deficiencia de estrógenos en la posmenopausia podría potenciar la actividad del MR, lo que contribuiría al aumento del riesgo cardiovascular en esta población.
Nuestros hallazgos aportan nueva evidencia sobre el papel del MR en la fisiopatología de la hipertensión y el daño renal en mujeres posmenopáusicas, y subrayan la importancia de considerar el estado hormonal en la evaluación del riesgo cardiovascular femenino.
Referencias
- Pilote L, Dasgupta K, Guru V, Humphries KH, McGrath J, Norris C, et al. A comprehensive view of sex-specific issues related to cardiovascular disease. CMAJ: Canadian Medical Association journal= journal de l’Association medicale canadienne. 2007; 176(6): S1-S44.
- Colafella KMM, Denton KM. Sex-specific differences in hypertension and associated cardiovascular disease. Nat Rev Nephrol. 2018; 14(3): 185-201.
- Novella S, Perez-Cremades D, Mompeon A, Hermenegildo C. Mechanisms underlying the influence of oestrogen on cardiovascular physiology in women. J Physiol. 2019; 597(19): 4873-4886.
- Benjamin EJ, Blaha MJ, Chiuve SE, Cushman M, Das SR, Deo R, et al. Heart Disease and Stroke Statistics-2017 Update: A Report From the American Heart Association. Circulation. 2017; 135(10): e146-e603.
- Mehta LS, Beckie TM, DeVon HA, Grines CL, Krumholz HM, Johnson MN, et al. Acute Myocardial Infarction in Women: A Scientific Statement From the American Heart Association. Circulation. 2016; 133(9): 916-947.
- Ji H, Kim A, Ebinger JE, Niiranen TJ, Claggett BL, Bairey Merz CN, et al. Sex Differences in Blood Pressure Trajectories Over the Life Course. JAMA Cardiol. 2020; 5(3): 19-26.
- Drury ER, Wu J, Gigliotti JC, Le TH. Sex differences in blood pressure regulation and hypertension: Renal, hemodynamic, and hormonal mechanisms. Physiol Rev. 2024; 104(1): 199-251.
- Gersh FL, O’Keefe JH, Lavie CJ, Henry BM. The Renin-Angiotensin- Aldosterone System in Postmenopausal Women: The Promise of Hormone Therapy. Mayo Clin Proc. 2021; 96(12): 3130-3141.
- Medina D, Mehay D, Arnold AC. Sex differences in cardiovascular actions of the renin-angiotensin system. Clin Auton Res. 2020; 30(5): 393-408.
- White MC, Fleeman R, Arnold AC. Sex differences in the metabolic effects of the renin-angiotensin system. Biol Sex Differ. 2019; 10(1): 31.
- Rossi GP, Caroccia B, Seccia TM. Role of estrogen receptors in modulating aldosterone biosynthesis and blood pressure. Steroids. 2019; 152: 108486.
- Wolter NL, Jaffe IZ. Emerging vascular cell-specific roles for mineralocorticoid receptor: Implications for understanding sex differences in cardiovascular disease. American journal of physiology Cell physiology. 2023; 324(1): C193-C204.
- Zitnanova I, Rakovan M, Paduchova Z, Dvorakova M, Andrezalova L, Muchova J, et al. Oxidative stress in women with perimenopausal symptoms. Menopause. 2011; 18(11): 1249-1255.
- Xue B, Johnson AK, Hay M. Sex differences in angiotensin II- and aldosterone-induced hypertension: The central protective effects of estrogen. Am J Physiol Regul Integr Comp Physiol. 2013; 305(5): R459-R463.
- McCarthy M, Raval AP. The peri-menopause in a woman’s life: A systemic inflammatory phase that enables later neurodegenerative disease. J Neuroinflammation. 2020; 17(1): 317.
- Nickenig G, Baumer AT, Grohe C, Kahlert S, Strehlow K, Rosenkranz S, et al. Estrogen modulates AT1 receptor gene expression in vitro and in vivo. Circulation. 1998; 97(22): 2197-2201.
- Barsha G, Mirabito Colafella KM, Walton SL, Gaspari TA, Spizzo I, Pinar AA, et al. In Aged Females, the Enhanced Pressor Response to Angiotensin II Is Attenuated By Estrogen Replacement via an Angiotensin Type 2 Receptor-Mediated Mechanism. Hypertension. 2021; 78(1): 128-137.
- Davel AP, Lu Q, Moss ME, Rao S, Anwar IJ, DuPont JJ, et al. Sex- Specific Mechanisms of Resistance Vessel Endothelial Dysfunction Induced by Cardiometabolic Risk Factors. J Am Heart Assoc. 2018; 7(4).
- Barrett Mueller K, Lu Q, Mohammad NN, Luu V, McCurley A, Williams GH, et al. Estrogen receptor inhibits mineralocorticoid receptor transcriptional regulatory function. Endocrinology. 2014; 155(11): 4461-4472.
- Biwer LA, Carvajal BV, Lu Q, Man JJ, Jaffe IZ. Mineralocorticoid and Estrogen Receptors in Endothelial Cells Coordinately Regulate Microvascular Function in Obese Female Mice. Hypertension. 2021; 77(6): 2117-2126.
- Solanki P, Gwini SM, Doery JCG, Choy KW, Shen J, Young MJ, et al. Age- and sex-specific reference ranges are needed for the aldosterone/renin ratio. Clin Endocrinol (Oxf). 2020; 93(3): 221-228.
- Szmuilowicz ED, Adler GK, Williams JS, Green DE, Yao TM, Hopkins PN, et al. Relationship between aldosterone and progesterone in the human menstrual cycle. J Clin Endocrinol Metab. 2006; 91(10): 3981-3987.
- Carvajal CA, Tapia-Castillo A, Pérez JA, Fardella CE. Serum Alpha- 1-Acid Glycoprotein-1 and Urinary Extracellular Vesicle miR-21-5p as Potential Biomarkers of Primary Aldosteronism. Front Immunol. 2021; 12: 768734.
- Barros ER, Rigalli JP, Tapia-Castillo A, Vecchiola A, Young MJ, Hoenderop JGH, et al. Proteomic profile of urinary extracellular vesicles identifies AGP1 as a potential biomarker of primary aldosteronism. Endocrinology. 2021.
- Tapia-Castillo A, Baudrand R, Vaidya A, Campino C, Allende F, Valdivia C, et al. Clinical, Biochemical, and Genetic Characteristics of “Nonclassic” Apparent Mineralocorticoid Excess Syndrome. J Clin Endocrinol Metab. 2019; 104(2): 595-603.
- Whelton PK, Carey RM, Aronow WS, Casey DE, Jr., Collins KJ, Dennison Himmelfarb C, et al. 2017 ACC/AHA/AAPA/ABC/ACPM/ AGS/APhA/ASH/ASPC/NMA/PCNA Guideline for the Prevention, Detection, Evaluation, and Management of High Blood Pressure in Adults: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Hypertension. 2018; 71(6): e13-e115.
- Campino C, Martinez-Aguayo A, Baudrand R, Carvajal CA, Aglony M, Garcia H, et al. Age-related changes in 11beta-hydroxysteroid dehydrogenase type 2 activity in normotensive subjects. Am J Hypertens. 2013; 26(4): 481-487.
- Coutinho P, Vega C, Pojoga LH, Rivera A, Prado GN, Yao TM, et al. Aldosterone’s rapid, nongenomic effects are mediated by striatin: A modulator of aldosterone’s effect on estrogen action. Endocrinology. 2014; 155(6): 2233-2243.
- Fuller PJ, Young MJ. Duelling receptors: Estrogen receptor versus mineralocorticoid receptor in the cardiovascular system. Endocrinology. 2014; 155(11): 4117-4119.
- Tapia-Castillo A, Carvajal CA, Campino C, Hill C, Allende F, Vecchiola A, et al. The Expression of RAC1 and Mineralocorticoid Pathway-Dependent Genes are Associated With Different Responses to Salt Intake. Am J Hypertens. 2015; 28(6): 722-728.
- Nagase M. Role of Rac1 GTPase in salt-sensitive hypertension. Curr Opin Nephrol Hypertens. 2013; 22(2): 148-155.
- Cohen DL, Wachtel H, Vaidya A, Hundemer GL, Tezuka Y, Davio A, et al. Primary Aldosteronism in Chronic Kidney Disease: Blood Pressure Control and Kidney and Cardiovascular Outcomes After Surgical Versus Medical Management. Hypertension. 2023; 80(10): 2187-2195.
- Hundemer GL, Leung AA, Kline GA, Brown JM, Turcu AF, Vaidya A. Biomarkers to Guide Medical Therapy in Primary Aldosteronism. Endocr Rev. 2024; 45(1): 69-94.
- Tapia-Castillo A, Carvajal CA, Perez JA, Sandoval A, Allende F, Solari S, et al. Low Cortisone as a Novel Predictor of the Low-Renin Phenotype. J Endocr Soc. 2024; 8(6): bvae051.
- Calhoun DA, Sharma K. The role of aldosteronism in causing obesity-related cardiovascular risk. Cardiol Clin. 2010; 28(3): 517- 527.
- Quinkler M, Meyer B, Bumke-Vogt C, Grossmann C, Gruber U, Oelkers W, et al. Agonistic and antagonistic properties of progesterone metabolites at the human mineralocorticoid receptor. Eur J Endocrinol. 2002; 146(6): 789-799.