Rev. chil. endocrinol. diabetes 2011; (1) Volver a Índice
Artículos por Invitación
Este artículo es el segundo de la serie en que prestigiados médicos radiólogos dan a conocer, en forma de una amplia galería de
imágenes, su experiencia, práctica y docente, sobre aspectos de patología endocrinológica. Esta vez el invitado es el Dr. Isidro Huete L.
El Editor
Imágenes de patología hipofisiaria y de la cavidad selar
Isidro Huete L. y Pablo Riquelme M.1
Pituitary pathology images and the cavity selar
1Residente Becario de Radiología.
Departamento de Radiología Pontificia Universidad Católica de Chile.
Correspondencia:
Dr. Isidro Huete L.
E-mail: ihuete@med.puc.cl
Recibido: 09 de Diciembre de 2010
Aceptado: 10 de Diciembre de 2010
El estudio con imágenes de la región selar se sustenta actualmente en técnicas de Resonancia Magnética (RM) que han reemplazado a la tomografia computada (TAC) como el método de elección para evaluar la patología pituitaria1-3. La RM es más sensible que la TAC para identificar los microadenomas pituitarios y permite definir mejor las relaciones de los tumores con las estructuras vecinas4-6. En Chile la disponibilidad de equipos de Resonancia Magnética, aunque dispar en cuanto al número instalado en el sector publico en relación al sector privado, permite un acceso aceptable en la mayoría de las regiones del país.
A diferencia de la tomografia computada, que emplea tubos de rayos X, la RM no utiliza radiaciones ionizantes, lo que es una ventaja a considerar en los pacientes pediátricos y en las mujeres embarazadas. La RM tiene una excelente resolución espacial y de tejidos blandos; por ejemplo permite precisar la presencia o ausencia de la neurohipófisis, lo que no es posible con la Tomografia Computada5-7. Con la TAC, con o sin medio de contraste yodado, es posible detectar microadenomas y macroadenomas pituitarios (Figuras 1A y 1B); sin embargo, en los macroadenomas puede ser difícil distinguir las relaciones del tumor con el quiasma óptico, o definir la invasión del seno cavernoso. Además, los artefactos producidos por amalgamas dentales deterioran las imágenes y la dificultad para lograr posiciones cómodas para los pacientes, con el fin de obtener cortes coronales directos, limitan la utilidad de la TAC.
En todo caso si la RM no está disponible o está contraindicada, por ejemplo en un paciente con un marcapaso cardíaco, la TAC con equipos de multicorte puede ser suficiente en la evaluación de microadenomas, teniendo presente que en estos tumores milimétricos la TAC tiene un 25% de falsos negativos; así, en estos casos los antecedentes clínicos y los exámenes de laboratorio son fundamentales8,9.
En los tumores grandes (macroadenomas) la TAC puede entregar información diagnóstica adecuada, pero no supera la definición que se logra con equipos de RM superconductores (Figuras 2 A y 2B).
 Figura 1A y B. TAC con contraste yodado, corte coronal, muestra un microadenoma lateralizado a izquierda (punta de flecha). Control a los 2 años. TAC con contraste yodado, corte coronal, demuestra aumento de volumen del microadenoma, lo que es infrecuente de observar en clínica (punta de flecha).
Figura 1A y B. TAC con contraste yodado, corte coronal, muestra un microadenoma lateralizado a izquierda (punta de flecha). Control a los 2 años. TAC con contraste yodado, corte coronal, demuestra aumento de volumen del microadenoma, lo que es infrecuente de observar en clínica (punta de flecha).  Figura 2A y B. Cortes sagitales de RM y TAC. Adenoma pituitario con invasión del esfenoides y del clivus (puntas de flecha). Es posible demostrar las estructuras óseas en RM con similar precisión que la TAC.
Figura 2A y B. Cortes sagitales de RM y TAC. Adenoma pituitario con invasión del esfenoides y del clivus (puntas de flecha). Es posible demostrar las estructuras óseas en RM con similar precisión que la TAC.
La RM permite visualizar de manera precisa la anatomía de la glándula pituitaria, el infundíbulo, quiasma óptico, senos cavernosos y las estructuras vasculares vecinas y es el único método que define la anatomía del hipotálamo. Los reparos anatómicos óseos de la base del cráneo y del esfenoides son en ocasiones difíciles de demostrar, pero la señal de la mucosa del seno permite identificar los septos, y los reparos quirúrgicos que se utilizan en la cirugía vía transesfenoidal10,11.
La RM utiliza un campo magnético elevado, preferentemente de 1,5 Tesla o más; con ondas de radio se obtienen señales diferenciadas de los átomos de hidrógeno que forman parte integral de los tejidos corporales y con ello se reconstruye la morfología en forma digital, la que se muestra en cortes multiplanares. Para conseguir resultados óptimos es necesario emplear técnicas de examen dirigidas a obtener imágenes de la glándula pituitaria, con cortes finos de 1-2 mm (coronal y sagital) pre y postcontraste, con secuencias dinámicas y técnicas de supresión grasa12-15. Con estas imágenes de alta resolución es posible localizar tumores pequeños y definir sus caracteristicas. Los componentes del tumor pueden ser sólidos o quísticos, lo que con las secuencias ponderadas en T1 y T2 son fácilmente distinguibles pudiendo identificarse la presencia de sangre o grasa, con secuencias de gradiente y supresión grasa. Los depósitos cálcicos pueden ser difíciles de identificar con las secuencias convencionales, ya que la señal T1w y T2w es variable. Con el uso de secuencias de gradiente o susceptibilidad magnética (SWI) se facilita su identificación.
Con la administración de contraste paramagnético es posible evaluar el comportamiento dinámico de la hipófisis en relación a un tumor pituitario16, y también se puede investigar la composición metabólica de los distintos tumores con técnicas de espectroscopia.
Anatomía normal de la glándula pituitaria
En los recién nacidos, la glándula tiene un borde superior convexo y presenta hiperseñal homogénea en secuencias T1w (Figura 3A). Durante el primer año de vida la adenohipófisis cambia su señal, pero se mantiene un foco de hiperseñal posterior donde se ubica la neurohipófisis (Figura 3B). A partir de los dos años de edad adquiere una altura < 6 mm, tamaño que se mantiene hasta la pubertad, período en que aumenta alcanzando en promedio 8 mm en niños y 10 mm en niñas, medidas que se mantienen en los adultos jóvenes17 (Figuras 4A, 4B y 4C). Durante el embarazo la hipófisis alcanza su mayor tamaño, con 12 mm de altura durante el último mes de gestación y en la primera semana posparto (Figura 5). La adenohipófisis aumenta en un 30% su tamaño, alcanzando su máximo volumen al tercer día posparto18, como resultado de la hipertrofia e hiperplasia de los lactotropos inducida por los estrógenos de la placenta. La neurohipófisis pierde su foco de hiperseñal durante el tercer trimestre, aunque las dimensiones del tallo hipofisiario y de la neurohipófisis no se modifican durante el embarazo.
El tallo pituitario normal tiene un diámetro transverso de 3,25 mm a nivel del quiasma óptico y mide 1,91 mm en la inserción pituitaria19.
En general, el volumen y la forma de la glándula pituitaria varían con la edad, el sexo y las condiciones fisiológicas del individuo; así, por ejemplo, la hiperplasia pituitaria asociada al hipotiroidismo primario puede simular un adenoma pituitario. Algunas variaciones en la morfología corresponden al hecho que la glándula pituitaria debe acomodarse a la forma y volumen de la silla turca, lo que hay que tener presente al evaluar sus características (Figuras 6A, 6B y 7).
Entre la adenohipófisis, que representa un 75% del volumen de la glándula, y la neurohipófisis se encuentran la pars intermedia y la hendidura de Rathke, que no se identifican con precisión con los métodos disponibles y que son sitios de origen de quistes (Figura 8), confundibles con adenomas pituitarios y que pueden constituir un problema diagnóstico20, especialmente cuando el cuadro clínico y los exámenes iniciales sugieren un microadenoma.
Con el aumento de la edad puede desaparecer el foco hiperintenso en T1w de la neurohipófisis, lo que ha sido comunicado en el 10 a 29% de sujetos normales21.
 Figura 3A. Corte sagital, secuencia T1w. Glándula pituitaria en un recién nacido, muestra hiperseñal homogénea normal a esta edad.
Figura 3A. Corte sagital, secuencia T1w. Glándula pituitaria en un recién nacido, muestra hiperseñal homogénea normal a esta edad.  Figura 3B. Corte sagital, secuencia T1w. Glándula pituitaria en lactante de 2 meses, muestra disminución de la hiperseñal de la adenohipófisis.
Figura 3B. Corte sagital, secuencia T1w. Glándula pituitaria en lactante de 2 meses, muestra disminución de la hiperseñal de la adenohipófisis.  Figura 4A. Corte sagital, secuencia T1w. Glándula pituitaria normal en adulto joven (27 años), muestra foco posterior de hiperseñal de la neurohipófisis (punta de flecha); la señal de la adenohipófisis es similar a la de la protuberancia.
Figura 4A. Corte sagital, secuencia T1w. Glándula pituitaria normal en adulto joven (27 años), muestra foco posterior de hiperseñal de la neurohipófisis (punta de flecha); la señal de la adenohipófisis es similar a la de la protuberancia.  Figura 4B. Corte sagital, secuencia T2w.en el mismo paciente, la glándula pituitaria, muestra la neurohipófisis con leve hiperseñal (punta de flecha); la señal de la adenohipófisis es también similar a la protuberancia en esta secuencia.
Figura 4B. Corte sagital, secuencia T2w.en el mismo paciente, la glándula pituitaria, muestra la neurohipófisis con leve hiperseñal (punta de flecha); la señal de la adenohipófisis es también similar a la protuberancia en esta secuencia.  Figura 4C. Corte sagital, secuencia T1w post inyección de Gadolinio. La glándula pituitaria, muestra refuerzo normal incluyendo el tallo pituitario; en el cerebro solo se refuerzan las estructuras vasculares.
Figura 4C. Corte sagital, secuencia T1w post inyección de Gadolinio. La glándula pituitaria, muestra refuerzo normal incluyendo el tallo pituitario; en el cerebro solo se refuerzan las estructuras vasculares.  Figura 5. Corte sagital, secuencia T1w. Examen realizado dos días postparto; muestra la pituitaria levemente mas intensa que la protuberancia, con un borde superior convexo (puntas de flecha), que ocupa la porción central inferior de la cisterna supraselar, lo que corresponde a hallazgos normales en esta condición.
Figura 5. Corte sagital, secuencia T1w. Examen realizado dos días postparto; muestra la pituitaria levemente mas intensa que la protuberancia, con un borde superior convexo (puntas de flecha), que ocupa la porción central inferior de la cisterna supraselar, lo que corresponde a hallazgos normales en esta condición. Figura 6A y B. Cortes sagital y coronal T1w con Gadolinio, muestra una glándula pituitaria que ocupa la cisterna supraselar (puntas de flecha), por insuficiente desarrollo de la silla turca.
Figura 6A y B. Cortes sagital y coronal T1w con Gadolinio, muestra una glándula pituitaria que ocupa la cisterna supraselar (puntas de flecha), por insuficiente desarrollo de la silla turca.
 Figura 7. Corte coronal, secuencia T2w, muestra que la hipófisis ocupa la porción central de la fosa pituitaria (punta de flecha), con ambas arterias carótidas internas aproximándose a la línea media, lo que corresponde a una variante anatómica, que debe identificarse antes de realizar una cirugía por vía transesfenoidal.
Figura 7. Corte coronal, secuencia T2w, muestra que la hipófisis ocupa la porción central de la fosa pituitaria (punta de flecha), con ambas arterias carótidas internas aproximándose a la línea media, lo que corresponde a una variante anatómica, que debe identificarse antes de realizar una cirugía por vía transesfenoidal.  Figura 8. Corte sagital, secuencia T1w con Gadolinio, se observa un pequeño quiste de la pars intermedia (punta de flecha), inmediatamente inferior al tallo pituitario.
Figura 8. Corte sagital, secuencia T1w con Gadolinio, se observa un pequeño quiste de la pars intermedia (punta de flecha), inmediatamente inferior al tallo pituitario.
También con la mayor edad se produce involución de la glándula22, lo que puede acentuarse con el desarrollo de una hernia de la cisterna supraselar en la fosa pituitaria, que en grados avanzados constituye un aracnoidocele selar. En estos casos la silla turca puede estar aumentada de tamaño sin que exista un tumor; esto se debe a las pulsaciones del líquido cefalorraquideo(LCR) transmitidos a través de la apertura normal del diafragma selar, que en un 20% de la población puede estar ausente o presentar una dehiscencia adquirida, lo que inicialmente fue descrito en patología como "silla turca vacía"23. Esta situación de vacuidad no es tal, porque en realidad la silla turca está ocupada por líquido cefalorraquideo y una glándula pituitaria aplanada, con un tallo pituitario elongado (Figuras 9A y 9B), condición que se observa con mayor frecuencia en mujeres sobre los 50 años, obesas y multíparas. Se ha descrito en un 5,5 % de las autopsias y generalmente se trata de una condición primaria, habitualmente asintomática. En los casos secundarios, cuando hay causas como la cirugía o radioterapia, puede asociarse con alteraciones del campo visual por adherencias que deforman el quiasma óptico24.
 Figura 9A y B. Cortes sagitales, secuencias T1wl con Gadolinio y T2w, muestran la hipófisis en la porción inferior de la fosa pituitaria, lo que es secundario a una herniación de la cisterna supraselar (flecha). Obsérvese que el tallo pituitario esta también descendido. La secuencia T2w permite confirmar que la señal del líquido en la fosa pituitaria es similar al LCR del IV ventrículo (punta de flecha).
Figura 9A y B. Cortes sagitales, secuencias T1wl con Gadolinio y T2w, muestran la hipófisis en la porción inferior de la fosa pituitaria, lo que es secundario a una herniación de la cisterna supraselar (flecha). Obsérvese que el tallo pituitario esta también descendido. La secuencia T2w permite confirmar que la señal del líquido en la fosa pituitaria es similar al LCR del IV ventrículo (punta de flecha). Tumores pituitarios
Los adenomas pituitarios son las lesiones más comunes de la glándula pituitaria y corresponden a un 15% de todos los tumores intracraneanos25. Son tumores, benignos en su gran mayoría, que se clasifican en funcionantes y no funcionantes y de acuerdo a su tamaño se dividen en microadenomas (< 10 mm), que son tumores generalmente funcionantes y en macroadenomas (> 10 mm). En series de autopsia, los adenomas pituitarios corresponden en un 50% a tumores no funcionantes26.
En los microadenomas el crecimiento tumoral es observado en una minoría de los casos (Figuras 1A y 1B), en contraste con los macroadenomas, los cuales cuando son encontrados en forma accidental (incidentalomas pituitarios) han demostrado un aumento de tamaño que varía entre 25 a 50%27-31.
El volumen tumoral se mide con el diámetro mayor en las tres direcciones cartesianas. El diámetro vertical (V) se mide en cortes sagitales y coronales T1w; el diámetro anteroposterior (AP) en corte T1w sagital y el diámetro transversal (T) en corte coronal T1 w. El volumen tumoral se calcula como el volumen de un elipsoide con la fórmula: π/6 (VxAPxT)32.
Aproximadamente 65% de los adenomas pituitarios secretan una hormona (48% prolactina, 10% hormona del crecimiento, 6% ACTH y 1% tirotropina); el resto de los adenomas pituitarios (35%) no es secretor de hormonas33.
Los prolactinomas (Figuras 10A y 10B) se presentan frecuentemente como microadenomas en mujeres premenopáusicas con amenorrea y galactorrea34. En hombres, los prolactinomas pueden ser asintomáticos o desarrollar síntomas visuales o hipogonadismo hipogonadotrópico con pérdida de la libido e impotencia.
Los tumores que secretan hormona del crecimiento son en general de mayor tamaño y se manifiestan con acromegalia; antes de la pubertad resultan en gigantismo. Los adenomas que secretan ACTH se presentan con tamaños muy pequeños, ya que el impacto hormonal es más rápido en aparecer y son particularmente difíciles de detectar.
Los macroadenomas pituitarios no funcionantes (MANF) son los macroadenomas más prevalentes; al momento del diagnóstico, los defectos del campo visual se detectan en 60-80% de los pacientes.
Los microadenomas pituitarios se asocian frecuentemente con una silla turca de tamaño normal y en estos casos la radiografía convencional y la tomografía pluridirectional son insensibles y no especificas. La RM es el método más útil para evaluar este grupo de pacientes35, con técnicas complementarias que incluyen la AngioTAC, AngioRM, la angiografía digital y la obtención de muestras en venas petrosas en casos de pacientes con enfermedad de Cushing.
 Figura 10A y B. Microadenoma pituitario (prolactinoma), secuencias T1W antes y después de contraste, cortes coronales. Sin Gadolinio el tumor tiene señal similar a la glándula pituitaria. La secuencia T1W post Gadolinio, muestra la glándula contrastada y a izquierda un tumor no contrastado, (hipointenso) de 7 mm (punta de flecha).
Figura 10A y B. Microadenoma pituitario (prolactinoma), secuencias T1W antes y después de contraste, cortes coronales. Sin Gadolinio el tumor tiene señal similar a la glándula pituitaria. La secuencia T1W post Gadolinio, muestra la glándula contrastada y a izquierda un tumor no contrastado, (hipointenso) de 7 mm (punta de flecha). Características de la imagen del adenoma pituitario
En el caso de los microadenomas, al ser tumores funcionantes, el cuadro clínico y de laboratorio ayuda a definir la localización de la lesión. La glándula pituitaria, considerando el pequeño tamaño de los tumores, puede mostrar forma y volumen normal. En un 20-25% de los casos no se logra demostrar los microadenomas menores de 3 mm, lo que aumenta al 40% en el casos de los adenomas productores de ACTH, en que los exámenes falsos negativos son más frecuentes36-38 (Figuras 11A, 11B, 11C y11D). En este grupo de pacientes es fundamental la utilización de protocolos de examen que incluyan cortes finos coronales de 1 mm en secuencias ponderadas en T1 antes, durante y después de la inyección de Gadolinio, para asegurar la detección de los adenomas, los cuales se contrastan en general más tardíamente que la glándula normal39-41 (Figuras 12A y 12B).
 Figura 11A. Microadenoma pituitario productor de ACTH, corte coronal, secuencia T1w, muestra señal homogénea en la hipófisis. B. corte coronal (secuencia dinámica T1w con Gadolinio); se observa nódulo hipointenso de 3 mm (que aun no se refuerza) en cuadrante inferolateral izquierdo de la hipófisis (punta de flecha). C. corte coronal, secuencia tardía T1w con Gadolinio, muestra refuerzo heterogéneo de la glándula, no es posible precisar la ubicación del tumor. D. corte coronal, secuencia volumétrica SPGR T1w con Gadolinio de 1 mm de espesor, que muestra claramente la ubicación del tumor (punta de flecha). Esta secuencia ha mostrado mejores resultados en la evaluación de la enfermedad de Cushing.
Figura 11A. Microadenoma pituitario productor de ACTH, corte coronal, secuencia T1w, muestra señal homogénea en la hipófisis. B. corte coronal (secuencia dinámica T1w con Gadolinio); se observa nódulo hipointenso de 3 mm (que aun no se refuerza) en cuadrante inferolateral izquierdo de la hipófisis (punta de flecha). C. corte coronal, secuencia tardía T1w con Gadolinio, muestra refuerzo heterogéneo de la glándula, no es posible precisar la ubicación del tumor. D. corte coronal, secuencia volumétrica SPGR T1w con Gadolinio de 1 mm de espesor, que muestra claramente la ubicación del tumor (punta de flecha). Esta secuencia ha mostrado mejores resultados en la evaluación de la enfermedad de Cushing.
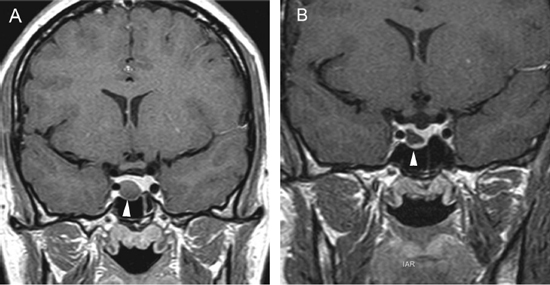 Figura 12A. Microadenoma pituitario (8 mm), corte coronal, secuencia convencional T1w con Gadolinio, el tumor lateralizado a derecha, erosiona y deforma el piso de la silla turca (punta de flecha). B. Mismo paciente, 3 meses post-tratamiento médico, corte coronal secuencia T1w con Gadolinio, El tumor ha modificado su forma, se ha reducido de tamaño (punta de flecha) y la glándula muestra ahora un borde superior cóncavo, con una pequeña herniación de la cisterna supraselar.
Figura 12A. Microadenoma pituitario (8 mm), corte coronal, secuencia convencional T1w con Gadolinio, el tumor lateralizado a derecha, erosiona y deforma el piso de la silla turca (punta de flecha). B. Mismo paciente, 3 meses post-tratamiento médico, corte coronal secuencia T1w con Gadolinio, El tumor ha modificado su forma, se ha reducido de tamaño (punta de flecha) y la glándula muestra ahora un borde superior cóncavo, con una pequeña herniación de la cisterna supraselar. Los macroadenomas pituitarios producen expansión de la silla turca, con moderado refuerzo del tumor después de la inyección de gadolinio. La densidad (TAC), intensidad de señal (RM) y características del refuerzo con medio de contraste yodado (TAC) o gadolinio (RM) no son específicas, pero el aumento de volumen y erosión de la silla turca, la invasión del seno cavernoso y la presencia de contornos lobulados (64%) son hallazgos frecuentes en un macroadenoma42-44. El aumento de volumen selar se observa en 94 a 100% y la erosión de las paredes de la silla turca, incluyendo el piso selar, dorso selar, tubérculo selar y extensión al seno esfenoidal, está presente en 76% de los macroadenomas. La invasión del hueso esfenoides y del clivus (Figura 2Ay 2B) se demuestra en 19% de los casos.
Los macroadenomas pituitarios crecen en general en forma asimétrica y tienden a desplazar lateralmente el infundíbulo. Su estructura es habitualmente heterogénea antes y después del uso de contraste y en sólo 37% de los casos se refuerzan homogéneamente. (Figuras 13 A y 13B). Los macroadenomas muestran cambios quísticos o necróticos en 5 a 18%45,46 (Figuras 14A y 14B). En el caso de lesiones necróticas un absceso puede ocasionalmente simular un macroadenoma no funcionante, tanto en la presentación clínica como en los hallazgos en las imágenes47 (Figuras15 A, 15B y 15C).
 Figura 13A y B. Cortes coronales, secuencias T1w sin y con contraste. Antes de la inyección de gadolinio, el tumor se identifica a pesar de tener señal similar a la glándula (punta de flecha). El tumor muestra un borde superior convexo, se asocia con un piso selar cóncavo y a leve desviación del tallo pituitario a derecha, hallazgos que ayudan a localizarlo. Con el Gadolinio el adenoma se identifica con precisión al reforzarse la glándula pituitaria y los senos cavernosos, lo que permite visualizar la invasión del seno cavernoso izquierdo (punta de flecha).
Figura 13A y B. Cortes coronales, secuencias T1w sin y con contraste. Antes de la inyección de gadolinio, el tumor se identifica a pesar de tener señal similar a la glándula (punta de flecha). El tumor muestra un borde superior convexo, se asocia con un piso selar cóncavo y a leve desviación del tallo pituitario a derecha, hallazgos que ayudan a localizarlo. Con el Gadolinio el adenoma se identifica con precisión al reforzarse la glándula pituitaria y los senos cavernosos, lo que permite visualizar la invasión del seno cavernoso izquierdo (punta de flecha).
 Figura 14A y B. Cortes coronal y sagital, secuencia T1w
Gad., macroadenoma con ex
tensión supraselar que comprime el quiasma óptico (fle
cha). En el corte sagital nótese que la neurohipófisis man-tiene su señal y posición (punta de flecha).
Figura 14A y B. Cortes coronal y sagital, secuencia T1w
Gad., macroadenoma con ex
tensión supraselar que comprime el quiasma óptico (fle
cha). En el corte sagital nótese que la neurohipófisis man-tiene su señal y posición (punta de flecha).  Figura 15 A, B y C. Cortes sagital T1w, coronal T1w Gad. y coronal T2w. Absceso pituitario que simula un macroadenoma quístico no funcionante.
Figura 15 A, B y C. Cortes sagital T1w, coronal T1w Gad. y coronal T2w. Absceso pituitario que simula un macroadenoma quístico no funcionante.El compromiso del seno cavernoso (definido como la invasión perivascular de la arteria carotida interna), se observa en 19% de los macroadenomas y es habitualmente unilateral (Figuras 16A, 16B y 16C) pero puede ser bilateral en macroadenomas invasores (Figuras 17A y 17B). Para evaluar la invasión del seno cavernoso se utilizan las imágenes coronales T1w con gadolinio, efectuando el análisis de la forma y compartimientos del seno cavernoso y su relación con el adenoma; cuando el porcentaje de tumor que rodea la arteria carótida interna intracavernosa es mayor o igual a 66% del círculo medido alrededor de la carótida, hay invasión del seno, si es menor de 25%, el seno no está invadido48.
 Figura 16A, B y C. Cortes coronales T1w sin y con Gadolinio y T2w. Macroadenoma con expansión asimétrica de la silla turca e invasión del seno cavernoso izquierdo.
Figura 16A, B y C. Cortes coronales T1w sin y con Gadolinio y T2w. Macroadenoma con expansión asimétrica de la silla turca e invasión del seno cavernoso izquierdo.  Figura 17A y B. Cortes coronal y axial transversal, T1w Gad. Macroadenoma con crecimiento hacia lateral (entre puntas de flecha), mayor a derecha con invasión de ambos senos cavernosos; el quiasma está libre.
Figura 17A y B. Cortes coronal y axial transversal, T1w Gad. Macroadenoma con crecimiento hacia lateral (entre puntas de flecha), mayor a derecha con invasión de ambos senos cavernosos; el quiasma está libre.Los adenomas invasores (Figuras 18 y 19) constituyen un grupo aparte y de acuerdo con series recientes publicadas representan entre 10% a 35% de los adenomas pituitarios operados49. En estos casos el potencial de invasión es estimado con mayor precisión con estudios histoquímicos y ultraestructurales de las muestras obtenidas durante la cirugía. Estos estudios patológicos, en conjunto con la cuantía de tumor residual demostrada con las neuroimágenes postoperatorias, definirán la conducta terapéutica a seguir.
 Figura 18A y B. Cortes sagitales, secuencia T1Gad. Macroadenoma invasor que se extiende al seno esfenoidal, al clivus, crece en el espacio retroselar, ocupa la cisterna supraselar y se extiende a la región subfrontal.
Figura 18A y B. Cortes sagitales, secuencia T1Gad. Macroadenoma invasor que se extiende al seno esfenoidal, al clivus, crece en el espacio retroselar, ocupa la cisterna supraselar y se extiende a la región subfrontal. Figura 19A y B. Cortes sagitales T1w antes y después de inyección de Gadolinio. El tumor (prolactinoma) crece hacia caudal, invade el seno esfenoidal y erosiona el clivus (puntas de flecha), dejando libre la cisterna quiasmática.
Figura 19A y B. Cortes sagitales T1w antes y después de inyección de Gadolinio. El tumor (prolactinoma) crece hacia caudal, invade el seno esfenoidal y erosiona el clivus (puntas de flecha), dejando libre la cisterna quiasmática. Los adenomas pituitarios invasores tienen características histológicas benignas, los malignos (carcinomas pituitarios) constituyen sólo el 0,2-0,5% de todos los tumores pituitarios50 y generalmente son macroadenomas funcionantes recidivados,que se presentan con metástasis subaracnoideas, cerebrales o sistémicas (Figuras 20 A, 20B, 20C y 20D).
 Figura 20A y B. Cortes sagitales, secuencia T1 sin y con Gad. Prolactinoma maligno que invade el seno esfenoidal, el clivus, se extiende a la cisterna supraselar. C y D cortes axiales transversal y coronal, secuencia T1w con Gad. demuestran invasión subaracnoidea y del lóbulo temporal izquierdo (punta de flecha).
Figura 20A y B. Cortes sagitales, secuencia T1 sin y con Gad. Prolactinoma maligno que invade el seno esfenoidal, el clivus, se extiende a la cisterna supraselar. C y D cortes axiales transversal y coronal, secuencia T1w con Gad. demuestran invasión subaracnoidea y del lóbulo temporal izquierdo (punta de flecha).
Apoplejía pituitaria
La apoplejía pituitaria (Figuras 21A y 21B) es un síndrome clínico que resulta de una hemorragia aguda o infarto en un tumor pituitario51. En pacientes con macroadenomas no funcionantes la apoplejía es el cuadro de presentación en un 15 a 25% de los casos52. En la minoría de los pacientes con apoplejía se conoce previamente la existencia de un tumor pituitario53. En comparación, la incidencia de apoplejía en pacientes con un tumor pituitario conocido es estimada en menos de 1% por año54. La presencia de sangre en un adenoma pituitario no va siempre acompañada de un cuadro clínico de apoplejía pituitaria y es un hecho frecuente de encontrar (Figuras 22A y 22B); los macroadenomas pueden presentar en el 14% de los casos focos de hiperseñal en TIw en áreas de hemorragia55,56. La evolución temporal de la hemorragia en RM (Figuras 23A, 23B y 23C) es diferente a la hemorragia del cerebro que se reabsorbe en pocas semanas; en la glándula pituitaria la hiperseñal T1w puede mantenerse por largo tiempo57.
 Figura 21A. Corte axial transversal a nivel de la cisterna supraselar. La cisterna esta ocupada por una masa pituitaria espontáneamente hiperdensa compatible con hemorragia reciente (punta de flecha). La paciente se presentó con un cuadro de cefalea intenso, que se interpretó inicialmente como una hemorragia subaracnoidea. B. Corte coronal del mismo paciente, secuencia gradiente se observa la extensión supraselar de un adenoma pituitario con una señal muy hipointensa, por la presencia de sangre (punta de flecha). Esta secuencia es muy sensible para detectar hemorragia, ya que la sangre extravasada produce artefactos de susceptibilidad magnética que aparecen como focos de hiposeñal en la imagen.
Figura 21A. Corte axial transversal a nivel de la cisterna supraselar. La cisterna esta ocupada por una masa pituitaria espontáneamente hiperdensa compatible con hemorragia reciente (punta de flecha). La paciente se presentó con un cuadro de cefalea intenso, que se interpretó inicialmente como una hemorragia subaracnoidea. B. Corte coronal del mismo paciente, secuencia gradiente se observa la extensión supraselar de un adenoma pituitario con una señal muy hipointensa, por la presencia de sangre (punta de flecha). Esta secuencia es muy sensible para detectar hemorragia, ya que la sangre extravasada produce artefactos de susceptibilidad magnética que aparecen como focos de hiposeñal en la imagen. Figura 22A y B. Cortes sagital y coronal, secuencia T1w. Se observa un nódulo espontáneamente hiperintenso, resultante de hemorragia subaguda en un adenoma hipofisiario.
Figura 22A y B. Cortes sagital y coronal, secuencia T1w. Se observa un nódulo espontáneamente hiperintenso, resultante de hemorragia subaguda en un adenoma hipofisiario. 
Figura 23A, B y C. Cortes coronales T1w sin contraste. Evolución de la hemorragia en un adenoma pituitario. Examen inicial (A) muestra a derecha el nódulo espontáneamente hiperintenso, los controles (B) a los 2 años y (C) a los 4 años, muestran una lenta disminución de señal de la hemorragia.
Hipofisitis
La hipofisitis autoimmune (HA) puede imitar a los adenomas pituitarios no secretores y para diagnosticarse con certeza se requiere histología postbiopsia, lo que constituye un problema58. Aproximadamente un 40% de los pacientes con hipofisitis son erroneamente diagnosticados como macroadenomas pituitarios y sometidos a cirugía innecesaria.Los factores predictores de mayor utilidad para el diagnóstico son: la relación temporal con el embarazo, piso selar indemne, aumento de tamaño en forma simétrica de la hipófisis, aumento en la intensidad de señal después de la inyección de gadolinio, ausencia del foco de hiperseñal de la neurohipófisis, aumento de tamaño del tallo hipofisiario y edema mucoso, elementos que en conjunto alcanzan una sensibilidad de 92%, con especificidad de 99% y un valor predictivo positivo de 97% para el diagnóstico de hipofisitis autoinmune59.
Las imágenes más características en la RM son un aumento de tamaño simétrico de la glándula pituitaria, una estructura homogénea pre y postgadolinio, con refuerzo intenso después de la inyección de contraste paramagnético. (Figuras 24A y 24B).
La presencia de diabetes insípida es otra característica clínica muy útil en el diagnóstico diferencial;cuando está presente se puede excluir un adenoma pituitario.
 Figura 24 A y B. Hipofisitis, cortes sagitales, secuencias T1w antes y después de la inyección de Gadolinio, se observa aumento de volumen de la pituitaria y del infundíbulo, que muestran un refuerzo intenso y homogéneo (punta de flecha).
Figura 24 A y B. Hipofisitis, cortes sagitales, secuencias T1w antes y después de la inyección de Gadolinio, se observa aumento de volumen de la pituitaria y del infundíbulo, que muestran un refuerzo intenso y homogéneo (punta de flecha). Quiste de la bolsa de Rathke
Los quistes de la bolsa o hendidura de Rathke son quistes selares y supraselares congénitos, no neoplásicos, derivados de remanentes de la bolsa de Rathke. En autopsias se encuentran con una frecuencia de 13% a 22%60. Con la amplia disponibilidad de las neuroimágenes (TAC y RM), estos quistes se descubren frecuentemente como hallazgos incidentales y en general miden menos de 3 mm (Figuras 25A, 25B y 25C) y son comúnmente asintomáticos ya que su tamaño en general no produce compresión de las estructuras vecinas. Si se observa un desplazamiento anterior del infundíbulo se puede considerar el diagnóstico de un quiste de Rathke debido a su origen en la pars intermedia. Los quistes de Rathke sintomáticos son raros y comúmente se presentan como lesions intraselares; un tercio de ellos presenta ubicación supraselar61 (Figuras 26 A y 26B). Los quistes de mayor tamaño pueden presentarse con compresión del quiasma óptico, hipopituitarismo, diabetes insípida y cefalea. Pueden ser difíciles de distinguir en exámenes radiológicos de los craniofaringiomas quísticos o de los adenomas pituitarios quísticos; en estos casos la presencia de diabetes insípida sugiere que el quiste no es un adenoma pituitario.

Figura 25 A, B y C. Cortes sagitales T1w sin y con contraste y T2w. Quiste de Rathke (punta de flecha), localizado detrás de la adenohipófisis que en T1w es espontáneamente hiperintenso y en T2w muestra hiposeñal a diferencia de un quiste simple de la pars intermedia.
 Figura 26A y B. Cortes sagitales T1w antes y después de la inyección de Gadolinio. Quiste de Rathke (puntas de flecha) de la variedad A en T1W, su señal aparece similar a la hipófisis cuando esta se refuerza con el contraste.
Figura 26A y B. Cortes sagitales T1w antes y después de la inyección de Gadolinio. Quiste de Rathke (puntas de flecha) de la variedad A en T1W, su señal aparece similar a la hipófisis cuando esta se refuerza con el contraste.La intensidad de señal del quiste de Rathke es variable y no ayuda a distinguir los quistes no neoplásicos de los neoplásicos62,63, pero el refuerzo de la pared tumoral es esencial en el diagnóstico de un quiste tumoral64. La presencia de nódulos intraquísticos es frecuente en quistes de Rathke, que tienen hiperseñal en T1w e hiposeñal en T2w, lo que es útil en casos en que el líquido del quiste muestra señal elevada en T1w65. Con el uso de gadolinio no se refuerzan, aunque la glándula pituitaria comprimida por el quiste puede simular una pared que se contrasta (Figuras 27A, 27B y 27C). Los quistes de la bolsa de Rathke contienen material mucoide y colesterol, son hiperintensos (70%) en T2w (Figura 6). En T1w la mitad de los quistes de Rathke presentan una señal hiperintensa heterogénea (Figura 6). En imágenes FLAIR, que es una secuencia ponderada en T2 con atenuación de la señal del líquido cefalorraquídeo, el quiste pude aparecer hiperintenso66.

Figura 27A, B y C. Cortes coronales A y B, T1w sin y con Gadolinio y corte sagital T1w Gad. Quiste de la bolsa de Rathke, el quiste es hipointenso y homogéneo y no muestra refuerzo de sus paredes después de la inyección de contraste.
Conclusión
La resonancia magnética, usando los protocolos de examen adecuados, es el método de imágenes más útil para localizar y diferenciar los distintos tipos de lesiones intraselares. En la práctica clínica, considerando que aproximadamente un 10-20% de la población general67-69 puede tener adenomas no funcionantes o quistes incidentales, muchos de ellos microscópicos, es importante que la probabilidad de enfermedad sea alta en los pacientes estudiados, para que los hallazgos en un examen de RM puedan conducir a un tratamiento adecuado.
La evaluación clínica, apoyada en los exámenes de laboratorio y neuro-imágenes permitirá precisar un diagnóstico e idealmente plantear una aproximación histológica en cuanto al origen de los tumores de la silla turca. Esto tiene gran importancia para decidir el tipo de tratamiento, y, en el caso de plantearse la cirugía, las imágenes son fundamentales para definir las técnicas quirúrgicas (vía transesfenoidal versus craniotomía) y anticipar el grado de resección posible.
Referencias
- Guy RL, Benn JJ, Ayers AB, et al. 1991. A comparison of CT and MRI in the assessment of the pituitary and parasellar region. Clin Radiol 43: 156-161.
- Goldstein SJ, Lee C, Carr WA, et al. 1986. Magnetic resonance imaging of the sella turcica and parasellar region. A clinical-radiographic evaluation with computed tomography. Surg Neurol 26: 30-337.
- Johnson MR, Hoare RD, Cox T, et al. 1992. The evaluation of patients with a suspected pituitary microadenoma: computer tomography compared to magnetic resonance imaging. Clin Endocrinol (Oxf) 36: 335-3828.
- Lundin P, Bergstrom K. Thuomas KA, Lundberg P0, Muhr C. 1991. Comparison of MR imaging and CT in pituitary macroadenomas. Acta Radiol 32: 189-196.
- Nichols DA, Laws ER Jr, Houser OW, Abboud CF. 1988. Comparison of magnetic resonance imaging and computed tomography in the preoperative evaluation of pituitary adenomas. Neurosurgery 22: 380-385.
- Pisaneschi M, Kapoor G. 2005. Imaging the sella and parasellar region. Neuroimaging Clin N Am 15: 203-219.
- Zucchini S, di Natale B, Ambrosetto P, et al. 2008. Role of magnetic resonance imaging in hypothalamic-pituitary disorders. AJNR Am J Neuroradiol 29: 613-615.
- Dietemann JL, Cromero C, Tajahmady T, et al. 1992. CT and MRI of supraselar lesions. J Neuroradiol 19: 1-22.
- Bonneville JF, Cattin F, Dietemann JL. 1989. Hypothalamic-pituitary region: computed tomography imaging. Baillieres Clin Endocrinol Metab 3: 35-71.
- Chakeres DW, Curtin A, Ford G. 1989. Magnetic resonance imaging of pituitary and parasellar abnormalities. Radiol Clin North Am 27: 265-281.
- Schwartzberg D. 1992. Imaging of pituitary gland tumors. Seminars in Ultrasound, CT and MRI. Vol.13 No3:207-223.
- Soto-Ares G, Cortet-Rudelli C, Assaker R, Boulinguez A, Dubest C, Dewailly D, Pruvo JP. 2002. MRI protocol technique in the optimal therapeutic strategy of non-functioning pituitary adenomas. Eur J Endocrinol 146: 179-186.
- Seidenwurm DJ. 2008. for the Expert Panel on Neurologic Imaging. ACR Appropriateness Criteria Neuroendocrine Imaging. AJNR Am J Neuroradiol 29: 613-615.
- Longui CA, Rocha AJ, Menezes DM, et al. 2004. Fast acquisition sagittal T1 magnetic resonance imaging (FAST1-MRI): a new imaging approach for the diagnosis of growth hormone deficiency. J Pediatr Endocrinol Metab 17: 1111-1114.
- Macpherson P, Hadley DM, Teasdale E, et al. 1989. Pituitary microadenomas. Does Gadolinium enhance their demonstration? Neuroradiology 31: 293-298.
- Kucharczyk W, Bishop JE, Plewers DB, Keller MA, George S. 1994. Detection of pituitary microadenomas: comparison of dynamic keyhole fast spin-echo, unenhanced and conventional contrastenhanced MR imaging. AJR Am J Roentgenol 163: 671-679.
- Tien P, Kucharczky J, Bessette J, Middleton M. 1992. RM Imaging of the pituitary gland in infants and children:changes in size,shape and MR signal with growth and development. AJR Am J Roentgenol 158: 1151-1154.
- Dinc H, Esen F, Demirci A, et al. 1998. Pituitary dimensions and volume measurements in pregnancy and post partum: MR assessment. Acta Radiol 39: 64-69.
- Simmons GE, Suchnicki JE, Rak KM, et al. 1992. MR imaging of the pituitary stalk: size, shape, and enhancement pattern. AJR Am J Roentgenol 159: 375-377.
- Lee MH, Choi HY, Sung YA, et al. 2001. High signal intensity of the posterior pituitary gland on T1-weighted MR images: correlation with plasma vasopressin concentration to water deprivation. Acta Radiol 42: 129-134.
- Shanklin WM. 1949. On the presence of cysts in the human pituitary. Anat Rec 104: 399-407.
- Terano T, Seya A, Tamura Y, et al. 1996. Characteristics of the pituitary gland in elderly subjects from magnetic resonance images: relationship to pituitary hormone secretion. Clin Endocrinol (Oxf) 45: 273-279.
- Busch W. 1951. Die morphologie der sella turcica and ihre biezehungen zur hypophise.Virchow Arch Anat Physol 32D:
437-458. - Bjerre P. The empty sella. 1990. A reappraisal of etiology and pathogenesis. Acta Neurol Scand 130 (Suppl): 1-25.
- Ezzat S, Asa SL, Couldwell WT, et al. 2004. The prevalence of pituitary adenomas: a systematic review. Cancer 101: 613-619.
- Burrow GN, Wortzman G, Rewcastle NB, Holgate RC & Kovacs K. 1981. Microadenomas of the pituitary and abnormal sellar tomograms in an unselected autopsy series. N Engl J Med 304: 156-158.
- Dekkers OM, Hammer S, de Keizer R, Roelfsema F, Schutte P, Smit J, Romijn J and Pereira A. 2007. The natural course of non-functioning pituitary macroadenomas. Eur J Endocrinol 156: 217-224.
- Donovan LE & Corenblum B. 1995. The natural history of the pituitary incidentaloma. Arch Inter Med 155: 181-183.
- Reincke M, Allolio B, Saeger W, Menzel J & Winkelmann W. 1990 The 'incidentaloma' of the pituitary gland. Is neurosurgery required? JAMA; 263: 2772-2776.
- Sanno N, Oyama K, Tahara S, Teramoto A, Kato Y. 2003. A survey of pituitary incidentaloma in Japan. Eur J Endocrinol 149: 123-127.
- Arita K, Tominaga A, Sugiyama K. 2006. Natural course of incidentally found nonfunctioning pituitary adenoma, with special reference to pituitary apoplexy during follow-up examination. Brit J Neurosurg 104: 884-891.
- Di Chiro G, Nelson KB. 1962 The volume of the sella turcica. American Journal of Radiology 87: 989-1008.
- Post KD, McCormick PC, Bello JA. 1987. Differential diagnosis of pituitary tumors. Endocrinol Metabol Clin North Am 16: 609-645.
- Schlechte JA. 2003. Clinical practice. Prolactinoma. N Engl J Med 349: 2035-2041.
- Kucharczyk W, Davis DO, Kelly WM, et al. 1986. Pituitary adenomas: high resolution MR imaging at 1.5 T. Radiology 161: 761-765.
- Newell-Price J, Bertagna J,Grossman A, Nieman L. 2006. Cushing's syndrome. Lancet 367: 1605-1617.
- Tripathi S, Ammini AC, Bhatia R, et al. 1994.Cushing's disease: pituitary imaging. Australas Radiol 38: 183-186.
- Escourolle H, Abecassis JP, Bertagna X, et al.1993. Comparison of computerized tomography and magnetic resonance imaging for the examination of the pituitary gland in patients with Cushing's disease. Clin Endocrinol (Oxf) 39: 307-313.
- Bonneville JF, Bonneville F, Cattin F. 2005. Magnetic resonance imaging of pituitary adenomas. Eur Radiol 15: 543-548.
- Bartynski WS, Lin L. 1997. Dynamic and Conventional Spin-Echo MR of Pituitary Microlesions AJNR Am J Neuroradiol 18: 965-972.
- Yuh WTC, Fisher DJ, Nguyen HD, et al. 1994. Sequential MR enhancement pattern in normal pituitary gland and in pituitary adenoma. AJNR Am J Neuroradiol 15: 101-108.
- Donovan JL, Nesbit GM. 1996. Distinction of masses involving the sella and supraselar space: specificity of imaging features. AJR Am J Roentgenol; 167: 597-603.
- Hershey BL. 1993. Suprasellar masses: diagnosis and differential diagnosis. Semin Ultrasound CT MR 14: 215-231.
- Johnsen DE, Woodruff WW, Allen IS, et al. 1991.MR imaging of the sellar and juxtasellar regions. Radiographics 11: 727-758.
- Freda PU, Post KD. 1999. Differential diagnosis of sellar masses. Endocrinol Metab Clin North Am 28: 81-117.
- Connor SE, Penney CC. 2003. MRI in the differential diagnosis of a sellar mass. Clin Radiol 58: 20-31.
- Lury KM. 2005. Inflammatory and infectious processes involving the pituitary gland. Top Magn Reson Imaging; 16: 301-306.
- Cottier JP, Destrieux C, Brunerau L, et al. 2000. Cavernous sinus invasion by pituitary adenoma : MR imaging. Radiology 215: 463-469.
- Scheithauer B, Kalman T, Kovacs T, Laws E, Randall R. 1986. Pathology of invasive pituitary tumors with special reference to functional classification. J Neurosurg 65: 773-744.
- Kattsas GA, Nomikos P, Kontogeorgos G, Buchfelder M, Grossman A. 2005. Clnical Review: Diagnosis and managment of pituitary carcinomas. J Clin Endocrinol Metab 90 (5): 3089-3099.
- Poussaint TY, Barnes PD, Douglas CA, et al. 1996. Hemorrhagic Pituitary Adenomas of Adolescence. AJNR Am J Neuroradiol 17: 1907-1912.
- Bonneville JF, Cattin F, Marsot-dupuch K, Dormant D, Bonneville F, Chiras J. 2006. T1 signal hyperintensity in the sellar region:Spectrum of findings. Radiographics 26: 93-113.
- Bonneville F, Narboux Y, Cattin F, et al. 2002. Preoperative location of the pituitary bright spot in patients with pituitary macroadenomas. AJNR Am J Neuroradiol 23: 528-532.
- Tosaka M, Sato J, Hirato H, et al. 2007. Assessment of Hemorrhage in Pituitary Macroadenoma by T2*weighted Gradient Echo MR Imaging. AJNR Am J Neuroradiol 28: 2023-2029.
- Pressman EK, Zeidman SM, Reddy UM, et al. 1995. Differentiating lymphocytic adenohypophysitis from pituitary adenoma in the peripartum patient. J Reprod Med 40: 251-259.
- Gutenberg A, Larsen J, Lupi I, Rohde V, Caturegli P. 2009. A Radiologic Score to Distinguish Autoimmune Hypophysitis from Nonsecreting Pituitary Adenoma Preoperatively AJNR Am J Neuroradiol 30: 1766-1772.
- Mukherjee J, Islam N, Kaltsas G, Iowe DG, Charlesworth M, Grossman A. 1997. Clinical, Radiological and Pathological Features of Patients with Rathke's Cleft Cysts: Tumors That May Recur. J Clin Endocrinol Metab Vol. 82, No. 7.
- Sumida M, Uozumi T, Mukada K, Arita K, Kurisu K, Eguchi K. 1994. Rathke's cleft cysts: correlation of enhanced MR and surgical findings. AJNR Am J Neuroradiol 15: 525-532.
- Hayashi Y, Tachibana O, Muramatsu N, et al. 1999. Rathke cleft cyst: MR and biomedical analysis of cyst content. J Comput Assist Tomogr 23: 34-38.
- Ahmadi J, Dstian S, Apuzzo MLJ, Segall HD, Zee CS. 1992. Cystic fluid in craniopharyngioma: MR imaging and quantitative analysis. Radiology 182: 783-785.
- Ross DA, Norman D, Wilson CB. 1992. Radiologic characteristics and results of surgical management of Rathke's cysts in 43 patients. Neurosurgery 30: 173-179.
- Woo Mok Byun, Oh Lyong Kim, Dong sug Kim. 2000. MR Imaging Findings of Rathke's Cleft Cysts: Significance of Intracystic Nodules. AJNR Am J Neuroradiol 25: 485-488.
- Voelker JL, Campbell RL, Muller J. 1991. Clinical, radiographic and pathological features of symptomatic Rathke's cleft cysts. J Neurosurg 74: 535-544.
- Feldkamp J, Santen R, Harms E, Aulich A. 1999. Modder U and Scherbaum WA. Incidentally discovered pituitary lesions: high frequency of macroadenomas and hormone-secreting adenomas: results of a prospective study. Clinical Endocrinology 51: 109-113.
- Chanson P, Daujat F, Young J, Bellucci A, Kujas M, Doyon D, Schaison G. 2001. Normal pituitary hypertrophy as a frequent cause of pituitary incidentaloma: a follow-up study. J Clin Endocrinol Metab 86: 3009-3015.
- Hall W, Luciano M, Doppman J, Patronas, Oldfield E. 1994. Pituitary magnetic resonance imaging in normal human volunteers: occult adenomas in the general population. Annals of Internal Medicine 120: 817-820.