La suplementación con fructosa aumenta la expresión de factores lipogénicos y la esteatosis hepática inducida por una dieta alta en grasa
Javiera González1, Amanda D’Espessailles2, Daniel González-Mañán3, Nevenka Juretić4, Mabel Catalán5, Constanza Riquelme6, Patricio Tapia7, Gladys Tapia8
Fructose supplementation increases lipogenic factor expression and hepatic steatosis induced by a high-fat diet
- Tecnóloga Médica. Programa de Farmacología Molecular y Clínica, ICBM, Facultad de Medicina, Universidad de Chile. Santiago, Chile.
- Bióloga, PhD. Instituto de Ciencias de la Salud, Universidad de O’Higgins. Rancagua, Chile.
- Bioquímico, PhD. Facultad de Ciencias, Ingeniería y Tecnología, Universidad Mayor. Santiago, Chile.
- Bioquímico, PhD. Programa de Biología Celular y Molecular, ICBM, Facultad de Medicina, Universidad de Chile. Santiago, Chile.
- Químico Farmaceútico, PhD. Programa de Farmacología Molecular y Clínica, ICBM, Facultad de Medicina, Universidad de Chile. Santiago, Chile.
- Bioquímico. Programa de Farmacología Molecular y Clínica, ICBM, Facultad de Medicina, Universidad de Chile. Santiago, Chile.
- Médico. Programa de Farmacología Molecular y Clínica, ICBM, Facultad de Medicina, Universidad de Chile. Santiago, Chile.
- Bióloga, PhD. Programa de Farmacología Molecular y Clínica, ICBM, Facultad de Medicina, Universidad de Chile. Santiago, Chile.
Apoyo Financiero:
- Fondo de Investigación UNETE (Proyecto # UNT15-004) del Convenio de Desempeño Regional, FRO 1301, Universidad de La Frontera.
- Fondo de Investigación de la Sociedad Chilena de Endocrinología y Diabetes (SOCHED #2021-04).
*Correspondencia: Gladys Tapia /
gtapia@uchile.cl
Los autores declaran no tener conflictos de interés.
Financiamiento Proyecto SOCHED 2021-09.
Recibido: 20-11-2023.
Aceptado: 12-12-2023.
Resumen: La enfermedad de hígado graso no alcohólico (EHGNA) abarca desde una acumulación simple de lípidos neutros, triacilglicéridos (TAG) y colesterol en más del 5% de los hepatocitos, hasta una forma más avanzada llamada esteatohepatitis no alcohólica (EHNA), la que incluye inflamación lobular, balonamiento hepático y, en algunos casos, se asocia con fibrosis hepática. La creciente prevalencia de la EHGNA asociada a la dieta, especialmente aquellas ricas en grasas y carbohidratos, como la fructosa, ha orientado el enfoque de esta investigación. Nuestro objetivo fue analizar cómo la suplementación de fructosa, junto a una dieta alta en grasas, contribuye a la progresión desde EHGNA a EHNA, evaluando su efecto en marcadores lipogénicos y fibróticos. Ratones macho de la cepa C57BL/6 (n=9) fueron alimentados con dieta alta en grasa (DAG) (n=5) o dieta alta en grasa más fructosa (DAG+F) (n=4) durante 17 semanas. Se evaluaron parámetros generales (peso corporal, de tejido adiposo y hepático), niveles de glicemia e insulinemia, HOMA, histología hepática y adiposa; niveles de expresión de marcadores inflamatorios (TNF-α e IL-1b), lipogénicos (SREBP-1c, FAS) y fibrogénicos (TGF-β, α-SMA). La suplementación con fructosa no generó diferencias respecto al peso corporal, peso del hígado o del tejido adiposo, ni sobre la glicemia basal y el HOMA-IR en comparación con la DAG, pero incrementó los niveles de insulina. Además, indujo esteatosis macrovesicular, junto con un incremento en el balonamiento celular, inflamación lobulillar y fibrosis. Concluimos que la suplementación de fructosa junto con la DAG indujo un estado pre-fibrótico, caracterizado por el incremento de α-SMA y de marcadores lipogénicos.
Palabras clave: Esteatohepatitis; Fructosa; Lipogénesis; Resistencia a la insulina.
Abstract: Non-alcoholic fatty liver disease (NAFLD) ranges from a simple accumulation of neutral lipids, triacylglycerides (TAG) and cholesterol in more than 5% of hepatocytes, to a more advanced form called non-alcoholic steatohepatitis (NASH), which includes lobular inflammation, hepatic ballooning and, in some cases, is associated with hepatic fibrosis. The increasing prevalence of NASH associated with diet, especially those rich in fats and carbohydrates, such as fructose, has guided the focus of this research. Our aim was to analyze how fructose supplementation, together with a high-fat diet, contributes to the progression from NAFLD to NASH, evaluating its effect on lipogenic and fibrotic markers. Male C57BL/6 strain mice (n=9) were fed high-fat diet (HFD) (n=5) or high-fat diet plus fructose (HFD+F) (n=4) for 17 weeks. General parameters (body, adipose and liver tissue weight), glycemia and insulinemia levels, HOMA, liver and adipose histology; expression levels of inflammatory (TNF-α and IL-1b), lipogenic (SREBP-1c, FAS) and fibrogenic (TGF-β, α-SMA) markers were evaluated. Fructose supplementation did not generate differences with respect to body weight, liver or adipose tissue weight, nor on basal glycemia and HOMA-IR compared to DAG, but increased insulin levels. In addition, it induced macrovesicular steatosis, along with increased cell ballooning, lobular inflammation and fibrosis. We conclude that fructose supplementation together with DAG induced a pre-fibrotic state, characterized by increased α-SMA and lipogenic markers.
Keywords: Steatohepatitis, Lipogenesis, Fructose, Insulin resistance.
Introducción
La enfermedad de hígado graso no alcohólico (EHGNA) abarca una serie de trastornos metabólicos hepáticos, desde una acumulación simple de lípidos neutros, triacilglicéridos (TAG) y colesterol en más del 5% de los hepatocitos1, conocida como esteatosis simple, hasta una forma más avanzada llamada esteatohepatitis no alcohólica (EHNA), la que incluye inflamación lobular, balonamiento hepático y, en algunos casos, se asocia con fibrosis hepática2. La EHGNA es una importante causa de enfermedad hepática, con un 30,05% de prevalencia global y un 44,37% en Latinoamérica3.
Los principales factores de riesgo del desarrollo de EHGNA y progreso a EHNA, son la obesidad, resistencia a la insulina (RI), diabetes mellitus tipo 2, sedentarismo y el consumo de dietas altas en grasas y carbohidratos2.
A nivel hepático, la RI induce la lipogénesis de novo a través del aumento de expresión y actividad de la proteína de unión al elemento regulador de esterol (SREBP-1c). El aumento de SREBP-1c estimula la transcripción y actividad de la enzima sintasa de ácidos grasos (FAS)4, contribuyendo a la acumulación intracelular de lípidos4. Estos cambios afectan la β-oxidación, promoviendo un ambiente lipotóxico asociado a la aparición de estrés oxidativo, estrés de retículo endoplásmico, activación del sistema inmunitario innato y cambios mediados por citoquinas proinflamatorias5, tales como interleuquina (IL)- 6, factor de necrosis tumoral (TNF)-α e IL-1β.
La fructosa, corresponde a un factor de riesgo para el desarrollo de EGNHA y progresión de EHNA. La mayor parte de la fructosa ingerida no se metaboliza en el intestino, sino que es transportada a través de la vena porta hacia el hígado, actuando como un regulador nutricional y afectando la expresión de diversos genes relacionados la lipogénesis de novo, la gluconeogénesis, la glucólisis y la lipólisis, lo cual agrava el daño causado por la RI6.
Durante la progresión a EHNA, se observa un incremento en la expresión y liberación del factor de crecimiento transformante (TGF)-β, cuyo aumento se relaciona con la estimulación de las células estrelladas hepáticas (HSC, por sus siglas en inglés Hepatic stellate cells)7, activación clave para el desarrollo de fibrosis, que caracteriza a la EHNA. Las HSC activadas expresan alfa actina (α-SMA) y otras sustancias quimiotácticas capaces de reclutar células inflamatorias, lo que les permite reparar el daño hepático a partir de la producción de matriz extracelular que se traducirá finalmente en fibrosis hepátic8. En un estudio realizado en ratones con deficiencia de IL-1α e IL-1β, se observó una protección en contra de la inflamación después de inducir esteatosis por la dieta, lo que sugiere que estas citocinas proinflamatorias podrían estar implicadas de manera crucial en el desarrollo de la inflamación del hígado. Además, ratones knockout para IL-1α e IL-1β mostraron niveles más bajos de ARNm de genes relacionados con la inflamación y la fibrosis, incluyendo una marcada reducción en los niveles del TGF-β, lo que destaca la estrecha relación fisiopatológica entre la inflamación y la fibrosi9.
La creciente prevalencia de la EHGNA asociada a la dieta, especialmente aquellas ricas en grasas y carbohidratos, como la fructosa, ha orientado el enfoque de esta investigación. Nuestro objetivo es analizar, a través de la observación de cambios en marcadores cruciales en el desarrollo de la EHGNA, cómo estos factores dietéticos pueden influir en la patogénesis de la enfermedad.
Material y Métodos
Modelo experimental: Se utilizaron ratones macho cepa C57BL/6 obtenidos desde el Bioterio Central de la Facultad de Medicina de la Universidad de Chile. Se mantuvieron en condiciones de temperatura constate entre 21-23 °C y ciclos de luz/oscuridad de 12 horas y 12 horas con acceso libre a alimentación y agua. Protocolos de manejo y cuidado de animales experimentales se ajustan a la guía para el cuidado y uso de animales de laboratorio (National Academy of Sciences, NIH Publication 6-23, revised 1985) y fueron aprobados por el Comité de Bioética sobre investigación en animales de la Facultad de Medicina de la Universidad de Chile (CBA 1190FMUCH). Los animales de peso inicial 12-14 g, fueron separados aleatoriamente en 2 grupos experimentales y alimentados con distintas dietas durante 17 semanas: Dieta alta en grasa (DAG) (n=5) (Research Diet INC D12492, USA; 60% lípidos, 20% proteínas, 20% carbohidratos) y Dieta alta en grasa más fructosa (DAG+F) (n=4) (Merck, CAS-No 57-48-7, solución acuosa al 30% masa/volumen).
Histología hígado y tejido adiposo: Se utilizaron las técnicas hematoxilina eosina y tricrómico Sirius Red, para análisis histológico y de fibrosis, respectivamente. A partir de microfotografías de cortes de hígado (10 fotos por cada animal), se evaluó el grado de EHGNA, según el sistema de puntaje de Actividad de EHGNA (NAS, por sus siglas en inglés NAFLD Activity Score)10. El puntaje NAS (0-8) se calculó a partir de la suma de las puntuaciones individuales para esteatosis (0-3), inflamación lobular (0-2) y balonamiento (0-2).
PCR en tiempo real (qPCR): Se evaluó la expresión de ARNm hepático de TGF-β, α-SMA, SREBP-1c, FAS, TNF- α e IL-1b mediante qPCR (Stratagene Mx3000p qPCR System (Agilent Technologies)), utilizando el reactivo EvaGreen® (5X HOT FIREPol® EvaGreen® qPCR Mix Plus, Solis Biodyne) según las instrucciones del fabricante. Se extrajo el ARN total de hígado congelado usando el Kit E.Z.N.A de ARN total I, según instrucciones del fabricante (Omega bio-tek). Se obtuvo ADNc utilizando transcriptasa inversa Superscript II (Invitrogen Corp., Carlsbad, CA, EE.UU.). Las secuencias de los partidores sentido (F) y antisentido (R) para cada gen fueron las siguientes: TGF-β (F: “TGAGTGGCTGTCTTTTGACG”, R : “A G T G A G C G C T G A AT C G A A A G ” ) , α - S M A ( F : “ G G G C C A A A A A G A C A G C T A T G ” , R : “ G C C A G A T C T T T T C C A T G T C G ” ) , S R E B P - 1 c ( F : “ C C G G G G A A C T T T T C C T T A A C ” , R : “ A A A A C C G C T G T G T C C A G T T C ” ) , F A S ( F : “ T T T G G G A A G T C C T C A G C A A C ” , R : “ A T G T C A A C C C T A A C G C C T T G ” ) , T N F - α ( F : “ A A A T G G G C T C C C T C T A T C A G T T C ” , R : “ T C T G C T T G G T G G T T T G C T A C G A C ” ) , I L - 1 b ( F : “ T G A A G C A G C T A T G G C A A C T G ” , R : “GGTCAAAGGTTTGGAAGCAG”). El análisis de los resultados se realizó a través del algoritmo Delta-Delta Ct (2-Δ ΔCt)11.
Evaluación inmunohistoquímica de la expresión de SREBP-1c y FAS: El protocolo para la inmunohistoquímica de SREBP-1c (SC8984, Santa Cruz) y FAS (SC20140, Santa Cruz), se realizó a partir del presentado en el trabajo de Juretić, et al, 202112.
Glicemia basal y Curva de tolerancia a la glucosa: Se extrajeron muestras de sangre de ratones en ayunas mediante la escisión del extremo de la cola. Luego, se inyectó 1,5 mg de glucosa/g de peso de forma intraperitoneal, y se midieron los niveles de glucosa plasmática a los 15, 30, 60 y 120 minutos.
Insulinemia y HOMA-IR: Se utilizó el Kit Sigma-Aldrich Rat/ Mouse Insulin ELISA (Catálogo No. EZRMI-13K), siguiendo las instrucciones del fabricante y evaluando la absorbancia a 450 y 590 mm (BioTek® SynergyTM 2). El índice HOMA-IR se calculó según la fórmula [glicemia sérica en ayunas (mmol/L) × insulina sérica en ayunas (μU/ml) /22,5]13,14,15.
Análisis estadísticos: Los resultados se expresaron como promedios ± error estándar medio (SEM) utilizando el software GraphPad Prism 9.0 ©. Los análisis se realizaron mediante la prueba paramétrica t de Student, considerando significativo un valor de p < 0,05.
Resultados
- Parámetros generales. Después de un período de 17 semanas de tratamiento, se evaluaron los parámetros generales de cada grupo experimental. No se evidenciaron diferencias (p > 0,05) entre los pesos corporales finales ni en los pesos de los hígados y el tejido adiposo entre los grupos DAG y DAG+F (Tabla 1). No se observó diferencia (p > 0,05) en la glicemia basal entre los grupos DAG y DAG+F, pero si se encontró un incremento (p < 0,05) en la insulinemia de un 176% en el grupo DAG+F, respecto al grupo DAG. El análisis del índice HOMA-IR, indica una RI avanzada en el grupo DAG+F, a comparación del grupo DAG, cuyo valor le asigna una clasificación de RI en fase inicial o temprana (Tabla 1).
- Alteraciones del tejido hepático y adiposo, y detección
de fibrosis. El grupo DAG, presentó gotas lipídicas del
tipo macrovesicular, con bajo grado de balonamiento, sin
inflamación ni signos de fibrosis, lo que lo clasifica como
una esteatosis simple (según Score NAS). A diferencia del grupo DAG+F, donde se observaron mayores alteraciones
del tejido hepático, con predominancia de vesículas
lipídicas de tipo microvesicular, inflamación lobular leve
y balonamiento hepático (Figura 1A). Sin embargo, las
alteraciones del grupo DAG+F no alcanzan el puntaje
necesario para ser clasificado como EHNA (según Score
NAS), quedando calificado como EHNA indeterminada (Tabla
2). El método tricrómico Sirius Red, en el grupo DAG+F
detecta presencia de fibras colágenas en niveles basales
sin alcanzar una magnitud que permita categorizarlo como
fibrosis, mientras que no se evidencia tinción positiva para
fibras colágenas en el grupo DAG. (Figura 1B).
En relación con los adipocitos, en ambos grupos se observa hipertrofia del tejido adiposo, núcleos aplanados y desplazados a la periferia. En el grupo DAG se evidencia mayor inflamación en el tejido y signos de muerte celular dado por la presencia de estructuras en “forma de corona”, a comparación del grupo DAG+F (Figura 2A). Se observó aumento significativo (p<0,05) de un 8,5% del área media de adipocitos en el grupo DAG respecto al grupo DAG+F (Figura 2B). - Expresión molecular de marcadores fibrogénicos (TGF-β y α-SMA) e inflamatorios (TNF-α e IL-1β). Los resultados del análisis de la expresión de ARNm de TGF-β y α-SMA en el tejido hepático revelaron diferencias significativas (p < 0,05) entre DAG y DAG+F. La expresión de TGF-β mostró un aumento (p < 0,05) de un 91% en el grupo DAG en comparación con el grupo DAG+F. Por otro lado, se observó un incremento significativo (p < 0,05) de un 115% en la expresión de α-SMA en el grupo DAG+F con relación al grupo DAG. (Figura 3). La expresión hepática del ARNm para TNF-α e IL-1β, no mostró cambios significativos entre los grupos DAG y DAG+F, pero si se puede observar una tendencia al aumento de ambos marcadores en el grupo DAG+F (Figura 3).
- Evaluación de la expresión proteica y molecular de los marcadores lipogénicos SREBP-1c y FAS. Los resultados de la expresión hepática del ARNm de SREBP-1c no demostraron una diferencia estadísticamente significativa (p>0,05) entre los grupos DAG y DAG+F, sin embargo, se evidencia una tendencia al aumento de la expresión del marcador en el grupo DAG+F (Figura 4A). La inmunotinción positiva para SREBP-1c mostró una localización nuclear (Figura 4C) y no se observó diferencia significativa (p>0,05) en el promedio de núcleos positivos entre los grupos DAG y DAG+F (Figura 4B).
Respecto a la expresión hepática del ARNm de FAS, se observó un incremento (p<0,05) del 112,3% en el grupo DAG+F respecto al grupo DAG (Figura 5A). La inmunotinción positiva para FAS mostró una localización citoplasmática (Figura 5C) y se observó un aumento (p<0,05) en el porcentaje de células positivas para FAS del 209% en el grupo DAG+F, a comparación del grupo DAG (Figura 5B).
Tabla 1. Parámetros generales.
| Parámetros | DAG | DAG+F | P |
| Peso corporal inicial (g) |
18,7 ± 0,4 | 19,8 ± 0,6 | >0,05 |
| Peso corporal final (g) |
42,5 ± 2,5 | 40,5 ± 2,1 | >0,05 |
| Peso hígado (g) |
1,5 ± 0,2 | 1,4 ± 0,09 | >0,05 |
| (Peso hígado/peso corporal) x 100 | 3,5 ± 0,22 | 3,5 ± 0,11 | >0,05 |
| Peso tejido adiposo (g) | 2,1 ± 0,2 | 2,3 ± 0,1 | >0,05 |
| (Peso tejido adiposo/peso corporal) x 100 |
4,9 ± 0,7 | 5,1 ± 0,4 | >0,05 |
| Glicemia basal (mg/dL) | 206,5 ± 14,6 | 179 ± 3 | >0,05 |
| Insulinemia (μU/mL) | 5,0 ± 1,7 * | 13,8 ± 0,5 * | =0,0071 |
| HOMA-IR | 2,5 ± 0,8 | 5,3 ± 0,8 | >0,05 |
Los valores corresponden a promedios ± SEM (p<0,05 t de Student). DAG: Dieta alta en grasa (n=5); DAG+F: Dieta alta en grasa + Fructosa (n=4).
Tabla 2. Score NAS.
| Tratamiento | Esteatosis | Balonamiento | Inflamación lobulillar |
Fibrosis | Diagnóstico |
| DAG | 1,25 ± 0,25 | 0,25 ± 0,25 | 0,5 ± 0,3 | 0 | Esteatosis simple |
| DAG+F | 2,33 ± 0,24 | 1,33 ± 0,24 | 1 | 0,66 ± 0,24 | EHNA Indeterminado |
Los valores corresponden a promedios ± SEM. DAG: Dieta alta en grasa (n=5); DAG+F: Dieta alta en grasa + Fructosa (n=4).
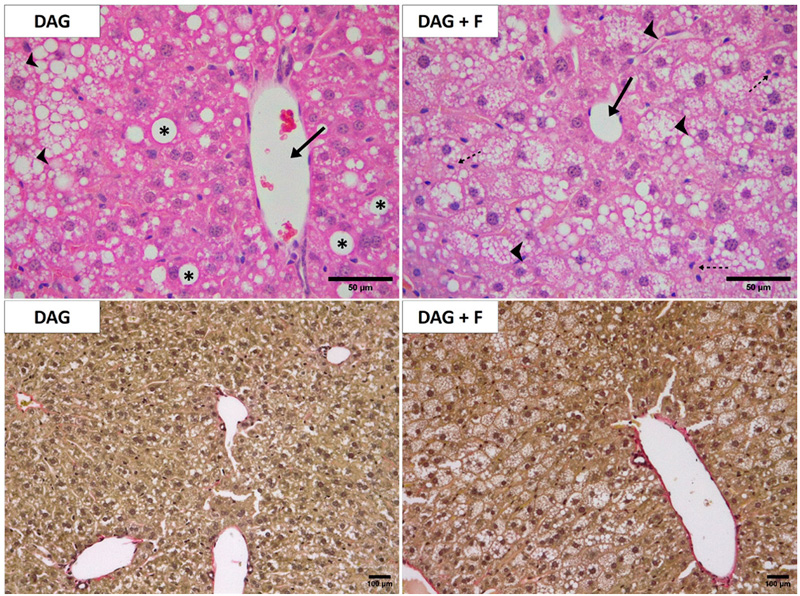 Figura 1: (A) Histología hepática: Las flechas continuas indican las venas
centrolobulillares. Punta de flechas señalan hepatocitos con balonamiento y
microvesículas lipídicas. Los asteriscos marcan las macrovesículas lipídicas
presentes en los citoplasmas de los hepatocitos. Flechas discontinuas señalan
células inflamatorias. Hematoxilina Eosina. Escala 50 μm. (B) Detección de fibrosis:
La tinción rojiza indica presencia de fibras colágenas. Tricrómico Sirius Red.
Escala 100 μm. DAG: Dieta alta en grasa; DAG+F: Dieta alta en grasa + Fructosa.
Figura 1: (A) Histología hepática: Las flechas continuas indican las venas
centrolobulillares. Punta de flechas señalan hepatocitos con balonamiento y
microvesículas lipídicas. Los asteriscos marcan las macrovesículas lipídicas
presentes en los citoplasmas de los hepatocitos. Flechas discontinuas señalan
células inflamatorias. Hematoxilina Eosina. Escala 50 μm. (B) Detección de fibrosis:
La tinción rojiza indica presencia de fibras colágenas. Tricrómico Sirius Red.
Escala 100 μm. DAG: Dieta alta en grasa; DAG+F: Dieta alta en grasa + Fructosa. Figura 2: (A) Histología tejido adiposo: Se observa hipertrofia de los
adipocitos en ambos grupos experimentales. La flecha señala una
“forma en corona” en el tejido adiposo del grupo DAG. Escala 200 μm.
(B) Cuantificación del área media de adipocitos: Valores expresados
como promedio ± SEM. ****p < 0,0001 (P<0,05 t de Student). DAG:
Dieta alta en grasa (n=5); DAG+F: Dieta alta en grasa + Fructosa (n=4).
Figura 2: (A) Histología tejido adiposo: Se observa hipertrofia de los
adipocitos en ambos grupos experimentales. La flecha señala una
“forma en corona” en el tejido adiposo del grupo DAG. Escala 200 μm.
(B) Cuantificación del área media de adipocitos: Valores expresados
como promedio ± SEM. ****p < 0,0001 (P<0,05 t de Student). DAG:
Dieta alta en grasa (n=5); DAG+F: Dieta alta en grasa + Fructosa (n=4).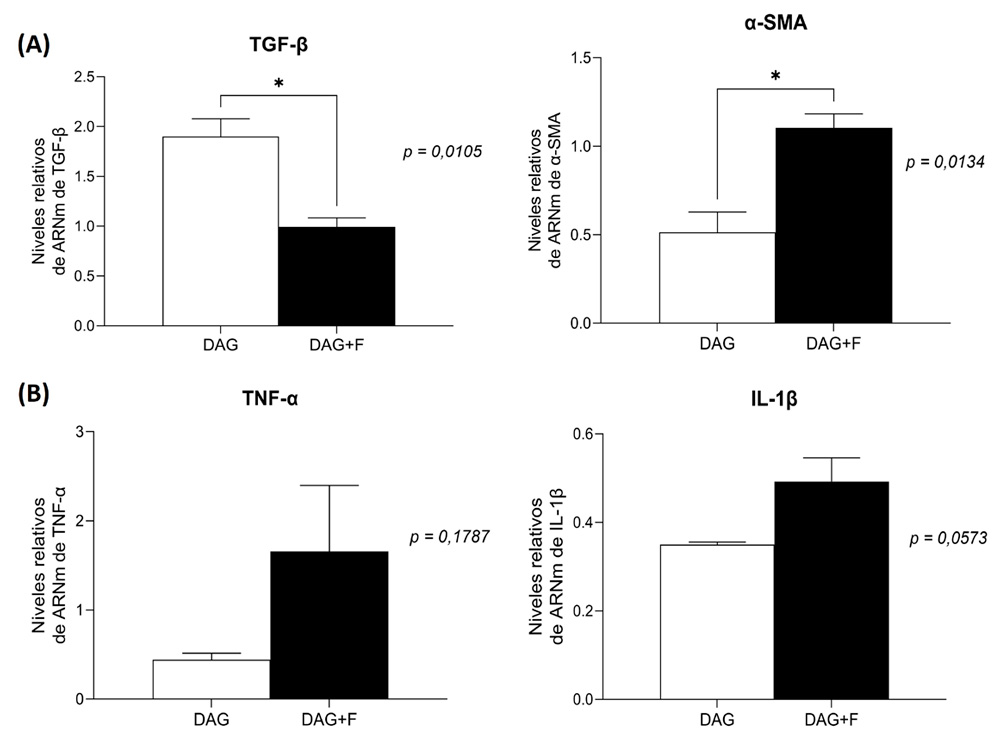 Figura 3: (A) Niveles del ARNm hepático de marcadores fibrogénicos TGF-β
y α-SMA y (B) Niveles del ARNm hepático de marcadores inflamatorios
TNF-α y IL-1b, expresados como promedio ± SEM. *p < 0,05 (P<0,05 t
de Student). DAG: Dieta alta en grasa (n=5); DAG+F: Dieta alta en grasa
+ Fructosa (n=4).
Figura 3: (A) Niveles del ARNm hepático de marcadores fibrogénicos TGF-β
y α-SMA y (B) Niveles del ARNm hepático de marcadores inflamatorios
TNF-α y IL-1b, expresados como promedio ± SEM. *p < 0,05 (P<0,05 t
de Student). DAG: Dieta alta en grasa (n=5); DAG+F: Dieta alta en grasa
+ Fructosa (n=4).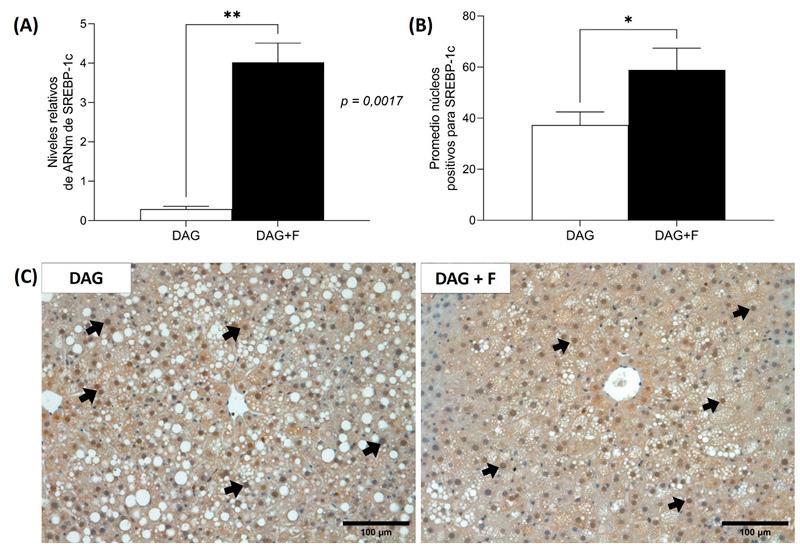 Figura 4: Niveles del ARNm y (B) Cuantificación de los núcleos positivos
para SREBP-1c: Valores expresados como promedio ± SEM. *p < 0,05, **p
< 0,01 (P<0,05 t de Student). (C) Inmunotinción para SREBP-1c. Flechas
señalan núcleos positivos para SREBP-1c. Escala 100 μm. DAG: Dieta alta
en grasa (n=5); DAG+F: Dieta alta en grasa + Fructosa (n=4).
Figura 4: Niveles del ARNm y (B) Cuantificación de los núcleos positivos
para SREBP-1c: Valores expresados como promedio ± SEM. *p < 0,05, **p
< 0,01 (P<0,05 t de Student). (C) Inmunotinción para SREBP-1c. Flechas
señalan núcleos positivos para SREBP-1c. Escala 100 μm. DAG: Dieta alta
en grasa (n=5); DAG+F: Dieta alta en grasa + Fructosa (n=4). Figura 5: (A) Niveles del A RNm y (B) Cuantificación de las células
positivas para FAS: Valores expresados como promedio ± SEM. **p <
0,01, ****p < 0,0001 (P < 0,05 t de Student). (C) Inmunotinción para FAS:
Flechas señalan hepatocitos positivos para FAS. Escala 100 μm. DAG:
Dieta alta en grasa (n=5); DAG+F: Dieta alta en grasa + Fructosa (n=4).
Figura 5: (A) Niveles del A RNm y (B) Cuantificación de las células
positivas para FAS: Valores expresados como promedio ± SEM. **p <
0,01, ****p < 0,0001 (P < 0,05 t de Student). (C) Inmunotinción para FAS:
Flechas señalan hepatocitos positivos para FAS. Escala 100 μm. DAG:
Dieta alta en grasa (n=5); DAG+F: Dieta alta en grasa + Fructosa (n=4).Discusión
Diversos estudios han propuesto que la fructosa aumenta la lipogénesis hepática y promueve la RI, contribuyendo así al desarrollo de la EHGNA16,17. Si bien la DAG es ampliamente utilizada como modelo para inducir la esteatosis hepática en animales18, esta no induce EHNA. Es en este contexto, que el objetivo del presente estudio fue investigar el impacto de la ingesta de fructosa junto a una DAG sobre parámetros inflamatorios y fibróticos, para evaluar su rol en la progresión de la EGNHA a estados más complejos y así estandarizar este modelo de estudio.
El consumo de fructosa junto a DAG por 17 semanas no generó diferencias respecto al peso corporal, peso del hígado, del tejido adiposo, ni sobre la glicemia basal de los animales alimentados sólo con DAG. Sin embargo y de manera interesante, la suplementación con fructosa incrementó los niveles de insulina, aunque esta diferencia no se vio reflejada en los niveles de HOMA-IR. Este aumento de los niveles de insulina podría estar explicado por una sobrecompensación en la secreción de insulina por parte de las células β pancreáticas disfuncionales, sugiriendo que la ingesta de fructosa en estas condiciones podría inducir un estado de prediabetes. Otros estudios han observado que la suplementación con fructosa (al 10%) por 3 semanas reduce la masa de células β sin alterar la glicemia19, debido a la capacidad residual de las células β para producir insulina. Otros estudios han reforzado la evidencia de que una alimentación alta en grasas y fructosa induce alteraciones en el tamaño de los grupos de células β y anomalías en las funciones secretoras del páncreas20. Además, se ha observado que la fructosa desencadena trastornos metabólicos, oxidación e inflamación a nivel sistémico20.
A nivel histológico, tanto la dieta DAG como la DAG+F indujeron esteatosis hepática. Sin embargo, la suplementación con fructosa indujo además un incremento en el balonamiento celular, inflamación lobulillar y fibrosis, correspondiendo a un estado de EHNA indeterminado. De forma interesante, la fructosa indujo esteatosis macrovesicular, mientras que los animales alimentados con DAG por sí sola, presentaron esteatosis microvesicular. La esteatosis macrovesicular ha sido relacionada fuertemente con la aparición de inflamación y fibrosis21. Otro resultado interesante fue que, si bien la fructosa no indujo diferencia en el peso de los animales, sí observamos diferencias en la histología del tejido adiposo. Interesantemente, observamos que los animales alimentados con DAG+F presentaron tamaño de adipocitos significativamente menores que los animales alimentados sólo con DAG. Según la literatura, la ingesta de dieta DAG genera un estado de hipertrofia en el TA, en donde los adipocitos aumentan de tamaño más que en cantidad. Nuestros resultados sugieren que la fructosa junto con la DAG podría estar incrementando el tamaño del TA por otros mecanismos, como hiperplasia.
Se ha descrito que la suplementación de fructosa promueve un entorno proinflamatorio y exacerba la acumulación de lípidos en el hígado, lo que en conjunto llevan a la progresión de la EHGNA hacia EHNA. En este sentido, al evaluar marcadores inflamatorios hepáticos, encontramos una tendencia al aumento en los transcritos de TNF-α e IL-1β, pero no un aumento significativo. Este resultado concuerda con lo observado para los marcadores de fibrosis. Según los estudios histológicos, la fructosa junto con DAG por 17 semanas indujo un estado pre-fibrótico, donde además observamos incremento en los transcritos de α-SMA, pero, sorpresivamente, una disminución de TGF-β. Sin embargo, sería necesario estudiar los niveles proteicos para concluir si esta disminución es debida a la temporalidad de la medición, o si responde a algún estado previo de fibrosis. En este sentido, otros estudios han observado fibrosis luego de 32 semanas de tratamiento con dietas similares22. Por otro lado, la elevación de la expresión del ARNm de α-SMA, apoya el estado prematuro de fibrosis y sugiere que las células estrelladas hepáticas han sido activadas y han experimentado transdiferenciación, lo que ha sido observado previamente23. La lipotoxicidad hepática se manifiesta a través de la disminución este sentido, observamos un aumento significativo tanto en los transcritos como en los niveles proteicos de SREBP-1c y FAS, lo que reafirma lo descrito en la literatura24.
En conclusión, los resultados obtenidos en este estudio indican que el tratamiento de 17 semanas con DAG más fructosa induce un estado pro-fibrótico en el hígado, caracterizado por un aumento en la expresión de α-SMA, lo cual implicaría una promoción en la activación de las células estrelladas hepáticas.
Referencias
- Sheka AC, Adeyi O, Thompson J, Hameed B, Crawford PA, Ikramuddin S. Nonalcoholic Steatohepatitis: A Review. JAMA. 2020; 323(12): 1175-1183.
- Carvallo P, Carvallo E, Barbosa-da-silva S, Mandarim-de-lacerda CA, Del sol M. NAFLD e ingesta de fructosa en altas concentraciones. Una revisión de la literatura. Int. J. Morphol. 2017; 35(2): 676-683.
- Younossi M, Golabi P, Paik M, Henry A, Van Dongen C, Henry L. The global epidemiology of nonalcoholic fatty liver disease (NAFLD) and nonalcoholic steatohepatitis (NASH): A systematic review. Hepatology. 2023; 77(4): 335-1347.
- Kohjima M, Higuchi N, Kato M, Kotoh K, Yoshimoto T, Fujino T, et al. SREBP-1c, regulated by the insulin and AMPK signaling pathways, plays a role in nonalcoholic fatty liver disease. Int J Mol Med. 2008; 21(4): 507- 511.
- Nguyen TAT, Sanyal AJ. Pathophysiology guided treatment of nonalcoholic steatohepatitis. J Gastroenterol Hepatol. 2012; 27(Suppl 2): 58-64.
- Roeb E, Weiskirchen R. Fructose and Non-Alcoholic Steatohepatitis. Front Pharmacol. 2021;12: 634344.
- Moreira R. Hepatic stellate cells and liver fibrosis. Arch Pathol Lab Med. 2007; 131(11): 1728-1734.
- Puche J, Saiman Y, Friedman S. Hepatic stellate cells and liver fibrosis. Compr Physiol. 2013; 3(4): 1473-1492.
- Kamari Y, Shaish A, Vax E, Shemesh S, Kandel-Kfir M, Arbel Y, et al. Lack of interleukin-1α or interleukin-1β inhibits transformation of steatosis to steatohepatitis and liver fibrosis in hypercholesterolemic mice. J Hepatol. 2011; 55(5): 1086-1094.
- Kleiner DE, Brunt EM, Van Natta M, et al, for the Nonalcoholic Steatohepatitis Clinical Research Network. Design and validation of a histological scoring system for nonalcoholic fatty liver disease. Hepatology. 2005; 41: 1313- 1321.
- Schmittgen T, Livak K. Analyzing real-time PCR data by the comparative C(T) method. Nat Protoc. 2008; 3(6): 1101-118.
- Juretić N, Sepúlveda R, D’Espessailles A, Vera DB, Cadagan C, de Miguel M, et al. Dietary alpha- and gamma-tocopherol (1:5 ratio) supplementation attenuates adipose tissue expansion, hepatic steatosis, and expression of inflammatory markers in a high-fat-diet-fed murine model. Nutrition. 2021; 85: 111139.
- Handelsman Y, Bloomgarden ZT, Grunberger G, et al. American association of clinical endocrinologists and american college of endocrinology - clinical practice guidelines for developing a diabetes mellitus comprehensive care plan – 2015. Endocr Pract. 2015; 21(Suppl 1): 1-87.
- Knopp J, Holder-Pearson L, Chase J. Insulin Units and Conversion Factors: A Story of Truth, Boots, and Faster Half-Truths. J Diabetes Sci and Technol. 2019; 13(3): 597-600.
- Matthews D, Hosker J, Rudenski A, et al. Homeostasis model assessment: insulin resistance and β-cell function from fasting plasma glucose and insulin concentrations in man. Diabetologia. 1985; 28(7): 412-419.
- Nseir W, Nassar F, Assy N. Soft drinks consumption and nonalcoholic fatty liver disease. World J Gastroenterol. 2010; 16(21): 2579-2588.
- Stricker S, Rudloff S, Geier A, Steveling A, Roeb E, Zimmer K.P. Fructose Consumption-Free Sugars and Their Health Effects. Dtsch Arztebl Int. 2021; 118(5): 71-77.
- Lau JKC, Zhang X, Yu J. Animal models of non-alcoholic fatty live disease: Current perspectives and recent advances. J Pathol. 2017; 241: 36-44.
- Maiztegui B, Borelli M.I, Raschia M.A, Del Zotto H, Gagliardino J.J. Islet adaptive changes to fructose-induced insulin resistance: beta-cell mass, glucokinase, glucose metabolism, and insulin secretion. J Endocrinol. 2009; 200(2): 139-149.
- Zhao Y, Wang Q-Y, Zeng L-T, Wang J-J, Liu Z, Fan G-Q, et al. Long-Term High-Fat High-Fructose Diet Induces Type 2 Diabetes in Rats through Oxidative Stress. Nutrients. 2022; 14(11): 2181.
- Mulder P, Liang Wen, Wielinga P, Verschuren L, Toet K, Havekes L, et al. Macrovesicular steatosis is associated with development of lobular inflammation and fibrosis in diet-induced non-alcoholic steatohepatitis (NASH). Inflamm Cell Signal. 2015; 2: e804.
- Lozano I, Van der Werf R, Bietiger W, et al. High-fructose and high-fat dietinduced disorders in rats: Impact on diabetes risk, hepatic and vascular complications. Nutr Metab (Lond). 2016; 13: 15.
- Kohli R, Kirby M, Xanthakos S.A, Softic S, Feldstein A.E., Saxena V, et al. High-fructose, medium chain trans-fat diet induces liver fibrosis and elevates plasma coenzyme Q9 in a novel murine model of obesity and nonalcoholic steatohepatitis. Hepatol. 2010; 52(3): 934-944.
- Schultz A, Neil D, Aguila M, Mandarim-de-Lacerda C. Hepatic Adverse Effects of Fructose Consumption Independent of Overweight/Obesity. Int J Mol Sci. 2013; 14(11): 21873-21886.