Comportamiento de la insulina plasmática y la respuesta metabólica después de un esfuerzo físico máximo en personas físicamente inactivas
Johnattan Cano M.1 ORCID: 0000-0003-4654-6335
Amanda Bentes S.2 ORCID: 0000-0001-5117-237X
Yanara Pavez E.3 ORCID: 0009-0002-3693-9418
Paola Rubilar S.3 ORCID: 0009-0007-7100-004X
Carolina Lavoz2 ORCID: 0000-0003-2606-2974
Pamela Ehrenfeld2 ORCID: 0000-0002-2519-757
Viviana Sandoval4,* ORCID: 0000-0001-6874-4434
Sergio Martínez-Huenchullán1,* ORCID: 0000-0002-6336-5571
Plasma insulin behavior and metabolic response after a maximal effort in physically inactive individuals
- Carrera de Kinesiología, Facultad de Odontología y Ciencias de la Rehabilitación, Universidad San Sebastián. Valdivia, Chile.
- Facultad de Medicina, Universidad Austral de Chile. Valdivia, Chile.
- Carrera de Tecnología Médica, Facultad de Medicina y Ciencia, Universidad San Sebastián. Valdivia, Chile.
- Carrera de Nutrición y Dietética, Facultad de Ciencias para el Cuidado de la Salud, Universidad San Sebastián. Valdivia, Chile.
- Dirección Médica, Unidad de Medicina Familiar nº 49. Instituto Mexicano del Seguro Social. Celaya Guanajuato, México.
*Correspondencia:
Viviana Sandoval
/ viviana.sandoval@uss.cl
Sergio Martínez-Huenchullán / sergio.martinez@uss.cl
General Lagos 1163, Valdivia, Chile
Financiamiento: Sociedad Chilena de Endocrinología y Diabetes (SOCHED 2023-01).
Recibido: 28-11-2024.
Aceptado: 20-01-2025.
Resumen. Introducción: La inactividad física, definida como realizar menos de 150
minutos de actividad física moderada o 75 minutos de actividad vigorosa
por semana, se asocia con enfermedades cardiometabólicas. El ejercicio
usualmente promueve disminuciones en la insulina circulante en individuos
sanos después del ejercicio. Sin embargo, estudios recientes sugieren que
esta respuesta puede depender del tipo e intensidad del ejercicio. Por tanto,
este estudio buscó comparar el fenotipo y perfil metabólico de adultos jóvenes
físicamente inactivos que presentaron respuestas insulínicas divergentes
(aumento o disminución) tras una prueba de esfuerzo máximo. Material y
Métodos: Este estudio cuasi-experimental incluyó a participantes físicamente
inactivos de entre 18 y 30 años, divididos según su respuesta de insulina
plasmática post-ejercicio (aumento o disminución). Se evaluaron medidas antropométricas,
composición corporal y marcadores metabólicos (e.g., glucosa,
HOMA-IR). Los participantes realizaron una prueba de esfuerzo máximo en
cicloergómetro hasta la fatiga, con medidas fisiológicas y bioquímicas antes
y después del ejercicio. Resultados: De los 21 participantes, aquellos con
aumento en la insulina post-ejercicio presentaron menor peso corporal, IMC
y circunferencia cintura-cadera en comparación con quienes disminuyeron
sus niveles de insulina (p<0,05). No se observaron diferencias en la respuesta
cardiorrespiratoria o percepción de esfuerzo entre los grupos. El aumento de
la insulina post-ejercicio se asoció con niveles más altos de glucosa e índice
HOMA-IR, sugiriendo mayor resistencia a la insulina sistémica (p<0,05).
Conclusión: En individuos físicamente inactivos, la respuesta de la insulina al
ejercicio máximo varía y se asocia con características fenotípicas y metabólicas específicas. Esta variabilidad en la respuesta insulínica destaca la influencia
de la composición corporal y el estado metabólico en la adaptación al ejercicio,
por lo que estudios futuros deberían explorar los mecanismos detrás
de estas asociaciones.
Palabras clave: Ejercicio; Fatiga; Insulina.
Abstract:
Introduction: Physical inactivity, defined as performing less than 150 minutes
of moderate or 75 minutes of vigorous physical activity per week, is associated
with cardiometabolic diseases. Exercise typically promotes reductions in circulating
insulin levels in healthy individuals post-exercise. However, recent studies
suggest that this response may depend on the type and intensity of exercise.
Therefore, this study aimed to compare the phenotype and metabolic profile
of physically inactive young adults with divergent insulin responses (increase
or decrease) following a maximal exercise test. Materials and Methods: This
quasi-experimental study included physically inactive participants aged 18–30,
divided according to their post-exercise plasma insulin response (increase or
decrease). Anthropometric measurements, body composition, and metabolic
markers (e.g., glucose, HOMA-IR) were assessed. Participants performed a
maximal effort test on a cycle ergometer to fatigue, with physiological and
biochemical measurements taken pre- and post-exercise. Results: Of the 21
participants, those with increased post-exercise insulin had significantly lower
body weight, BMI, and waist-to-hip ratio compared to those who showed
decreased insulin levels (p<0.05). No differences were observed in the
cardiorespiratory response or perceived exertion between groups. Increased
post-exercise insulin was associated with higher glucose levels and HOMAIR,
suggesting greater systemic insulin resistance (p<0.05). Conclusion: In
physically inactive individuals, the insulin response to maximal exercise varies
and is associated with specific phenotypic and metabolic characteristics. This
variability in insulin response highlights the influence of body composition
and metabolic status on adaptation to exercise, suggesting that future studies
should explore the mechanisms behind these associations.
Keywords: Exercise; Fatigue; Insulin.
Introducción
La inactividad física se define como el no alcanzar los niveles de actividad espontánea mínimos para mantener una vida saludable. En tal sentido, este parámetro está definido por la Organización Mundial de la Salud como la realización de menos de 150 minutos/semana de actividad física de intensidad moderada y/o menos de 75 minutos/semana de actividad física vigorosa1. Por tanto, la mantención de una vida físicamente inactiva se asocia con un mayor riesgo de desarrollar una gama de enfermedades cardiorrespiratorias y metabólicas, entre las cuales destacan la hipertensión arterial, dislipidemia, obesidad, resistencia a la insulina y diabetes mellitus tipo 22,3.
En particular, la función de la insulina ha sido ampliamente estudiada tanto en situaciones de normalidad como disfunción respecto a su respuesta tras la realización de ejercicio físico4. Es así como se ha descrito que, en situaciones de normalidad, el ejercicio tanto de manera aguda5 como crónica6 provoca disminuciones de las concentraciones de insulina circulante en humanos, esto a modo de favorecer la utilización de macronutrientes por el músculo esquelético ante la realización de ejercicio4. Esto se ha extrapolado a poblaciones con disfunciones metabólicas, tales como resistencia a la insulina y diabetes mellitus tipo II, en donde se ha descrito que el ejercicio tiene la capacidad de regular los niveles glicémicos en humanos7 tanto por vías dependientes de insulina8 como independientes9 (i.e. traslocación de receptores GLUT4 a la membrana plasmática del músculo esquelético).
Sin embargo, en el último tiempo se ha cuestionado estos conceptos respecto al comportamiento de la insulina plasmática al realizar ejercicio. Es así como, recientemente, Steenberg, et al. describieron que en personas normopeso y moderadamente entrenadas, la realización de un ejercicio localizado en extensores de rodilla hasta la fatiga generó una reducción de la captación de glucosa en un 18%, lo cual fue relacionado a una disminución en un 37% de la captación de glucosa estimulada por insulina en los músculos no ejercitados10. De lo anterior se desprende que el aumento o disminución de la sensibilidad a insulina derivada a ejercicio dependería de la interacción entre los músculos reclutados y los que están en reposo, complejizando la interpretación de resultados en este ámbito.
Además, se ha incorporado el concepto de que el ejercicio de alta intensidad o hasta la fatiga en personas físicamente inactivas provocaría inflamación muscular, lo cual también atentaría contra la respuesta insulínica al ejercicio11. Por tanto, se desconoce si la respuesta de la insulina plasmática frente a la realización de un ejercicio físico máximo es homogénea en personas físicamente inactivas, y si esta respuesta depende de algunos factores fenotípicos de las personas. En este contexto, el presente estudio tuvo como objetivo comparar el fenotipo y función metabólica de personas que tuvieron comportamientos insulínicos disímiles tras una prueba de esfuerzo máximo en adultos jóvenes físicamente inactivos.
Material y Métodos
Diseño del estudio y consideraciones éticas
Este es un estudio cuasi-experimental, de comparación pre-post en donde el resultado primario fue comparar las respuestas metabólicas entre personas que aumentaron sus niveles plasmáticos de insulina tras un esfuerzo físico máximo versus los que desarrollaron un descenso en las concentraciones circulantes de esta proteína. Este estudio fue revisado y aprobado por el Comité de Ética del Servicio de Salud Los Ríos (código 222/2022) y todos los participantes leyeron y firmaron un consentimiento informado antes de participar del estudio. Este estudio está registrado en Clinicaltrial.gov (NCT06680713).
Participantes
Fueron incluidos personas entre 18 y 30 años, quienes eran físicamente inactivos (realizaban menos de 150 minutos/ semana de actividad física moderada y/o 75 minutos/semana de actividad física vigorosa) y no tenían contraindicaciones médicas para realizar actividad física. No fueron consideradas personas que estuviesen consumiendo medicamentos que influenciaran los niveles de glicemia o insulina sanguínea y/o que tuvieran efectos antinflamatorios. Dado que este estudio forma parte de un proyecto de mayor alcance (Single Maximal Exercise Session and the Metabolic Response of Physically Inactive Young Adults (EASY-Study)), el cálculo del tamaño muestral se realizó considerando los siguientes parámetros: una potencia del 95%, un valor alfa de 0,05, una diferencia de promedios pre y post intervención del factor de crecimiento de fibroblastos 21 (FGF21) de 50 pg/ ml (100 vs 150 pg/ml), con una desviación estándar para ambos grupos de 50 pg/ml12,13. Con dichos datos, el tamaño muestral es de 16 participantes, y considerando un 20% de drop-off, el tamaño final es de 20 participantes, en donde el reclutamiento fue por conveniencia.
Mediciones fenotípicas y prueba de esfuerzo máxima
La antropometría de los participantes fue valorada mediante el peso, talla, índice de masa corporal (IMC), circunferencia de cintura y el cálculo de los índices de cintura-cadera y cintura-estatura. El porcentaje de masa adiposa y muscular según el peso corporal fue valorado a través de bioimpedancia (InBody® 270). El nivel de actividad física se valoró mediante el cuestionario International Physical Activity Questionnaire (IPAQ), el cual está validado en población nacional14. Después de 5 minutos de reposo en sedente, se valoró la frecuencia cardiaca (FC) a través de una banda cardiaca Polar® H10, la presión arterial (PA) con un esfingomanómetro (OMRON®), saturación de oxígeno (SatO2, Nonin® Onyx Vantage) y la sensación subjetiva de esfuerzo (SSE) según la escala de Borg original15. Complementariamente, se valoró la oximetría muscular (SmO2) mediante la ubicación de un oxímetro inalámbrico (Moxy® 5), el cual fue ubicado en el vientre muscular del vasto lateral del cuádriceps derecho. La prueba de esfuerzo máximo consistió en una prueba de carga incremental en cicloergómetro o bicicleta estática, en el cual se elevó la carga de pedaleo en 30W cada 3 minutos, partiendo de una carga inicial de 30W hasta llegar al punto de fatiga, manteniendo una cadencia de pedaleo de 60 revoluciones por minuto (RPM). Durante la realización de la prueba se monitoreó cada minuto la FC, SatO2, SmO2 y SSE, mientras que la PA se midió al final de la prueba de esfuerzo (Figura 1). Los criterios de finalización de la prueba de esfuerzo fueron los siguientes: utilización de un 85% de la FC máxima o más, PA mayores a 180/100 mmHg, una SSE igual o mayor a 17 sobre 20, y/o la fatiga voluntaria o incapacidad de mantener la cadencia de pedaleo16. Inmediatamente posterior a la prueba, se midió la FC, PA, SatO2, SmO2 y SSE.
Exámenes de laboratorio
Previo a la realización de la prueba, a través de punción digital con lanceta estéril se valoró el nivel de lactato sanguíneo utilizando una tira reactiva específica para este fin y el aparato AccuTrend Plus®. Además, se tomó una muestra de sangre venosa desde la vena ante cubital en un tubo de 2 ml con EDTA y otro tubo sin anticoagulante (con gel separador) para la posterior medición plasmática del factor de crecimientos de fibroblastos 21 (FGF21) con un kit ELISA específico para aquello (RayBio® catálogo ELH-FGF21) y exámenes bioquímicos como glicemia, insulinemia y el cálculo del índice HOMA-IR, exámenes que fueron realizados en el Laboratorio Clínico de la Universidad Austral de Chile. Inmediatamente posterior a la realización de la prueba, se tomaron nuevas muestras de sangre venosa, además de una nueva valoración de los niveles de lactato sanguíneo post ejercicio. Se escogió este método debido a que las concentraciones de lactato son altamente dinámicas después del cese de ejercicio, en donde después de 4 minutos se ha descrito que sus concentraciones caen cerca de un 50% en personas sanas17.
Análisis estadístico
Las variables cuantitativas fueron resumidas en términos de medias y desviación estándar, mientras que las cualitativas en frecuencias absolutas. Para comprobar la normalidad de la distribución de los datos se utilizó la prueba de Kolmogorov-Smirnov. Las comparaciones entre los valores pre y post entrenamiento de las variables de interés se realizaron con la prueba de Wilcoxon. Para todos los análisis se consideró un valor p menor a 0,05 como estadísticamente significativo y se utilizaron los softwares SPSS versión 20 y GraphPad versión 8.
Resultados
21 voluntarios completaron el estudio de forma satisfactoria, en donde solo uno de ellos refirió nauseas al final del ejercicio, sensación que se reguló espontáneamente después de 5 minutos. En la figura 2 se representa la variabilidad interindividual del comportamiento de la insulina plasmática antes y después de la prueba en cicloergómetro hasta la fatiga. En la tabla 1 se describen las características generales de la muestra las cuales fueron agrupadas según mostraron ascensos o descensos de insulina posterior al ejercicio. Aquí, se observó que las personas que aumentaron su insulina plasmática tenían un peso, índice de masa corporal, circunferencias de cintura y cadera significativamente menores que sus pares (todos p<0,05). En términos de la respuesta cardiorrespiratoria y la percepción de esfuerzo frente al ejercicio no se observaron diferencias entre ambos grupos (Tabla 2; p>0,05). Sin embargo, en términos de marcadores metabólicos, las personas que tuvieron ascensos insulínicos post-ejercicio evidenciaron mayores niveles de glicemia y del índice HOMA-IR, sugerente al desarrollo de un aumento de la resistencia a la insulina sistémica (todos p<0,05; Tabla 3 y figura 3).
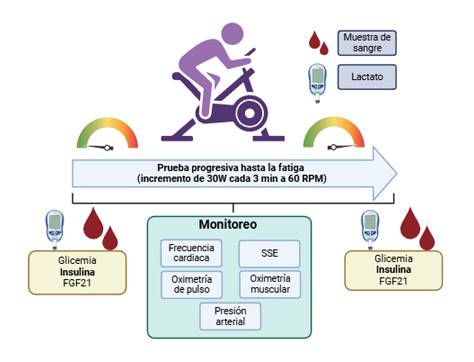
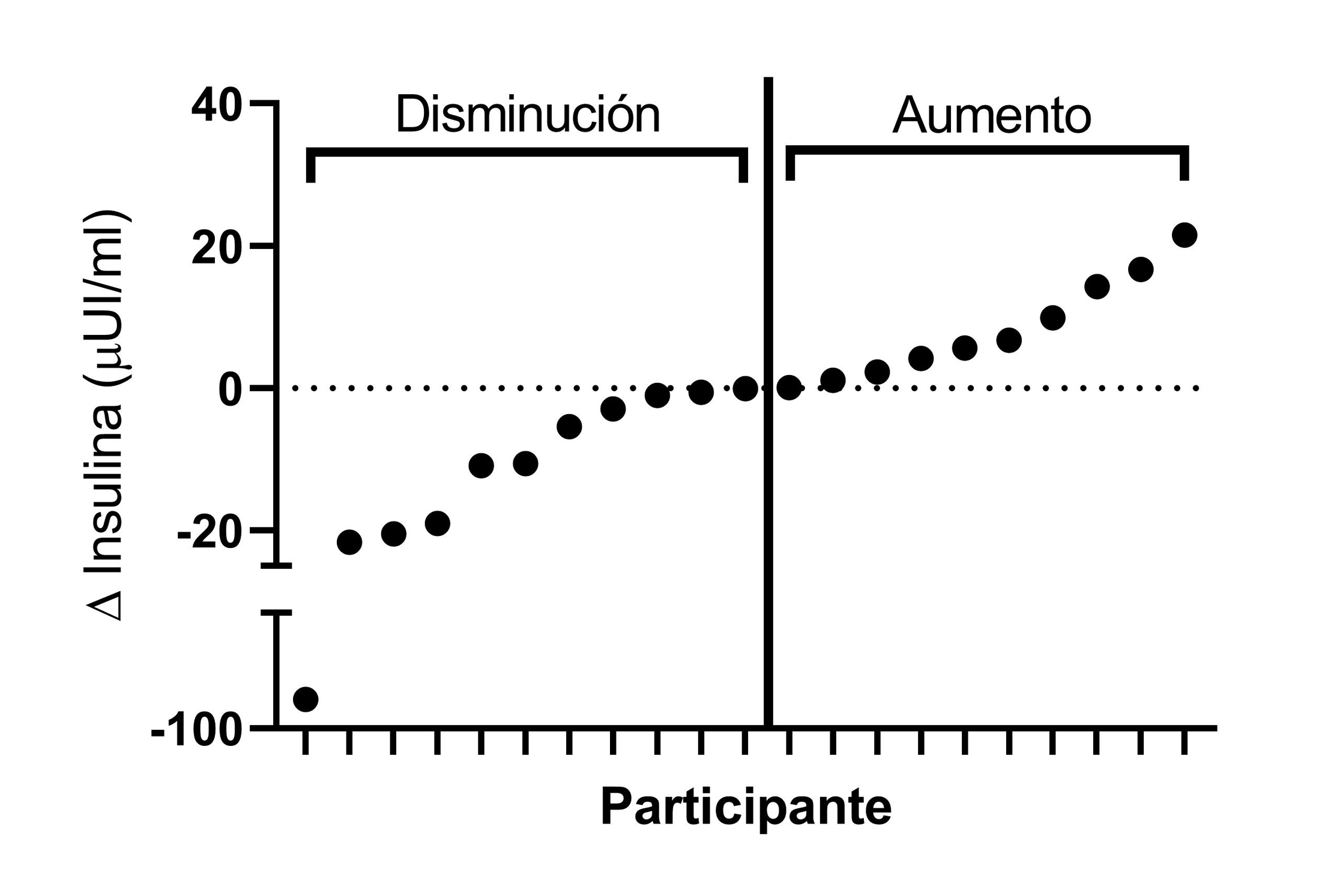
Tabla 1. Características generales de la muestra según cambio en insulina plasmática post-ejercicio.
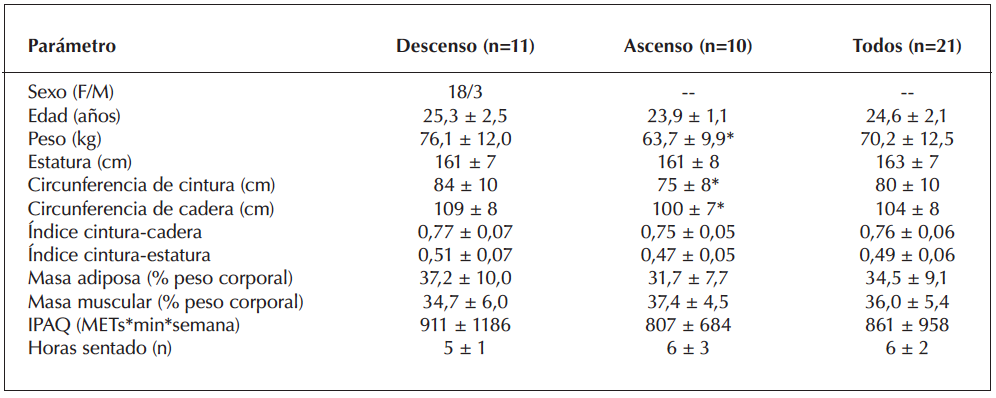
Abreviaciones: IMC: índice de masa corporal; IPAQ: international physical activity questionnaire
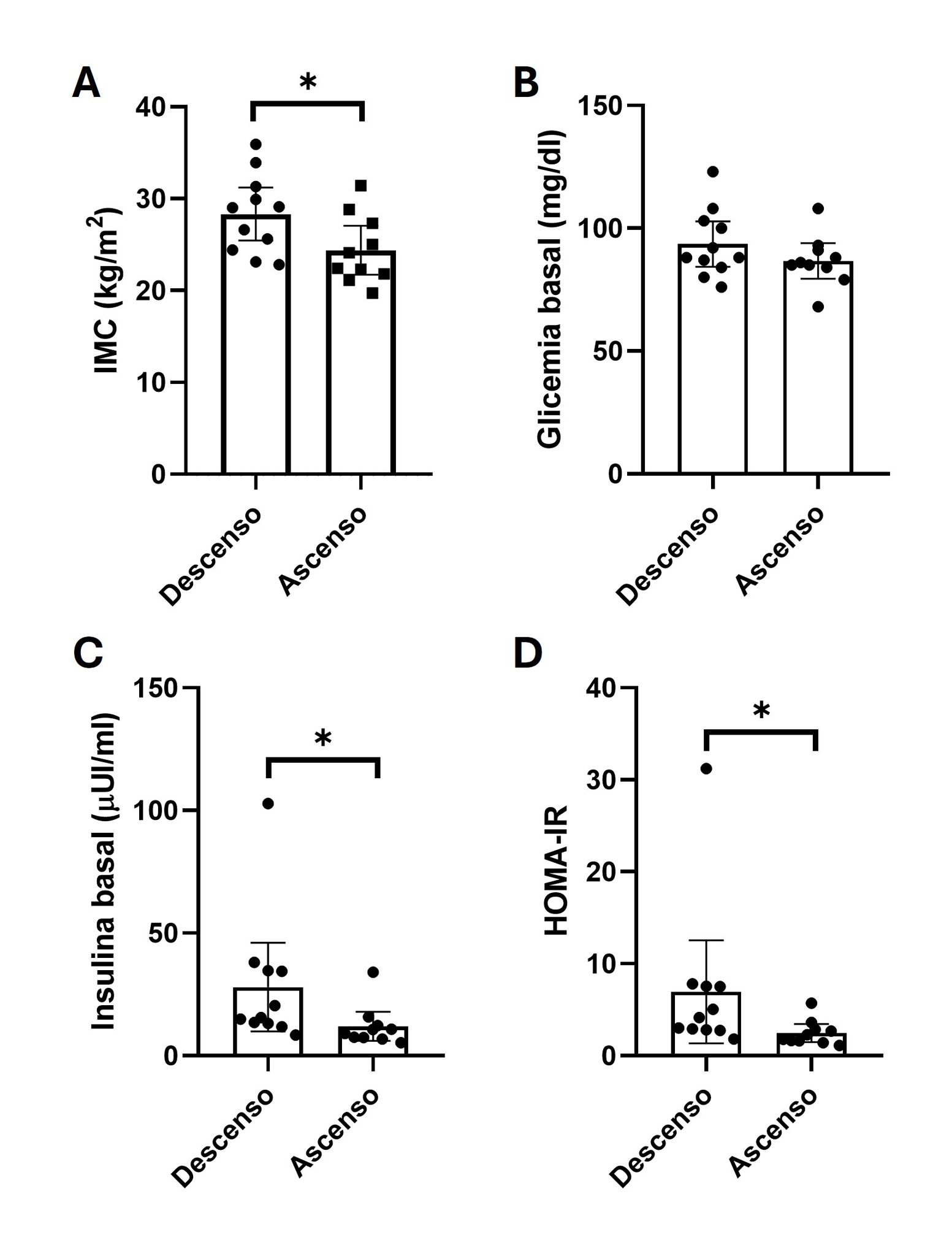 Figura 3: Diferencias entre las personas que mostraron descensos y ascensos de los niveles circulantes de insulina posterior al ejercicio físico. A) índice
de masa corporal (IMC); B) glicemia basal; C) insulina basal; d) HOMA-IR basal. Las barras indican el promedio y las barras de error el intervalo de
confianza al 95%. *: indica diferencias significativas entre grupos (p<0,05).
Figura 3: Diferencias entre las personas que mostraron descensos y ascensos de los niveles circulantes de insulina posterior al ejercicio físico. A) índice
de masa corporal (IMC); B) glicemia basal; C) insulina basal; d) HOMA-IR basal. Las barras indican el promedio y las barras de error el intervalo de
confianza al 95%. *: indica diferencias significativas entre grupos (p<0,05).
Tabla 2. Características sociodemográficas por tipo de dermatopatía.
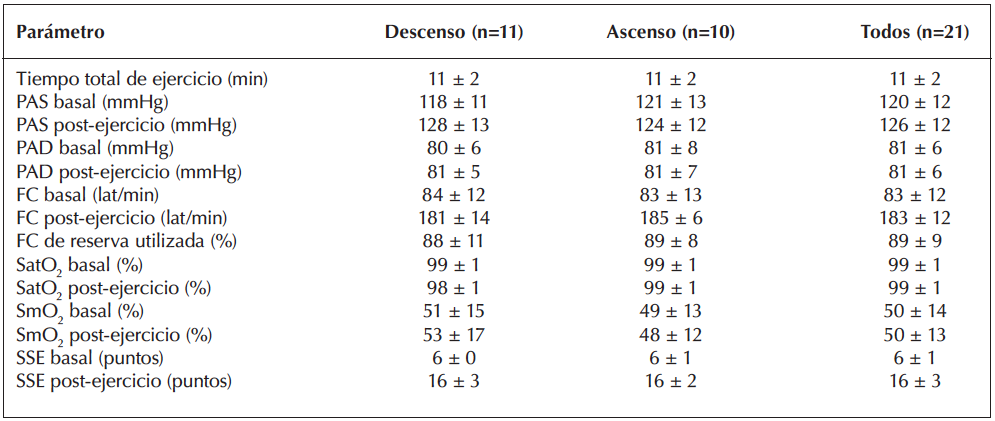
Abreviaciones: PAS: presión arterial sistólica; PAD: presión arterial diastólica; FC: frecuencia cardiaca; SatO2: saturación parcial de oxígeno; SmO2: saturación muscular de oxígeno; SSE: sensación subjetiva de esfuerzo.
Tabla 3. Marcadores metabólicos según cambio en insulina plasmática post-ejercicio.

Abreviaciones: Δ: diferencia entre valores basales y post-ejercicio; FGF21: factor de crecimiento de fibroblastos 21; HOMAIR: homeostatic model assessment for insulin resistance.
Discusión
El presente estudio tuvo por objetivo comparar el fenotipo y función metabólica de personas que tuvieron comportamientos insulínicos disímiles tras una prueba de esfuerzo máximo en adultos jóvenes físicamente inactivos. Como resultados principales se observó que, en este grupo de adultos jóvenes físicamente inactivos, las personas que desarrollaron aumentos en la insulina plasmática tenían tanto un fenotipo como un perfil metabólico más adecuado respecto a los pares que desarrollaron un descenso de la insulina plasmática. Tradicionalmente, se ha descrito que uno de los principales efectos del ejercicio físico sobre la insulina plasmática es su disminución, tanto durante la ejecución de este como durante las 48 horas posteriores, esto derivado a un efecto insulino-sensibilizador del ejercicio sobre el músculo esquelético4,18. Al respecto, nosotros en un estudio clínico previo observamos que una sesión de 30 minutos de ejercicio de intensidad moderada redujo de forma significativa los niveles plasmáticos de insulina en personas físicamente inactivas19, resultados que otros grupos también han descrito20. Sin embargo, cuando la intensidad del esfuerzo físico es más elevada, esta respuesta deja de ser la misma. Es así como en un estudio reciente Steenberg et al. en un grupo de personas adultas sanas observaron que, tras la realización de un ejercicio localizado en extensores de rodilla hasta la fatiga, la captación de glucosa sistémica disminuyó un 18%, lo cual se asoció a una disminución en un 37% en la captación de glucosa estimulada por insulina en los músculos no ejercitados10. Esto sugiere que como respuesta a ejercicios de alta intensidad o hasta la fatiga, es esperable observar cierto nivel de resistencia a la insulina en los músculos no ejercitados21. Concordante con esto, se ha descrito que en personas físicamente desentrenadas tras la realización de un ejercicio en treadmill hasta la fatiga, se observaron peaks de insulina más altos durante los primeros 10 minutos de un clamp hyperglicémico respecto a las mediciones realizadas sin haber realizado ejercicio previamente17. Lo anterior, hace suponer que las elevaciones de insulina tras un esfuerzo físico intenso hasta la fatiga podrían ser fisiológicos, ante lo cual una posible explicación es la liberación de catecolaminas ante este tipo de esfuerzos, proteínas que a su vez inducen resistencia a la insulina en humanos22. Esta posible respuesta fisiológica, es acorde al fenotipo y estado metabólico de las personas que desarrollaron elevaciones de insulina circulante en este estudio, quienes tenían menores niveles de obesidad central, insulina basal y elevaciones de glicemia circulante. Lo último podría ser interpretado como una mayor disponibilidad de carbohidratos para su utilización a nivel del músculo esquelético durante la realización de ejercicio. Por tanto, se podría considerar que elevaciones insulínicas tras un esfuerzo intenso hasta la fatiga podrían asociarse a una respuesta fisiológica, sobre todo cuando el esfuerzo realizado es enfocado en ciertos grupos musculares y no constituye un esfuerzo musculoesquelético generalizado. Como limitaciones, podemos destacar que la muestra estuvo compuesta mayoritariamente por mujeres, lo cual podría dificultar la extrapolación de estos resultados. Además, no controlamos la alimentación de los participantes de manera previa, indicándoles solamente que no comieran algo distinto a lo usual. Además, el no tener los valores de los exámenes de laboratorio en condiciones de ayuno dificulta la detección de potenciales disfunciones metabólicas de base no diagnosticadas en los participantes. Como conclusión, en nuestra muestra observamos que el comportamiento insulínico tras la realización de un esfuerzo físico hasta la fatiga en personas físicamente inactivas es disímil, y que estas diferencias estarían asociadas a discrepancias en medidas fenotípicas y metabólicas. Esto sugiere que las adaptaciones fisiológicas al esfuerzo físico, incluso máximo, también estarían impactadas por alteraciones en la composición corporal y metabolismo, por lo que futuros estudios debieran enfocarse en investigar posibles mecanismos detrás de estas asociaciones. Agradecimientos Los autores agradecen la colaboración del Prof. Ernesto Carreaux y el equipo del Laboratorio Clínico de la Universidad Austral de Chile (LABOCLIN), por la realización de los exámenes de laboratorio descritos en este reporte.
Referencias
- OMS. Physical Inactivity 2022. Available from: https://www.who. int/data/gho/indicator-metadata-registry/imr-details/3416.
- Gadde KM, Martin CK, Berthoud HR, Heymsfield SB. Obesity: Pathophysiology and Management. J Am Coll Cardiol. 2018; 71(1): 69-84.
- Pedersen BK. The diseasome of physical inactivity-and the role of myokines in muscle-fat cross talk. The Journal of Physiology. 2009; 587(23): 5559-5568.
- Richter EA, Sylow L, Hargreaves M. Interactions between insulin and exercise. Biochem J. 2021; 478(21): 3827-3846.
- Frampton J, Cobbold B, Nozdrin M, Oo HTH, Wilson H, Murphy KG, et al. The Effect of a Single Bout of Continuous Aerobic Exercise on Glucose, Insulin and Glucagon Concentrations Compared to Resting Conditions in Healthy Adults: A Systematic Review, Meta-Analysis and Meta-Regression. Sports Med. 2021; 51(9): 1949-1966.
- Silva FM, Duarte-Mendes P, Teixeira AM, Soares CM, Ferreira JP. The effects of combined exercise training on glucose metabolism and inflammatory markers in sedentary adults: A systematic review and meta-analysis. Sci Rep. 2024; 14(1): 1936.
- Way KL, Hackett DA, Baker MK, Johnson NA. The Effect of Regular Exercise on Insulin Sensitivity in Type 2 Diabetes Mellitus: A Systematic Review and Meta-Analysis. Diabetes Metab J. 2016; 40(4): 253-271.
- Holten MK, Zacho M, Gaster M, Juel C, Wojtaszewski JF, Dela F. Strength training increases insulin-mediated glucose uptake, GLUT4 content, and insulin signaling in skeletal muscle in patients with type 2 diabetes. Diabetes. 2004; 53(2): 294-305.
- Stanford KI, Goodyear LJ. Exercise and type 2 diabetes: molecular mechanisms regulating glucose uptake in skeletal muscle. Adv Physiol Educ. 2014; 38(4): 308-314.
- Steenberg DE, Hingst JR, Birk JB, Thorup A, Kristensen JM, Sjoberg KA, et al. A Single Bout of One-Legged Exercise to Local Exhaustion Decreases Insulin Action in Nonexercised Muscle Leading to Decreased Whole-Body Insulin Action. Diabetes. 2020; 69(4): 578-590.
- Kirwan JP, Bourey RE, Kohrt WM, Staten MA, Holloszy JO. Effects of treadmill exercise to exhaustion on the insulin response to hyperglycemia in untrained men. J Appl Physiol (1985). 1991; 70(1): 246-250.
- Sabaratnam R, Pedersen AJT, Kristensen JM, Handberg A, Wojtaszewski JFP, Hojlund K. Intact regulation of muscle expression and circulating levels of myokines in response to exercise in patients with type 2 diabetes. Physiol Rep. 2018; 6(12): e13723.
- Slusher AL, Whitehurst M, Zoeller RF, Mock JT, Maharaj M, Huang CJ. Attenuated fibroblast growth factor 21 response to acute aerobic exercise in obese individuals. Nutr Metab Cardiovasc Dis. 2015; 25(9): 839-845.
- Balboa-Castillo T, Munoz S, Seron P, Andrade-Mayorga O, Lavados- Romo P, Aguilar-Farias N. Validity and reliability of the international physical activity questionnaire short form in Chilean adults. PLoS One. 2023; 18(10): e0291604.
- Borg GA. Psychophysical bases of perceived exertion. Med Sci Sports Exerc. 1982; 14(5): 377-381.
- Wasserman K. Principles of exercise testing and interpretation. 4th ed. Philadelphia: Lippincott Williams & Wilkins; 2005.
- Menzies P, Menzies C, McIntyre L, Paterson P, Wilson J, Kemi OJ. Blood lactate clearance during active recovery after an intense running bout depends on the intensity of the active recovery. J Sports Sci. 2010; 28(9): 975-982.
- DiMenna FJ, Arad AD. The acute vs. chronic effect of exercise on insulin sensitivity: nothing lasts forever. Cardiovasc Endocrinol Metab. 2021; 10(3): 149-161.
- Carrasco-Molina J, Iuspa-Santelices G, Flores-Ojeda F, Ruíz-Uribe M, Martínez-Huenchullán SF. Acute effects of moderate-intensity constant training on circulatory fibroblast growth factor 21, resis-tin, and adiponectin of physically inactive young adults. Retos. 2024; 55: 379-385.
- Annuzzi G, Riccardi G, Capaldo B, Kaijser L. Increased insulinstimulated glucose uptake by exercised human muscles one day after prolonged physical exercise. Eur J Clin Invest. 1991; 21(1): 6-12.
- Devlin JT, Barlow J, Horton ES. Whole body and regional fuel metabolism during early postexercise recovery. Am J Physiol. 1989; 256(1 Pt 1): E167-172.
- Deibert DC, DeFronzo RA. Epinephrine-induced insulin resistance in man. J Clin Invest. 1980; 65(3): 717-721.