Manifestaciones endocrinas asociadas a la inmunoterapia en pacientes con cáncer: Estudio de cohorte descriptivo
Andrea Orellana Toledo1,*, Victoria Novik Assael2, Pamela Narváez Valenzuela3, Alejandro Acevedo Gaete4, Jorge Miranda Madariaga4, Francisco Dodds Berger4, Ignacio Ruiz Carmona5, Pablo Sanzana Ruiz5, Rocio Soto Yaksic5, Francisco Vega Stehr5.
Endocrine manifestations associated with immunotherapy in cancer patients: A descriptive cohort study
- Médico Cirujano. Residente Medicina Interna Universidad Valparaíso. Valparaíso, Chile.
- Endocrinóloga. Médico Internista. Universidad Andrés Bello. Universidad de Valparaíso. Valparaíso, Chile.
- Médico Internista. Servicio de Medicina Interna Hospital Naval Almirante Nef
- Oncocentro APYS. Viña del Mar, Chile.
- Interno de Medicina, Universidad Andrés Bello. Viña del Mar, Chile.
*Correpondencia: Andrea Orellana T. / a.orellanatoledo2292@gmail.com
Conflictos de interés: Sin conflictos de interés.
Financiamiento propio.
Recibido: 25-11-2024.
Aceptado: 21-01-2025.
Resumen: Los inhibidores del punto de control inmunológico (ICIs) son tratamientos
efectivos contra el cáncer que pueden inducir manifestaciones endocrinológicas
(ME). Este estudio retrospectivo analiza las ME en una cohorte de
145 pacientes tratados con ICIs, de los cuales 31 (21,4%) presentaron ME.
Resultados: La mayoría eran mujeres (58,1%) con edades entre 34 y 83 años
(media de 58,5 años). Los tipos de cáncer predominantes fueron melanoma
(22,6%), cáncer cervicouterino (19,4%) y cáncer renal (16,1%). La patología
tiroidea fue la ME más común, afectando a 24 pacientes (74,2%) e incluyó
bocio multinodular eutiroideo, tiroiditis subaguda e hipotiroidismo (HT). Siete
pacientes (22,6%) presentaron insuficiencia del eje suprarrenal (IeSR) y dos
de estos desarrollaron IeSR después del diagnóstico de HT. Dos pacientes
presentaron tres ME combinadas: uno desarrolló HT, IeSR y diabetes mellitus
y otro presentó HT, IeSR e hipogonadismo. El tiempo promedio hasta el desarrollo
de la ME fue de 5,7 meses (Rango 1–20 meses), siendo más temprano
para el HT y más tardío para la IeSR. En cuanto a los ICIs utilizados, 77,4%
de los pacientes recibió pembrolizumab y el 16,1% nivolumab. La detección
de las patologías tiroideas fue mayormente asintomática, identificada en exámenes
de rutina y la afectación del eje suprarrenal se identificó mediante la
clínica. Conclusiones: La prevalencia de ME en este estudio fue del 22,3%,
un valor consistente con lo reportado en la literatura. No se identificaron
factores predisponentes específicos para el desarrollo de ME, y el HT fue
la manifestación más común, seguido de la IeSR. Estos hallazgos resaltan la
importancia de la medición periódica de hormona tiroestimulante (TSH) y
de buscar activamente IeSR en pacientes oncológicos tratados con ICIs, dado
que sus síntomas pueden confundirse fácilmente con los de la enfermedad
de base, destacando la necesidad de una vigilancia clínica cuidadosa para
un diagnóstico oportuno.
Palabras clave: Cáncer; Inhibidores de puntos de control; Inmunoterapia;
Manifestaciones endocrinas.
Abstract: Immune checkpoint inhibitors (ICIs) are effective cancer treatments that can
induce endocrine manifestations (EM). This retrospective study analyzes EM in
a cohort of 145 patients treated with ICIs, of whom 31 (21.4%) developed EM.
Results: The majority were women (58.1%), aged between 34 and 83 years (mean
age of 58.5 years). The predominant cancer types were melanoma (22.6%),
cervical cancer (19.4%), and renal cancer (16.1%). Thyroid pathology was
the most common EM, affecting 24 patients (74.2%), and included euthyroid
multinodular goiter, subacute thyroiditis, and hypothyroidism (HT). Seven patients
(22.6%) presented adrenal axis insufficiency (AAI), and two of these developed
AAI after an HT diagnosis. Two patients presented three combined EMs: HT,
AAI, and diabetes mellitus; another patient with HT, AAI, and hypogonadism.
The average time to EM development was 5.7 months (range 1–20 months),
being earlier for HT and later for AAI. Regarding the ICIs used, 77.4% of patients
received pembrolizumab and 16.1% nivolumab. Thyroid pathologies
were mostly asymptomatic, identified in routine exams, and adrenal axis
involvement was identified clinically. Conclusions: The prevalence of EM in
this study was 22.3%, a value consistent with that reported in the literature.
No specific predisposing factors were identified for EM development, with
HT being the most common manifestation, followed by AAI. These findings
highlight the importance of periodic thyroid-stimulating hormone (TSH) measurement
and active screening for AAI in oncology patients treated with ICIs,
as their symptoms can easily be mistaken for those of the underlying disease,
emphasizing the need for careful clinical monitoring for timely diagnosis.
Keywords: Cancer; Checkpoint inhibitors; Endocrine manifestations; Immunotherapy.
Introducción
En los últimos años, la inmunoterapia ha revolucionado el tratamiento de múltiples tipos de cáncer, ofreciendo nuevas opciones para pacientes con enfermedades malignas avanzadas. Dentro de las estrategias más innovadoras en este campo se encuentran los inhibidores del punto de control inmunológico (ICIs, por sus siglas en inglés), un grupo de anticuerpos monoclonales diseñados para desbloquear ciertas proteínas que regulan la actividad del sistema inmunológico1.
Estas proteínas, como el antígeno 4 asociado a linfocitos T citotóxicos (CTLA-4), el receptor de muerte programada 1 (PD-1) o su ligando (PD-L1), y el gen de activación de linfocitos 3 (LAG-3), actúan normalmente como frenos en la respuesta inmune, evitando que las células inmunitarias ataquen tejidos propios de manera descontrolada2.
Al bloquear la interacción entre estas proteínas y sus ligandos, los ICIs eliminan estos “frenos” y permiten que el sistema inmunológico identifique y ataque con mayor eficacia a las células cancerosas2.
Estos agentes han demostrado su eficacia especialmente en cánceres como el melanoma, cáncer de pulmón de células no pequeñas, carcinoma renal, linfoma de Hodgkin, cáncer de cabeza y cuello y cáncer de vejiga. En estos tumores, los ICIs han mejorado significativamente la supervivencia y han logrado respuestas prolongadas en comparación con los tratamientos convencionales3 (Tabla 1).
Tabla 1. Inhibidores de puntos de control inmunológico aprobados por la FDA y sus principales indicaciones
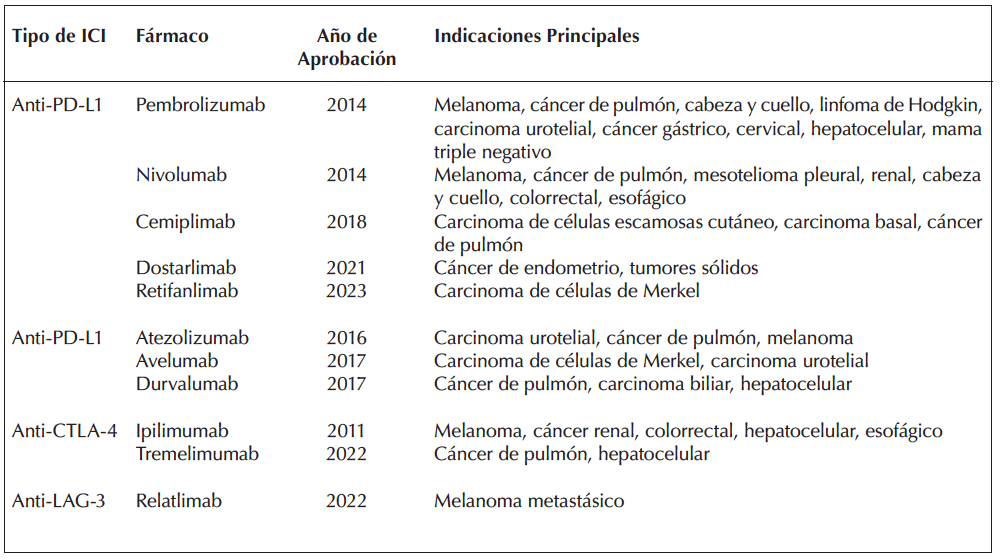
Adaptado de Wang C, Zhao G, Zhang Z, Yang L, et al. PD-L1: Ligando receptor muerte programada 1 PDL: Receptor de muerte programada 1 CTLA-4: Antígeno 4 asociado a linfocitos T citotóxicos LAG-3: gen de activación de linfocitos 3.
Sin embargo, esta reactivación del sistema inmune también ha llevado a la aparición de eventos adversos relacionados con el sistema inmunológico, conocidos como eventos adversos inmunorrelacionados (irAEs).
Entre los irAEs más frecuentes se encuentran los dermatológicos, seguidos de los gastrointestinales, endocrinos y pulmonares3.
Las manifestaciones endocrinas (ME) son comunes y clínicamente significativas en pacientes bajo tratamiento con ICIs. Su prevalencia suele oscilar entre un 10 y un 20% pudiendo aumentar hasta un 30 a 40% en casos de tratamientos combinados de ICIs4,5.
Entre los órganos más afectados se encuentran la glándula tiroides, la hipófisis, las glándulas suprarrenales y el páncreas, lo que en algunos casos puede llevar a disfunciones permanentes que requieren manejo a largo plazo. Estas ME pueden presentarse de manera simultánea o secuencial, afectando múltiples órganos durante el curso del tratamiento.
La disfunción tiroidea es una de las ME más prevalentes en pacientes bajo inmunoterapia, especialmente con ICIs dirigidos contra PD-1, como pembrolizumab y nivolumab. La prevalencia de disfunciones tiroideas, que incluyen hipotiroidismo y tiroiditis, varía entre un 10 y un 15%. El hipotiroidismo es la disfunción tiroidea más común y puede requerir tratamiento de reemplazo hormonal de por vida4.
Después de la disfunción tiroidea, la hipofisitis es la segunda endocrinopatía inmunomediada más común, con una prevalencia que puede alcanzar hasta el 8 a 12%4, especialmente en aquellos que reciben inhibidores de CTLA-4 como ipilimumab. La inflamación que afecta a las células del eje corticotropo produciendo déficit de hormona adrenocorticotópica (ACTH) es la más común, sin embargo, pueden ocurrir alteraciones en otras vías hormonales, resultando en hipotiroidismo central e hipogonadismo hipogonatrófico5.
La insuficiencia adrenal primaria tiene una prevalencia de aproximadamente 4 a 6% en pacientes tratados con ICIs, siendo más frecuente en aquellos tratados con combinaciones de ICIs como nivolumab e ipilimumab6.
Con respecto a la afectación pancreática, su prevalencia es menor en comparación con otras ME, situándose aproximadamente entre el 1 y el 2% en pacientes bajo tratamiento con ICIs. Esta complicación se manifiesta como diabetes inmunomediada, una condición grave que suele debutar de forma aguda con cetoacidosis diabética y que, al ser frecuentemente irreversible, requiere manejo con insulina a largo plazo7.
La identificación y manejo de las ME en pacientes tratados con ICIs es fundamental, ya que la mayoría de estos eventos son asintomáticos en etapas tempranas y pueden pasar desapercibidos sin un monitoreo adecuado.
El objetivo de este trabajo fue describir las características clínicas de una cohorte de 31 pacientes que recibieron tratamiento con ICIs y desarrollaron ME.
Tabla 2. Distribución de pacientes y características clínicas
de los pacientes con ME inducidas por ICIs.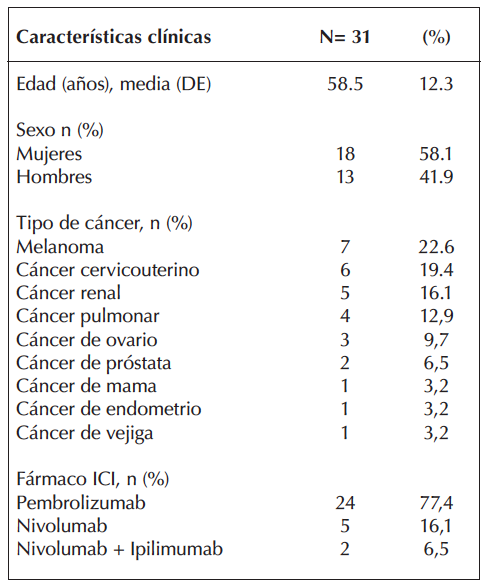
DE: Desviación estándar; ICI: Inhibidor control inmunológico.
Materiales y Métodos
Se realizó un estudio transversal y retrospectivo en pacientes tratados con ICIs, utilizando registros clínicos de pacientes aleatorizados que participaron en estudios de investigación de Fase III en el centro de salud Oncocentro. Se empleó una base de datos con información recopilada entre el 1 de octubre de 2018 y el 13 de junio de 2022.
Se incluyeron todos los pacientes con diagnóstico de cáncer sólido que recibieron tratamiento con algún tipo de ICI y presentaron al menos una ME. Los tipos de cáncer incluidos en el estudio fueron cáncer de vejiga, melanoma, pulmón, riñón, ovario, mama, próstata y cuello uterino.
Las variables evaluadas en cada paciente incluyeron edad, sexo, tipo de cáncer, fecha del inicio del tratamiento con ICI, diagnóstico endocrino específico, forma de presentación de la ME, tiempo transcurrido desde el inicio del fármaco hasta la aparición de la ME y análisis de factores que pudieran predisponer al desarrollo de ME: antecedentes familiares, anticuerpos antitiroideos (AAT) (los cuales se midieron solo a aquellos pacientes que desarrollaron ME) y presencia de otras manifestaciones autoinmunes.
Se empleó Microsoft Excel como herramienta para el análisis estadístico descriptivo, y los resultados se presentaron en forma de porcentajes para cada variable relevante. Este estudio cuenta con la aprobación del Comité de Ética del Servicio de Salud Viña del Mar Quillota y con la autorización de los patrocinadores para la publicación anónima de los resultados para cada protocolo de investigación.
Resultados
De los 145 pacientes incluidos en los protocolos de investigación durante el periodo de observación, 31 presentaron ME lo que representa una prevalencia del 21,4%. De estos pacientes, 18 (58,1%) eran mujeres, con edades comprendidas entre 34 y 83 años (media de 58,5 años).
La distribución de los tipos de cáncer en esta cohorte y los ICIs utilizados se resumen en la tabla 2.
La patología tiroidea fue la ME más frecuente, observada en 24 pacientes (77,4%). Dentro de este grupo, 1 paciente presentó bocio multinodular eutiroideo (BMN), mientras que 11 desarrollaron tiroiditis subaguda, de los cuales 8 evolucionaron a hipotiroidismo, requiriendo tratamiento de suplementación con levotiroxina y 3 permanecieron en estado eutiroideo. Los 12 casos restantes fueron diagnosticados con hipotiroidismo primario o subclínico (SC); de estos, 10 recibieron tratamiento con levotiroxina y 2 permanecieron sin tratamiento. La detección de estas patologías tiroideas fue realizada mediante hallazgos asintomáticos en exámenes de laboratorio de rutina.
La IeSR de origen central fue la segunda ME más común, diagnosticada en 7 de 31 pacientes (22,6%). Dos de estos pacientes desarrollaron ISR como segundo diagnóstico junto con hipotiroidismo (1 caso con tiroiditis subaguda). Todos los casos de sospecha de afectación del eje suprarrenal se diagnosticaron por síntomas que incluyeron compromiso del estado general, cansancio y fatigabilidad. Tres pacientes presentaron hipotensión severa y compromiso de conciencia que mejoraron rápidamente con la administración de corticoides endovenosos, todos con cortisol y ACTH disminuidos en exámenes de laboratorio.
No se realizó resonancia nuclear magnética de hipófisis en los pacientes con IeSR.
Dos pacientes presentaron tres ME cada uno: Uno desarrolló HT, IeSR y diabetes mellitus (con debut de cetoacidosis diabética severa que requirió manejo intensivo con insulina) bajo tratamiento con pembrolizumab y otro paciente, tratado con una combinación de nivolumab e ipilimumab, presentó HT, hipogonadismo hipogonadotrófico e ISR. La tabla 3 resume la distribución de los tipos de ME observadas.
El tiempo promedio de aparición de las ME desde el inicio del tratamiento con ICIs fue de 5,7 meses (DE = 4,1 meses). Las manifestaciones específicas aparecieron en promedio a los 6 meses para el HT, a los 5 meses para la tiroiditis subaguda y a los 8 meses para la IeSR, con un rango total de aparición entre 1 y 20 meses.
Con respecto a los factores predisponentes, dos pacientes presentaron vitíligo y se encontró la presencia de AAT en 4 pacientes.
En el caso del paciente que desarrolló diabetes insulinodependiente, no se realizó un estudio autoinmune adicional. Todos los pacientes diagnosticados con HT e IeSR continúan en tratamiento de sustitución hormonal, pese a que en 8 de ellos se interrumpió el tratamiento de ICIs. Durante el estudio, 3 pacientes fallecieron por causas no relacionadas con las ME.
Tabla 3. Tiempo hasta el diagnóstico de la Me y tipo de ME según tratamiento utilizado.
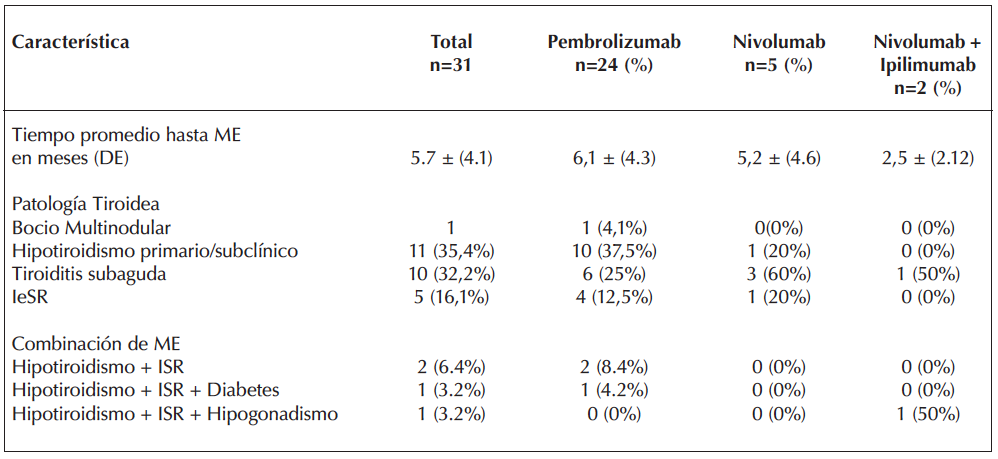
ME: Manifestación endocrina; DE: Desviación estándar; IeSR: Insuficiencia suprarrenal.
Discusión
En este estudio se observó una prevalencia importante de ME en pacientes tratados con ICIs, hallazgo que concuerda con otras investigaciones sobre toxicidades inmunomediadas en pacientes bajo inmunoterapia6.
La patología tiroidea fue la manifestación endocrina más frecuente, representando el 74,2% de las ME en esta cohorte. La susceptibilidad de la glándula tiroides a los ICIs puede explicarse por la pérdida de tolerancia inmunológica en el tejido tiroideo, facilitada por el bloqueo de proteínas como PD-1 y PD-L1, que normalmente actúan para limitar la activación inmune y proteger el tejido tiroideo de ataques autoinmunes. Al inhibir estos puntos de control, los ICIs permiten una reactivación de células T específicas que reconocen antígenos tiroideos, desencadenando inflamación autoinmune y, en muchos casos, progresando de una fase inicial de tiroiditis transitoria a HT permanente3,7.
Esto es consistente con la literatura, que describe al HT y la tiroiditis, inducidas por ICIs como complicaciones endocrinológicas comunes9. La mayoría de los casos se detectaron de forma asintomática mediante pruebas de laboratorio de rutina, lo que subraya la necesidad de realizar monitoreos regulares de los niveles de TSH y otros marcadores tiroideos en pacientes bajo ICIs, incluso en ausencia de síntomas.
Otros reportes también destacan que la hipofisitis con IeSR es una complicación endocrina relevante asociada a la terapia con ICIs6,10. En este estudio, el diagnóstico de IeSR se realizó principalmente en base a la clínica de los pacientes, ya que la medición de cortisol sérico como método de detección sistemática puede ser errática y poco confiable para identificar IeSR en etapas tempranas, ya que sus niveles fluctúan a lo largo del día y pueden ser afectados por factores como el estrés o comorbilidades, lo que dificulta una interpretación precisa1.
En este sentido, la evaluación basada en la clínica es esencial para el manejo adecuado de la IeSR, complementada con mediciones de laboratorio en contextos seleccionados y bajo supervisión médica estrecha6.
En relación al momento de aparición de las SE ME observó que éstas tienden a presentarse alrededor de los 5,7 meses desde el inicio del tratamiento, aunque con una variabilidad considerable. Esto es relevante clínicamente, ya que sugiere que el monitoreo endocrino debería mantenerse no solo durante los primeros meses, sino también a largo plazo para captar posibles manifestaciones endocrinas tardías. Además, los tiempos de aparición parecen variar según el tipo de ME, con el HT y la tiroiditis subaguda presentándose antes que la IeSR. Este hallazgo es coherente con estudios previos, en los que se observa que la patología tiroidea suele manifestarse tempranamente durante el tratamiento con ICIs6,10,11.
Un aspecto importante es la ausencia de factores predisponentes específicos para el desarrollo de ME, salvo el vitíligo observado en dos pacientes y la presencia de AAT en 4 pacientes. Esto sugiere que las ME pueden aparecer en una variedad de pacientes sin características predisponentes claras, destacando la naturaleza impredecible de los efectos adversos inmunomediados.
Dado el tamaño de la muestra (31pacientes con ME), el poder estadístico para detectar diferencias significativas entre subgrupos fue limitado, lo que restringe el análisis a descripciones generales sin comparaciones entre tipos de cáncer o ICI utilizado. Además, sería valioso evaluar el impacto de estas ME en la supervivencia y calidad de vida de los pacientes en estudios futuros de mayor escala. Sin embargo, en esta cohorte el tratamiento de sustitución hormonal no alteró la calidad de vida.
Como conclusión, los resultados de este estudio sugieren que los ICIs están asociados con una frecuencia no despreciable de ME, particularmente en relación con la patología tiroidea y la insuficiencia del eje suprarrenal. La aparición de estas condiciones parece ser bastante temprana (promedio de 6 meses), y la mayoría de los casos requieren tratamiento continuo. Además, la ausencia de factores predisponentes específicos refuerza la recomendación de realizar un monitoreo uniforme en todos los pacientes, independiente de sus antecedentes clínicos.
Agradecimientos
A la ejecutiva de Oncocentro Alejandra Fuentealba, por facilitarnos la revisión de fichas y datos.
Referencias
- Zhai Y, Ye X, Hu F, Xu J, Guo X, Zhuang Y, et al. Endocrine toxicity of immune checkpoint inhibitors: a real-world study leveraging US Food and Drug Administration adverse events reporting system. Journal for ImmunoTherapy of Cancer 2019; 7: 286. doi: 10.1186/ s40425-019-0754-2
- Tan M.H, Iyengar R, Mizokami-Stout K, Yentz S, MacEachern M, Yan L, et al. Spectrum of immune checkpoint inhibitors-induced endocrinopathies in cancer patients: A scoping review of case reports. Clin Diabetes Endocrinol. 2019; 5: 1.
- 3. Wang C, Zhao G, Zhang Z, Yang L, Liu S, Li G, et al. Immune checkpoint inhibitor-associated myocarditis: A systematic analysis of case reports. Front. Immunol. 2023; 14: 1275254. doi:10.3389/ fimmu.2023.1275254
- Barroso-Sousa R, Ott PA, Hodi FS, Kaiser UB, Tolaney SM, Min L. Endocrine dysfunction induced by immune checkpoint inhibitors: Practical recommendations for diagnosis and clinical management. Cancer. 2018; 124(6): 1111-1121. doi: 10.1002/cncr.31200. Epub 2018 Jan 3. PMID: 29313945.
- Jessel S, Weiss SA, Austin M, Mahajan A, Etts K, Zhang L, et al. Immune Checkpoint Inhibitor-Induced Hypophysitis and Patterns of Loss of Pituitary Function. Front Oncol. 2022;12: 836859. doi: 10.3389/fonc.2022.836859. PMID: 35350573; PMCID: PMC8958012
- Deligiorgi MV, Panayiotidis MI, Trafalis DT. Endocrine adverse events related with immune checkpoint inhibitors: an update for clinicians. Immunotherapy. 2020; 12(7): 481-510. doi: 10.2217/imt-2019-0132. Epub 2020 Apr 29. PMID: 32345074.
- Darnell EP, Mooradian MJ, Baruch EN, Yilmaz M, Reynolds KL. Immune-Related Adverse Events (irAEs): Diagnosis, Management, and Clinical Pearls. Curr Oncol Rep. 2020; 22(4): 39. doi: 10.1007/ s11912-020-0897-9. PMID: 32200442.
- Fidilio E, Navarro-González E, Romero-Lluch A.R, Iglesias P, Diez Gómez J.J, Anda Apiñániz E, Santos Mazo E, Zafón C. Alteraciones tiroideas asociadas con los inhibidores de los puntos de control inmunitario. Endocrinología, Diabetes y Nutrición. 2021; 68(5): 408-415. https://doi.org/10.1016/j.endinu.2020.04.007
- Li Y, Zhao J, Wang Y, Xu Y, Li R, Zhao Y, Dong X, et al. Common endocrine system adverse events associated with immune checkpoint inhibitors. Cancer Pathog Ther. 2023; 2(3): 164-172. doi: 10.1016/j. cpt.2023.11.005. PMID: 39027145; PMCID: PMC11252504.
- Wright JJ, Powers AC, Johnson DB. Endocrine toxicities of immune checkpoint inhibitors. Nat Rev Endocrinol. 2021; 17(7): 389-399. doi: 10.1038/s41574-021-00484-3. Epub 2021 Apr 19. PMID: 33875857; PMCID: PMC8769055.
- Ramos-Casals M, Brahmer JR, Callahan MK, Flores-Chávez A, Keegan N, Khamashta MA, Lambotte O, Mariette X, Prat A, Suárez-Almazor ME. Immune-related adverse events of checkpoint inhibitors. Nat Rev Dis Primers. 2020; 6(1): 38. doi: 10.1038/s41572-020-0160-6. PMID: 32382051; PMCID: PMC9728094