Efecto de 2-hidroxiestradiol sobre mediadores de la ruptura folicular vía ERK-1/2: Expresión del receptor de progesterona y la enzima ADAMTS en células de la granulosa humana
Soledad Henríquez1,2*, María José Valdivia3, Ana Godoy4, Alex Muñoz5,6, Claudio Villarroel7.
Effect of 2-hydroxyestradiol on mediators of follicular rupture via ERK-1/2: Expression of the progesterone receptor and the ADAMTS enzyme in human granulosa cells
- Académico PhD. Instituto de Investigaciones Materno Infantil (IDIMI), Facultad de Medicina, Universidad de Chile. Santiago, Chile.
- Académico PhD. Ins t i tuto Interdisciplinar en Ciencias Biomédicas (I3CBSEK), Facultad de Ciencias de la Salud, Universidad Internacional SEK, Santiago, Chile.
- Estudiante de Medicina. Facultad de Medicina, Universidad de Chile. Santiago, Chile.
- Bioquímica. Laboratorio de Fertilización In Vitro. Instituto de Investigaciones Materno Infantil (IDIMI), Facultad de Medicina, Universidad de Chile. Santiago, Chile.
- Profesor Asistente. Instituto de Investigaciones Materno Infantil (IDIMI), Facultad de Medicina, Universidad de Chile. Santiago, Chile.
- Tecnólogo Médico. Departamento de Ginecología y Obstetricia, Facultad de Medicina, Complejo Hospitalario San Borja-Arriaran, Universidad de Chile, Santiago, Chile.
- Médico. Instituto de Investigaciones Materno Infantil (IDIMI), Facultad de Medicina, Universidad de Chile. Santiago, Chile.
*Correspondencia:
Soledad Henríquez / soledadhenriquezbarrera@gmail.com
Instituto de Investigaciones Materno-Infantiles (IDIMI), Facultad de Medicina, Universidad de Chile.
Santa Rosa 1234, Santiago, Chile.
Conflicto de intereses: Los autores no
tienen conflictos de interés.
Este trabajo fue financiado por el proyecto
SOCHED N° 2022-01
Recibido: 23-12-2024.
Aceptado: 25-01-2025.
Resumen: La ruptura folicular es clave para la ovulación y depende de la expresión del
receptor de progesterona (RP) y metaloproteasas de matriz extracelular como
ADAMTS en las células de la granulosa (CG) humana de folículos pre-ovulatorios.
A su vez, la expresión del RP está mediada por las gonadotrofinas ováricas, a
través de diversas vías de señalización entre las que destaca la vía ERK. Se ha
estudiado que los metabolitos de estradiol (ME) como el 2-hidroxiestradiol
(2-OHE2) están en altas concentraciones en folículos pre-ovulatorios, lo que
sugiere que podrían participar durante la ovulación. Se ha observado en otros
tipos celulares que 2-OHE2 podría regular la fosforilación de la vía de ERK 1/2.
Objetivo: determinar si 2-OHE2 regula la expresión del RP y la enzima ADAMTS
mediante la vía de señalización intracelular ERK-1/2 dependiente de hCG en
CG humana. Métodos: Se obtuvieron CG de mujeres sanas que participan
del programa de IVF por infertilidad por factor masculino. Las células fueron
mantenidas en cultivo y luego incubadas con hCG (10 UI/mL) y 2-OHE2 (0,5
μM) para luego evaluar mediante inmunofluorescencia la expresión del RP y
por Western Blotting los niveles de ERK1/2 (total y fosforilado) y ADAMTS. Resultados: Las CG estimuladas con hCG y 2-OHE2 mostraron un aumento
de la expresión del RP a las 12 hrs. de estímulo comparada con la condición
basal y el estímulo solo con hCG (P<0.05). Resultados similares fueron obtenidos
para los niveles de ADAMTS a las 24 hrs. de estímulo. 2-OHE2 aumenta
la fosforilación de ERK-1/2 regulada por hCG. Conclusiones: 2-OHE2 regula
la expresión del RP dependiente de hCG vía ERK1/2, y con esto regula la
expresión de ADAMTS dependiente de RP, sugiriendo su participación en el
proceso ovulatorio.
Palabras clave: ADAMTS; Receptor de progesterona; Ruptura folicular; 2-hidroxiestradiol.
Abstract: Follicular rupture is key for ovulation and depends on the expression of the
progesterone receptor (PR) and extracellular matrix metalloproteases such as ADAMTS in human granulosa cells (GC) of pre-ovulatory follicles. In turn, PR expression
is mediated by ovarian gonadotropins through various signaling pathways, among which
the ERK pathway stands out. It has been studied that estradiol metabolites (EM), such
as 2-hydroxyestradiol (2-OHE2), are in high concentrations in pre-ovulatory follicles,
suggesting that they could participate during ovulation. It has been observed in other
cell types that 2-OHE2 could regulate the phosphorylation of the ERK 1/2 pathway.
Objective: To determine whether 2-OHE2 regulates the expression of the PR and the
ADAMTS enzyme through the hCG-dependent ERK-1/2 intracellular signaling pathway in
human granulosa cells. Methods: GCs were obtained from healthy women participating
in an IVF program for male factor infertility. Granulosa Cells in culture were deprived of
hormonal stimuli for XX hours and then incubated with hCG (10 IU/mL) and 2-OHE2
(0.5 μM) to evaluate the expression of PR by immunofluorescence and the levels of
ERK1/2 (total and phosphorylated) and ADAMTS by Western Blotting. Results: GCs
stimulated with hCG and 2-OHE2 showed an increase in PR expression at 12 hrs. of
stimulation compared to basal condition and stimulation with hCG alone (P<0.05).
Similar results were obtained for ADAMTS levels at 24 hrs. of stimulation. 2-OHE2 increases
hCG-regulated ERK-1/2 phosphorylation. Conclusions: 2-OHE2 regulates hCGdependent
progesterone receptor expression via ERK1/2, thus regulating progesterone
receptor-dependent ADAMTS expression, indicating its role in the ovulatory process.
Keywords: ADAMTS; Follicular ruptura; Progesterone receptor; 2-hydroxyestradiol.
Introducción
La ovulación humana es un proceso biológicamente complejo que se produce posterior al alza preovulatoria de LH y que incluye una serie de eventos fisiológicos, entre ellos la ruptura folicular para la liberación del ovocito desde el folículo dominante1,2.
Existe evidencia que la ruptura folicular depende de la unión de Progesterona (P4) a su receptor (RP) en las células de granulosa (CG) del folículo pre-ovulatorio3,4,5. A su vez, estudios previos han reportado que las gonadotrofinas, hormona luteinizante (LH), hormona folículo estimulante (FSH) y hormona gonadotrofina coriónica (hCG) estimulan la expresión del RP en CG humanas, a través de las vías de señalización intracelular PKA, PKC y ERK6.
La unión de Progesterona al RP en el folículo preovulatorio desencadena una serie de eventos bioquímicos necesarios para la ruptura folicular, entre los que destacan un aumento de enzimas claves incluyendo metaloproteinasas, las cuales, mediante la proteólisis y degradación del tejido conectivo folicular apical, cambian la integridad de la pared folicular y permiten la liberación del ovocito5,7,8,9. Trabajos realizados en ovario de ratón muestran que la expresión de la endopeptidasa ADAMTS-1 (Desintegrina y metaloproteinasa con motivos tipo trombopondina) dependiente de P4, es fundamental para la ruptura folicular, esta enzima se une a componentes de la matriz extracelular y puede degradar proteoglicanos, procesar pro-colageno a colágeno, actuar como carrier de factores de coagulación, entre otras funciones10. Publicaciones anteriores de nuestro laboratorio mostraron que ADAMTS es regulada por las gonadotrofinas LH, FSH y hCG en CG humanas, siendo su expresión dependiente del RP6.
Durante el ciclo ovárico, existe una coordinación funcional bi-celular entre las células de la teca y granulosa que permite la producción de estradiol a partir de andrógenos y el crecimiento folicular11. El estradiol puede metabolizarse en el ovario a metabolitos del estradiol (ME) mediante diversas vías, como glucuronidación, sulfonación, hidroxilación y metilación, siendo estas últimas dos, las vías más relevantes en los tejidos reproductivos. Cabe mencionar que estos ME no poseen actividad estrogénica, debido a su baja afinidad por receptores de estrógeno. La producción de estos metabolitos comienza con la conversión de E2 a 2-hidroxiestradiol (2- OHE2) mediante un proceso de hidroxilación catalizado por la enzima citocromo P450, isoforma 1A1 (CYP1A1)12,13. Se ha reportado que el 2-OHE2, ME con características pro angiogénicas, se produce intrafolicularmente a lo largo del todo el ciclo ovárico, participando en el desarrollo folicular normal y en la formación del cuerpo lúteo14,15,16,17. Interesantemente, los niveles intrafoliculares de este metabolito están reducidos en mujeres con patologías anovulatorias como el síndrome de ovario poliquístico16,17.
Estudios previos han reportado que la fosforilación de ERK-1/2 es fundamental para la expresión del RP dependiente de gonadotrofinas en CG humana, ya que al usar un inhibidor específico de la fosforilación de ERK (UO126), se inhibe la expresión de RP en CG humanas3. Resultados similares se han mostrado en roedores donde la vía ERK-1/2 es necesaria para la expresión de RP y la ruptura folicular5. Existen antecedentes en otros tipos celulares mostrando que 2-OHE2 puede estimular la fosforilación de la vía ERK, en células endoteliales, regulando su proliferación18. Además, el 2-OHE2 alcanza altas concentraciones en el folículo pre-ovulatorio16,17, lo que sugiere que también podría participar del proceso ovulatorio, regulando la expresión del RP dependiente de la vía ERK.
El objetivo de este estudio es determinar si el metabolito de estradiol 2-OHE2 regula la expresión del RP y la enzima ADAMTS, mediante la regulación de la vía de señalización intracelular ERK-1/2 dependiente de hCG en CG humana.
Materiales y Métodos
El estudio se realizó en el Instituto de Investigaciones Materno Infantil (IDIMI) de la Facultad de Medicina de la Universidad de Chile, ubicado en el Hospital Clínico San Borja-Arriarán.
Participantes
Las CGs humanas se obtuvieron de folículos pre-ovulatorios de mujeres sanas que participaron en el Programa de Fertilización In Vitro (FIV) del IDIMI, debido a infertilidad por factor masculino, quienes fueron invitadas a colaborar en este estudio de forma voluntaria, previa información sobre el proceso y firmando un consentimiento informado, aprobado por el comité ético científico del servicio de salud metropolitano central 292-2022.
Criterios de inclusión: mujeres sanas (n=10), con edades comprendidas entre 25 y 35 años, que participan en el programa de FIV debido a infertilidad por factor masculino.
Criterios de exclusión: diabetes, resistencia a la insulina, endometriosis y síndrome de ovario poliquístico.
El cálculo del tamaño de la muestra se basó en los datos publicados por Henríquez 20176, sobre las diferencias observadas en la marca para receptor de progesterona entre células de granulosa, estimuladas (80% marca positiva) y no estimuladas (15% de marca positiva). Sería necesario realizar cultivos celulares en al menos 5 mujeres para detectar una diferencia con una significación α del 5% y una potencia 1-β del 88%.
Cultivos de células de la granulosa-luteína
Se realizaron cultivos primarios de CG obtenidas de las aspiraciones foliculares según el protocolo descrito previamente19. Brevemente, las CG se cultivaron en un medio de crecimiento M-199 con suero fetal bovino 10% (Sigma-Aldrich, Missouri, USA) durante 48 horas a 37°C bajo atmósfera de 5% de CO2. Luego, las células se cultivaron en un medio básico libre del suero fetal bovino durante 24 horas adicionales. Las CG privadas de suero fetal bovino se estimularán según el siguiente diseño experimental: condición control (medio M199), hCG (10 UI/mL), 2-OHE2 (0,5 μM) y hCG en presencia de 2-OHE2.
Se determinó el efecto de 2-OHE2 sobre los niveles de expresión del RP después de 12 horas de estímulo por inmunofluorescencia.
El efecto de 2-OHE2 sobre la fosforilación de ERK se evaluó después de 5, 15 y 30 minutos de estimulo, por western blot mediante el uso de anticuerpos específicos para ERK fosforilado y ERK total según protocolo previamente descrito6.
Los niveles de expresión de la enzima ADAMTS se determinaron después de 24 horas de estimulo con 2-OHE2 por western blot mediante el uso de anticuerpos anti ADAMTS, protocolo previamente descrito6.
Western blotting: La extracción de proteínas desde las CG se realizó en presencia de inhibidores de proteasas y fosfatasas. Los extractos proteicos fueron cuantificados mediante Bradford: (Bio-Rad Lab. Inc., California, EE. UU). Las proteínas (10 ug) fueron separadas por electroforesis en geles PAGE-SDS 10% y transferidas a membranas de nitrocelulosa (Thermo Fisher Scientific, Massachusetts,USA). Estas membranas fueron bloqueadas con BSA 3 % y se incubaron con los anticuerpos primarios: anti-fosfo o total ERK1/2, (anticuerpo monoclonal mouse, Santa Cruz), anti ADAMTS (anticuerpo policlonal cell signaling) y anti Beta actina, toda la noche a 4ºC. Los productos de la inmunoreacción se detectaron utilizando un anticuerpo secundario, goat anti mouse, conjugado con peroxidasa de rábano (Jackson Immuno Research, dilución 1: 5000). El sistema de detección de quimioluminiscencia (Western Lightning Plus-ECL, Perking Elmer, Inc.) fue visualizado usando el lector de imágenes Ultra Quant 6.2. El análisis densitométrico, de las bandas inmunorreactivas, se realizó con el software Image Quant 5.2 (Molecular Dynamics Inc., Sunnyvale, CA) y fue normalizado en unidades arbitrarias de proteína fosforilada / proteína total.
Inmunofluorescencia: La expresión celular del RP en las CG fue determinado por inmunofluorescencia indirecta usando un protocolo descrito previamente6. Las células fueron fijadas en metanol (100%) frío y permeabilizadas en Triton X-100 0,5%. Luego, fueron bloqueadas con 1% de BSA. Las células fueron incubadas a 4ºC con el anticuerpo monoclonal anti-RP, dilución 1:100 (isoformas A/B, Cell Signaling, Technology, Massachusetts, USA) durante toda la noche. Posteriormente, las células fueron incubadas con un anticuerpo secundario anti-mouse conjugado con Alexa fluor 488. Como tinción de los núcleos celulares se utilizará DAPI ProLong Gold. La inmunofluorescencia fue documentada con un microscopio de epifluorescencia (Olympus BX-51TF; Olympus Optical Co.Ltd.) y CoolSNAPPro (Media Cybernetics). Para cuantificar los resultados de la inmunofluorescencia, se utilizó el programa computacional Image Pro software versión 6.20 (Media Cybernetics Inc.). A su vez, la intensidad de la señal inmunofluorescente se estimó con el software Integrated Optical Density tool.
Análisis estadístico
Los datos se presentaron como media ± SEM y se verificó su distribución normal mediante una prueba de Shapiro-Wilk. Las diferencias entre los tratamientos se calcularán mediante test de Kruskal Wallis seguido de un test de Dunn. Los niveles de significación se fijaron en p≤0,05 para todos los casos.
Resultados
Efecto del 2-OHE2 sobre la expresión del Receptor de Progesterona (RP) en CGs estimuladas con hCG
La figura 1 A y B muestran que el RP total fue detectado en el núcleo de las CGs humanas estimuladas con hCG (10 U/mL) por 12 horas (marca inmunofluorescente verde). Los núcleos se observan de color azul debido a la marca fluorescente de DAPI. La incubación con 2-OHE2 (0,5 μM) aumenta la detección del RP en comparación a la marca observada solo con hCG. La incubación de las CG con 2-OHE2 no muestra diferencias desde la condición basal.
La figura 1C muestra la cuantificación de las inmunofluorescencias en un gráfico de índice de densidad óptica en unidades relativas (UR), donde se observó que hCG aumentó significativamente la expresión de RP en las CG en comparación a la condición basal luego de 12 horas de estímulo (n=5, P<0.05). La incubación con 2-OHE2 (0,5 μM) en presencia de hCG aumentó significativamente la expresión del RP comparada con la condición basal y el estímulo solo con hCG (n=5, P<0.05). Los valores son presentados como el promedio ± el error estándar. * Basal vs hCG, n=5, P < 0.05. # hCG vs hCG + 2-OHE2, n=5, P< 0.05.
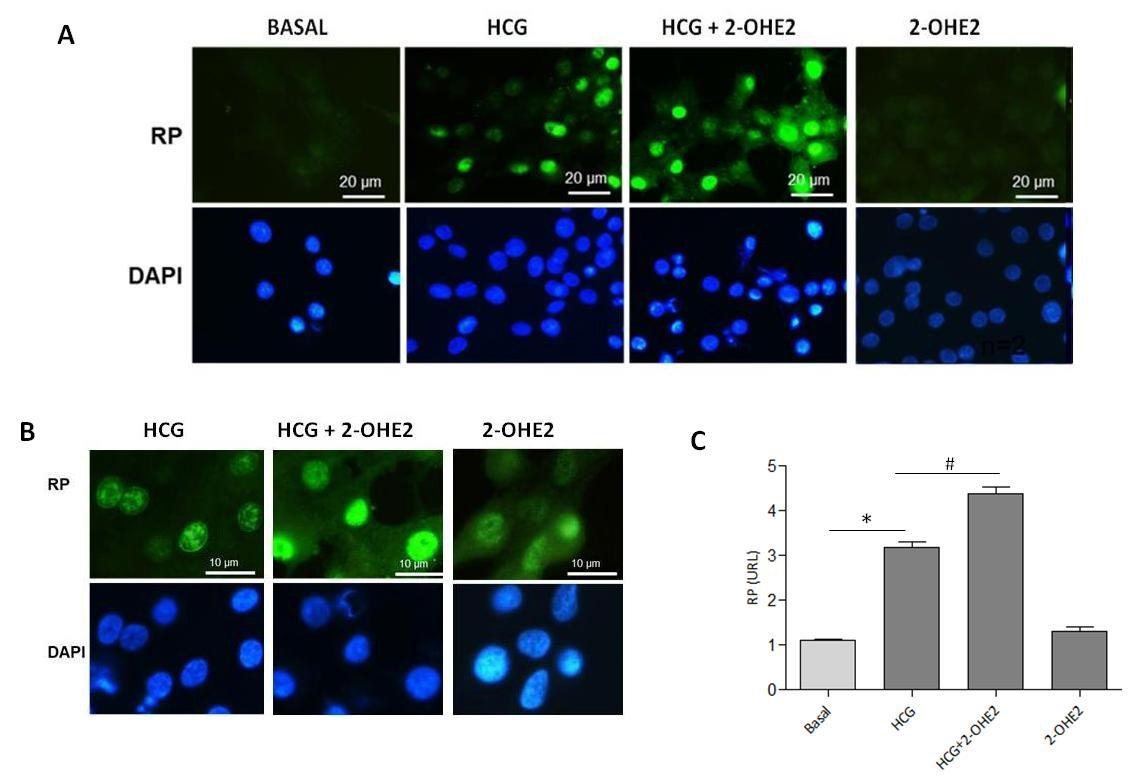 Figura 1: Efecto del 2-OHE2 sobre la fosforilación de ERK-1/2 regulada por hCG en cultivo de CG humana. Detección del receptor de progesterona
en el núcleo de células de la granulosa. Panel A y B: Detección de Receptor de Progesterona por Inmunofluorescencia en el núcleo de las células de
las granulosas humanas estimuladas con hCG y hCG+2-OHE2. Los núcleos se observan de color azul debido a la marca fluorescente de DAPI. Panel
C: gráfico de cuantificación de inmunofluorescencia expresado en unidades relativas (UR).
Figura 1: Efecto del 2-OHE2 sobre la fosforilación de ERK-1/2 regulada por hCG en cultivo de CG humana. Detección del receptor de progesterona
en el núcleo de células de la granulosa. Panel A y B: Detección de Receptor de Progesterona por Inmunofluorescencia en el núcleo de las células de
las granulosas humanas estimuladas con hCG y hCG+2-OHE2. Los núcleos se observan de color azul debido a la marca fluorescente de DAPI. Panel
C: gráfico de cuantificación de inmunofluorescencia expresado en unidades relativas (UR).
La figura 2 muestra el efecto de 2-OHE2 sobre la fosforilación de ERK-1/2 regulada por hCG en cultivo de CG humana. El panel A corresponde a un Western blotting representativo de los niveles de ERK-1/2, isoforma fosforilada y total, realizados a partir de extractos proteicos de CG estimuladas con hCG 10 UI en presencia y ausencia de 2-OHE2 (0,5 μM) por 5, 15 y 30 minutos. En el panel B, el gráfico representa el análisis densitométrico, expresado en unidades arbitrarias (UA). Se observó que hCG (10 U/ mL) estimuló en forma significativa los niveles de ERK-1/2 fosforilado (P < 0.05), desde los 5 minutos de estimulación, comparada con la condición basal. La presencia de 2-OHE-2 (0,5 μM) aumentó significativamente los niveles de ERK-1/2 fosforilado regulados por hCG (P < 0.05) a los 5 minutos de estimulación comparado con la condición solo estimulada por hCG.
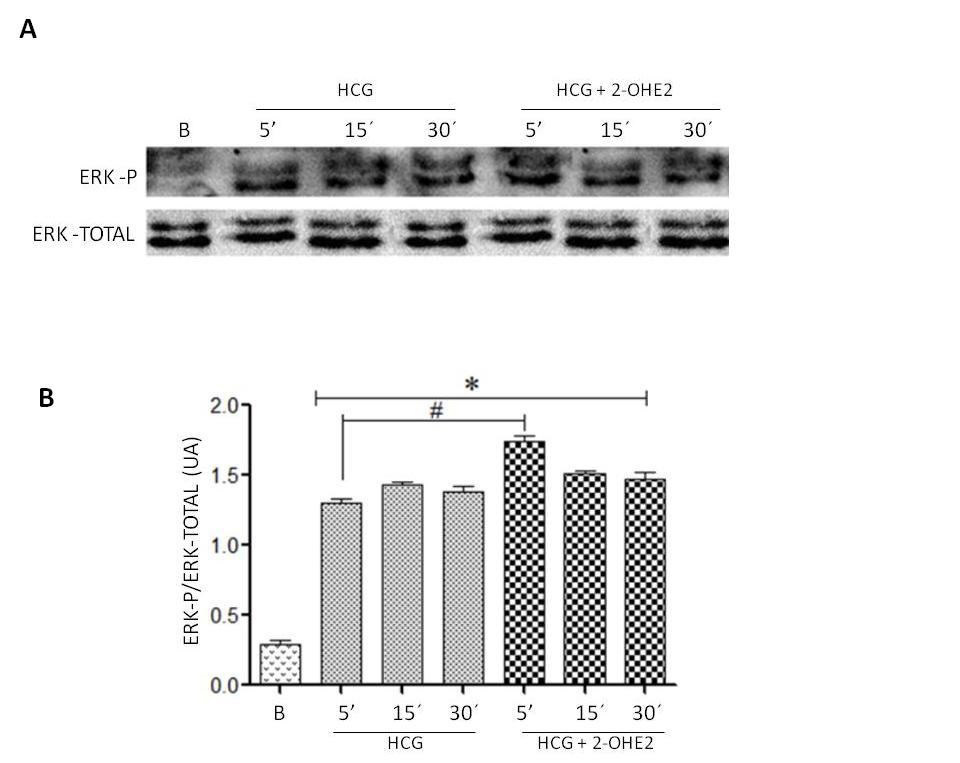 Figura 2: Niveles de ERK-1/2 isoforma fosforilada y total en células de la granulosa humanas. Panel A: Western blotting de niveles de ERK-1/2, isoforma
fosforilada y total, en células de la granulosa estimuladas con hCG en presencia y ausencia de 2-OHE2. Panel B: gráfico de análisis densitométrico
expresado en unidades arbitrarias (UA).
Figura 2: Niveles de ERK-1/2 isoforma fosforilada y total en células de la granulosa humanas. Panel A: Western blotting de niveles de ERK-1/2, isoforma
fosforilada y total, en células de la granulosa estimuladas con hCG en presencia y ausencia de 2-OHE2. Panel B: gráfico de análisis densitométrico
expresado en unidades arbitrarias (UA).
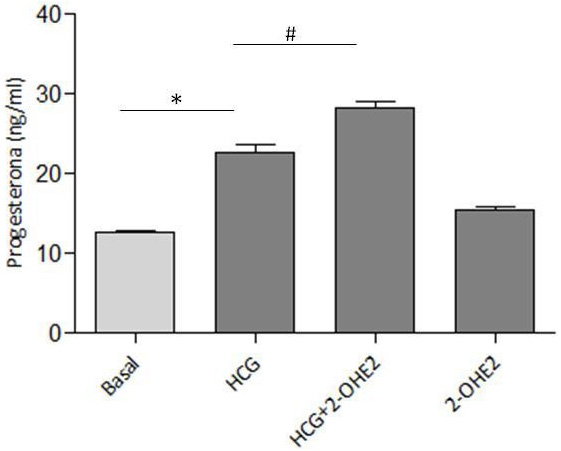 Figura 3: Niveles de progesterona en medio de cultivo de células de la
granulosa humanas. Gráfico de secreción de progesterona (ng/mL) al medio
de cultivo de células de la granulosa estimuladas con hCG y 2-OHE2.
Figura 3: Niveles de progesterona en medio de cultivo de células de la
granulosa humanas. Gráfico de secreción de progesterona (ng/mL) al medio
de cultivo de células de la granulosa estimuladas con hCG y 2-OHE2.
Los valores son presentados como el promedio ± el error estándar. * P < 0.05.Basal vs hCG (5, 15 y 30 min) y hCG + 2-OHE2 (5, 15 y 30 min), n=5. # P < 0.05 hCG (5 min) vs hCG + 2-OHE2 (5 min), n=5.
Efecto del 2-OHE2 sobre la secreción de progesterona regulada por hCG en cultivo de células de la granulosa humana
La figura 3 muestra un gráfico de secreción de progesterona (ng/mL) al medio de cultivo de CG estimuladas por 24 horas con hCG y 2-OHE2. Se observó que hCG aumentó significativamente la secreción de progesterona de las CG en comparación a la condición basal luego de 24 horas de estímulo (n=5, * P<0.05). La incubación con 2-OHE2 (0,5 μM) en presencia de hCG aumentó significativamente la secreción de progesterona comparada con la condición basal y el estímulo solo con hCG (n=5, **P<0.05). Los valores son presentados como el promedio ± el error estándar. * Basal vs hCG n=5, P < 0.05. # hCG vs hCG + 2-OHE2, n=5, P < 0.05.
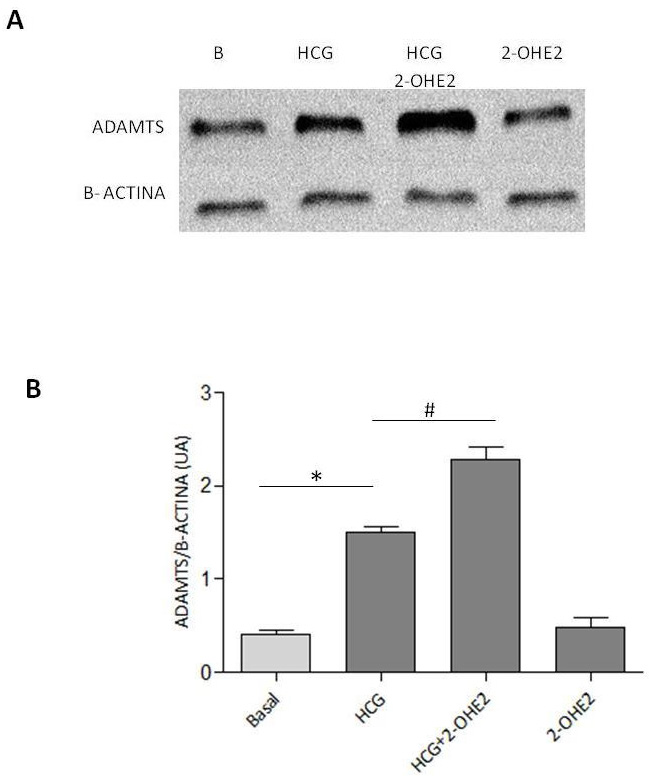 Figura 4: Niveles de ADAMTS y actina en células de la granulosa humanas.
Panel A: Western blotting de los niveles de ADAMTS y actina en células
de la granulosa estimuladas con hCG en presencia y ausencia de 2-OHE2.
Panel B: Gráfico de análisis densitométrico expresado en unidades
arbitrarias (UA).
Figura 4: Niveles de ADAMTS y actina en células de la granulosa humanas.
Panel A: Western blotting de los niveles de ADAMTS y actina en células
de la granulosa estimuladas con hCG en presencia y ausencia de 2-OHE2.
Panel B: Gráfico de análisis densitométrico expresado en unidades
arbitrarias (UA).
Los valores son presentados como el promedio ± el error estándar. * P < 0.05.Basal vs hCG (5, 15 y 30 min) y hCG + 2-OHE2 (5, 15 y 30 min), n=5. # P < 0.05 hCG (5 min) vs hCG + 2-OHE2 (5 min), n=5.
Expresión de la enzima ADAMTS, dependiente del receptor de progesterona, regulada por 2-hidroxiestradiol, en células de la granulosa humana
La figura 4 panel A corresponde a un Western blotting representativo de los niveles de ADAMTS y actina, realizados a partir de extractos proteicos de CG estimuladas con hCG 10 UI en presencia y ausencia de 2-OHE2 (0,5 μM) por 24 horas. En el panel B, el gráfico representa el análisis densitométrico, expresado en unidades arbitrarias (UA). Se observó que hCG (10 U/mL) aumenta los niveles de ADAMTS dependientes de RP comparada con la condición basal. Interesantemente, la presencia de 2-OHE-2 (0,5 μM) aumentó los niveles de ADAMTS regulados por hCG comparado con la condición solo estimulada por hCG. Los valores son presentados como el promedio ± el error estándar. * Basal vs hCG n=5, P < 0.05. # hCG vs hCG + 2-OHE2, n=5, P < 0.05.
Discusión
La expresión del RP en CG humanas es importante para la ruptura folicular, proceso clave en la ovulación humana9 y está mediada por LH y FSH a través de diversas vías de señalización intracelular como PKA, PKC y ERK1/26.
Los metabolitos de estradiol están presentes en fluido folicular a lo largo del desarrollo del folículo, regulando los procesos angiogénicos necesarios no sólo para el desarrollo folicular y selección del folículo dominante, sino también para el proceso ovulatorio donde sabemos que el RP es un factor clave16.
Específicamente el 2-OHE2 está presente en concentraciones elevadas en el folículo pre-ovulatorio lo que nos permite sugerir su importancia durante este proceso. Nuestros resultados muestran que la incubación con 2-OHE2 en presencia de hCG aumentó significativamente de la expresión del RP comparada con la condición basal y hCG (Figura 1). Lo que sugiere que este metabolito modula de forma positiva la expresión del RP regulada por hCG.
El metabolito 2-OHE2 podría regular la expresión del RP en CG, ya que existen antecedentes mostrando que 2-OHE2 puede regular la fosforilación de la vía ERK en otros tipos celulares18. Nuestros resultados muestran que 2-OHE2 regula la vía ERK aumentando significativamente su fosforilación (Figura 2).
Los resultados obtenidos se relacionan con antecedentes que indican que, previo a la ovulación, existe un ambiente folicular enriquecido en factores pro-angiogénicos como VEGF y un balance a favor de metabolitos del estradiol pro-angiogénicos en relación a los anti-angiogénicos16,17.
También ha sido documentado que el proceso de ruptura folicular requiere de una remodelación activa de la matriz extracelular, donde la expresión de enzimas especializadas como ADAMTS son fundamentales para el proceso ovulatorio6,9,10. Nosotros determinamos que 2-OHE2 aumenta significativamente los niveles de ADAMTS a las 24 hrs. de estímulo comparada con la condición basal y el estímulo solo con hCG (Figura 4).
Nuestros resultados muestran que el 2-OHE2 no solo regula la expresión de RP dependiente de hCG, sino que también incrementa la secreción de progesterona dependiente de hCG (Figura 3). Esta regulación positiva del receptor de progesterona también se evidencia al observar el aumento en los niveles de la enzima ADAMTS efectora del proceso de ruptura folicular. Todo este proceso sería mediado por la regulación de la vía de señalización intracelular ERK 1/2.
Estos hallazgos sugieren que 2-OHE2 actuaría como un agente pro-ovulatorio ya que no solo promueve un ambiente pro-angiogénico necesario para que se produzca la ovulación16,17, sino que también promueve la expresión de RP y ADAMTS favoreciendo la ruptura folicular.
Conclusión
De esta manera, este estudio aporta al mejor conocimiento de los procesos involucrados en la ovulación humana, teniendo posibles aplicaciones futuras en tratamientos de inducción de ovulación y en el desarrollo de nuevos métodos anticonceptivos.
Referencias
- White B. El sistema endocrino y el aparato reproductor. En: Koeppen B, Stanton B. Berne y Levy, 6ta ed. Fisiología. Elsevier. 2010; 43: 758-797.
- Stouffer RL. Progesterone as a mediator of gonadotrophin action in the corpus luteum: Beyond steroidogenesis. Hum Reprod Update. 2003; 9: 99-117.
- Lydon JP, DeMayo FJ, Funk CR, Mani SK, Hughes AR, Montgomery CA Jr, et al. Mice lacking progesterone receptor exhibit pleiotropic reproductive abnormalities. Genes Dev. 1995; 9: 2266-2278.
- Mulac-Jericevic B, Mullinax RA, DeMayo FJ, Lydon JP, Conneely OM. Subgroup of reproductive functions of progesterone mediated by progesterone receptor-B isoform. Science. 2000; 289: 1751-1754.
- Robker RL, Akison LK, Russell DL. Control of oocyte release by progesterone receptor-regulated gene expression. Nucl Recept Signal 2009; 7: e012.
- Henríquez S, Kohen P, Muñoz A, Godoy A, Orge F, Strauss JF 3rd, et al. In-vitro study of gonadotrophin signaling pathways in human granulosa cells in relation to progesterone receptor expression. Reprod BioMed Online. 2017; 35(4): 363-371.
- Duffy DM, Ko C, Jo M, Brannstrom M, Curry TE. Ovulation Parallels With Inflammatory Processes. Endocr Rev. 2019; 40(2): 369-416.
- Zakerkish F, Brännström M, Carlsohn E, Sihlbom C, van der Post S, Thoroddsen A. Proteomic analysis of follicular fluid during human ovulation. Acta Obstet Gynecol Scand. 2020; 99(7): 917-924.
- García V, Kohen P, Maldonado C, Villarroel C, Strauss JF, Devoto L. Transient expression of progesterone receptor and cathepsin-l in human granulosa cells during the periovulatory period. Fertil Steril. 2012; 97(3): 707-713.
- Porter S, Clark IM, Edwards DR. The ADAMTS metalloproteinases. Biochem J 2005; 386: 15-27.
- Devoto L, Fuentes A, Kohen P, Céspedes P, Palomino A, Pommer R, et al. The human corpus luteum: life cycle and function in natural cycles. Fertil Steril 2009; 92(3): 1067-1079.
- Mannisto PT, Kaakkola S. Catechol-O-methyltransferase (COMT): biochemistry, molecular biology, pharmacology, and clinical efficacy of the new selective COMT inhibitors. Pharmacol Rev. 1999; 51: 593-628.
- Dawling S, Hachey DL, Roodi N, Parl FF. In vitro model of mammary estrogen metabolism: Structural and kinetic differences between catechol estrogens 2- and 4- hydroxyestradiol. Chem Res Toxicol. 2004; 17: 1258-1264.
- Henríquez S, Kohen P, Xu X, Veenstra TD, Muñoz A, Palomino WA, et al. Estrogen metabolites in human corpus luteum physiology: Differential effects on angiogenic activity. Fertil Steril. 2016; 106(1): 230-237.
- Devoto L, Henríquez S, Kohen P, Strauss JF III. The significance of estradiol metabolites in human corpus luteum physiology. Steroids. 2017; 123: 50-54.
- Henríquez S, Kohen P, Xu X, Villarroel C, Muñoz A, Godoy A, et al. Significance of pro-angiogenic estrogen metabolites in normal follicular development and follicular growth arrest in Polycystic Ovarian Syndrome. Human Reprod. 2020; 35(7): 1655-1665.
- Henríquez S, Valdivia MJ, Mainigi M, Villarroel C, Velasquez L, Strauss III JF, Devoto L. The role of estrogen metabolites in human ovarian function. Steroids. 2024; 203: 109368.
- Landeros RV, Jobe SO, Magness RR. Convergent ERK1/2, p38 and JNK mitogen activated protein kinases (MAPKs) signalling mediate catecholoestradiol-induced proliferation of ovine uterine artery endothelial cells. J Physiol. 2017; 595(14): 4663-4676.
- Olivero P, Leiva-Salcedo E, Devoto L, Stutzin A. Activation of Clchannels by human chorionic gonadotropin in luteinized granulosa cells of the human ovary modulates progesterone biosynthesis. Endocrinology. 2008; 149(9): 4680-4687.