Aceite de rosa mosqueta (Rosa rubiginosa) disminuye marcadores inflamatorios en células hepáticas humanas HepG2 tratadas con lipopolisacárido
Amanda D’Espessailles1*, Manuel Soto2, Gonzalo Terreros3, Paulina Ormazábal4, Natalia Santillana5.
Rosa mosqueta (Rosa rubiginosa) oil decreases inflammatory markers in human liver cells HepG2 treated with lipopolysaccharide
- Bióloga, Msc Ciencias Biológicas, PhD. Nutrición y Alimentos. Instituto de Ciencias de la Salud, Universidad de O’Higgins, Rancagua, Chile.
- Estudiante de medicina. Escuela de Salud, Universidad de O’Higgins. Escuela de Salud, Universidad de O’Higgins, Rancagua, Chile.
- Biólogo, PhD, Ciencias mención Neurociencias. Instituto de Ciencias de la Salud. Universidad de O’Higgins, Rancagua, Chile.
- Bioquímica, PhD. Ciencias Biomédicas. Escuela de Obstetricia. Facultad de Ciencias para el Cuidado de la Salud, Universidad San Sebastián, Santiago, Chile.
- Nutricionista Msc Nutrición y Alimentos mención Nutrición Clínica.
Los autores declaran no tener conflictos de interés.
Financiamiento Proyecto SOCHED 20-08.
*Correspondencia: Amanda D’Espessailles
amanda.despessailles@uoh.cll
#Autor y coautor, contribuyeron equitativamente.
Recibido: 03-04-2024.
Aceptado: 13-05-2024.
Resumen: La alteración de la microbiota intestinal es uno de los factores claves
que afecta el inicio y la progresión de esteatosis hepática, al aumentar la permeabilidad
intestinal e inducir un aumento circulante de la endotoxina lipopolisacárido
(LPS). El LPS puede llegar al hígado a través de la vena porta, donde desencadena
procesos inflamatorios y pro-oxidantes. Por otro lado, alimentos ricos en aceites
esenciales podrían tener la capacidad de contrarrestar los efectos deletéreos del
LPS a nivel hepático. El objetivo de este estudio fue evaluar el efecto del aceite de
rosa mosqueta (ARM) en la prevención de procesos inflamatorios y oxidantes en
hepatocitos humanos HepG2 tratados con LPS. Células HepG2 fueron expuestas
a diferentes dosis de ARM (1,5, 3, 4,5, 6 y 7,5 μg/mL) por 24 horas y luego estimuladas
con LPS (100 ng/mL) por 4 horas. Se evaluaron los niveles de expresión de
citoquinas proinflamatorias (TNF-α, IL-6, IL-1β, CCL2) y de la proteína antioxidante
hemo oxigenasa 1 (HO-1), además de los niveles de activación de NF-κB. El tratamiento
con 6 μg/mL de ARM resultó en un incremento en la viabilidad celular. El
pretratamiento con ARM (1,5 - 4,5 μg/mL) fue efectivo para disminuir la expresión
(TNF-α, IL-6 y CCL2) y secreción (TNF-α) de citoquinas proinflamatorias. Sin embargo,
dosis altas de ARM incrementaron la activación de NF- κB y disminuyeron
la expresión de HO-1 en células tratadas con LPS. Estos resultados sugieren un
efecto antinflamatorio y un posible rol en el proceso antioxidante para dosis bajas
de ARM en hepatocitos humanos frente al daño con LPS.
Palabras clave: HepG2 cells; Inflammation; Lipopolysaccharides; Oxidative stress;
Plant oils.
Abstract: Rosa mosqueta (Rosa Rubiginosa) oil decreases inflammatory markers in human liver HepG2 cells treated with lipopolysaccharide. Gut microbiota alteration is one of the key factors affecting the onset and progression of hepatic steatosis by enhancing intestinal permeability and inducing an increase in circulating endotoxin lipopolysaccharide (LPS). LPS reaches the liver through the portal vein, where triggers inflammatory and pro-oxidant processes. On the other hand, essential oils-rich foods may have the capacity to abolish the deleterious effects of LPS in the liver. The objective of this study was to evaluate the effect of rosa mosqueta oil (ARM) in the prevention of inflammatory and oxidative processes in human hepatic cells HepG2 treated with LPS. HepG2 cells were exposed to different doses of ARM (1.5, 3, 4.5, 6 y 7.5 μg/mL) for 24 hours and then stimulated with LPS (100 ng/mL) for 4 hours. NF-κB activation, proinflammatory cytokines expression level (TNF-α, IL-6, IL-1β, CCL2), and the antioxidant protein expression of hem oxygenase 1 (HO-1) were evaluated. Treatment with 6 μg/mL increased cellular viability. ARM pretreatment was effective in decreasing the expression (TNF-α, IL-6 y CCL2) and secretion (TNF-α) of proinflammatory cytokines. On the other hand, high doses of ARM increased NF-κB activation and decreased HO-1 expression in cells treated with LPS. These results may suggest an anti-inflammatory effect and a possible role in the antioxidant process in the case of the lower doses of ARM in human hepatic cells treated with LPS.
Keywords: Hep G2 cells; Inflammation; Lipopolysaccharides; Oxidative stress; Plant oils.
Introducción
En los últimos años se ha descrito que diversas alteraciones metabólicas asociadas a la obesidad, como la esteatosis hepática, se manifiesta conjuntamente con la alteración de la microbiota intestinal, generando como consecuencia una desregulación en las poblaciones bacterianas, procesos inflamatorios y aumento de la permeabilidad intestinal1,2. Dicho incremento de la permeabilidad, propicia que productos bacterianos como el lipopolisacárido (LPS) puedan llegar al hígado a través de la vena porta, donde son reconocidos por receptores tipo Toll (TLR), desencadenando vías inflamatorias y prooxidantes. La unión del LPS a su receptor induce la activación del factor de transcripción factor nuclear (NF)-κB en monocitos, el cual en respuesta a estrés oxidativo controla la expresión y secreción de citoquinas proinflamatorias como el factor de necrosis tumoral (TNF)-α, interleuquina (IL)-6, IL-1β y quimioquina como CCL2, suscitando una respuesta inflamatoria3.
A nivel celular, el LPS induce un aumento en las especies reactivas del oxígeno, disfunción mitocondrial, estrés oxidativo y disminución de la respuesta antioxidante4. Uno de los principales mecanismos descritos en la desregulación de la homeostasis redox ante la exposición a LPS, es la disminución de la actividad del factor nuclear relativo a eritroide (Nrf)2. En condiciones fisiológicas, el Nrf-2 es traslocado al núcleo donde estimula la respuesta antioxidante y citoprotectora, promoviendo la expresión de genes relacionados con el metabolismo y balance óxido-reducción, como la enzima hemo oxigenasa (HO)-1, que previene la producción de radicales hidroxilos5. Interesantemente, la activación de NF-κB inhibe directamente la respuesta antioxidante del factor nuclear Nrf2 en células hepáticas humanas de la línea celular HepG26.
Dado lo anterior, y considerando que no existen tratamientos farmacológicos específicos para tratar los procesos inflamatorios asociados a alteraciones metabólicas en el hígado, resulta de gran interés la búsqueda de estrategias dietarias para tratarlos y/o prevenirlos. En ese sentido, el consumo de aceites vegetales constituidos por ácidos grasos saludables y con propiedades antioxidantes podría contribuir a contrarrestar la respuesta inflamatoria y oxidante inducida por LPS7,8,9.
El aceite de rosa mosqueta (ARM) es un aceite vegetal obtenido a partir de las semillas de un arbusto que crece en la toda la región andina, incluyendo la zona sur de Chile. Se caracteriza por sus altos niveles de ácido α-linoleico (18:3 n-3, ALA) y vitamina E, específicamente α- y γ- tocoferoles, en una proporción 1:510, que lo diferencia de otros aceites vegetales y lo destaca por su potencial antioxidante. En modelos animales, el ARM es efectivo para disminuir la generación de esteatosis hepática, resistencia a la insulina y la inflamación local y sistémica inducidas por la ingesta de una dieta alta en grasas11. Molecularmente, en un modelo animal, el ARM propicia la activación de Nrf2 y aumenta la expresión de HO-1, disminuyendo la expresión y secreción de citoquinas inflamatorias como IL-1β y TNF-α12.
A pesar del gran potencial y evidencia que tiene el ARM para el tratamiento de alteraciones metabólicas asociadas a la obesidad12,13,14, hasta la fecha no existe evidencia sobre el efecto del ARM a nivel hepático en humanos, ya sea in vivo o in vitro. Considerando lo anterior, el objetivo de este estudio fue evaluar el efecto de diferentes dosis de ARM en células hepáticas humanas HepG2 tratadas con LPS.
Materiales y métodos
Línea celular HepG2. Se utilizaron células derivadas de un carcinoma hepatocelular humano (HB-8065), validadas para el estudio celular in vitro de hepatocitos humanos15. Las células HepG2 se mantuvieron en un medio mínimo esencial (MEM), con suero fetal bovino al 10% suplementado con antibióticos (1% penicilina/estreptomicina) en una atmósfera controlada a 37°C con 5% de CO2. El cultivo se realizó sembrando a concentración de 2.5x104 células/cm2.
Tratamiento. El ARM (donado por Laboratorios COESAN ®, Chile y descrita su composición en D’Espessailles et al 2015)11 fue disuelto en dimetil sulfóxido (DMSO) a una concentración de 30 mg/mL, utilizándose la concentración máxima a la cual el ácido linoleico (el de mayor concentración en el ARM) puede disolverse en DMSO. Las células fueron tratadas con dosis de 1,5, 3, 4,5 y 7,5 μg/mL de ARM en MEM, según dosis utilizadas previamente . Como control, se utilizaron dosis equivalentes de DMSO en medio MEM. La concentración final de DMSO en el medio de cultivo fue menor a 0,1% en todos los casos. Los hepatocitos HepG2 fueron privados de suero por 24 horas, luego expuestos al ARM por 24 horas con las dosis anteriormente descritas, para posteriormente ser tratadas con 100 ng/mL lipopolisacárido (LPS, Sigma) durante 4 horas.
Evaluación de la viabilidad celular. Para establecer las dosis máximas seguras, se realizó un análisis de la citotoxicidad del ARM mediante el ensayo de MTS (Sigma-Aldrich, Francia) para las dosis de 1,5, 3, 4,5 y 7,5 μg/mL de ARM, según las instrucciones de fabricante. Cuantificación de proteínas (Western blot). La preparación de los lisados proteicos, electroforesis bajo condiciones denaturantes y transferencia a membranas de PVDF fue realizada según lo descrito previamente18. Posteriormente, las membranas fueron expuestas a anticuerpos primarios específicos: anti NF-κBp65, NF-κBp50, OH-1 y β-Tubulina (Santa Cruz, Inc). Los complejos proteína-anticuerpo se detectaron con una peroxidasa de rábano picante conjugada con un anticuerpo secundario, seguido de incubación con el sustrato de la enzima. La intensidad de las bandas se digitalizó en el sistema ChemiDoc Imaging System (Bio-Rad) y cuantificado usando el programa Image J (National Institutes of Health, USA).
Secreción de TNF-α. La secreción de la citoquina proinflamatoria TNF-α fue evaluada mediante el ELISA KIT Human TNF-α (ab181421, Abcam) en los medios de cultivo según las indicaciones del proveedor, como se ha descrito previamente19.
Evaluación de la expresión de mRNA (qPCR). Después de los tratamientos, las células fueron lisadas con Trizol (Invitrogen, Carlsbad, CA), para luego extraer el mRNA con el kit comercial E.Z.N.A. Total RNA (Promega), según las indicaciones del fabricante. Para la transcripción reversa se utilizó el kit High- Capacity cDNA Reverse Transcription (Applied Biosystems, USA). La cuantificación de la expresión del mRNA se realizó con el kit SYBR FAST qPCR (Applied Biosystems) en el equipo Step-one Realtime PCR System (Applied Biosystems, Foster City, USA), según las siguientes condiciones: preincubación a 95 °C por 20 s; 40 ciclos de 95 °C por 3 s, 60 °C por 30 s. Se usaron partidores específicos para TNF-α, IL6, CCL2, IL-1β y GAPDH (Tabla 1), este último se utilizó como gen housekeeping y la expresión de cada gen fue calculada usando el modelo de Pfaffl20. Los resultados fueron normalizados por el control.
Análisis estadístico. Para establecer el efecto de los tratamientos, las variables se evaluaron utilizando la prueba no paramétrica de Wilcoxon con rango de signo y Friedman. Se consideró significativo un p<0.05. Los datos fueron analizados utilizando el software Prism 2007 (GraphPad Software Inc., San Diego CA) y presentados como promedio ± SEM.
Tabla 1. Secuencias forward y reverse para genes en qPCR.

Resultados
1. Efecto del ARM sobre la viabilidad celular.
En la figura 1 se observa el efecto de diferentes
concentraciones del ARM por 24 horas sobre la viabilidad de
células HepG2, utilizando un kit comercial de MTS y evaluada
como % de viabilidad celular respecto al control. Se observa
que las dosis de 1,5, 3, 4,5 y 7.5 μg/mL no afectan la viabilidad
de las células HepG2 (p>0,05), mientras que el tratamiento con
6 μg/mL de ARM incrementa significativamente la viabilidad
celular en 16% respecto al control (p<0,05). Considerando
lo anterior, para las siguientes evaluaciones se utilizaron las
dosis de 1,5, 3 y 4,5 μg/mL.
2. Efecto del ARM sobre los niveles de expresión de mRNA
de citoquinas proinflamatorias.
Evaluamos el efecto del ARM en los niveles de mRNA de
citoquinas proinflamatorias (IL-6, IL-1β, TNF-α y CCL2) en células
HepG2 tratadas con LPS 100 ng/mL por 4 horas. En la figura
2 se observa que el tratamiento con ARM previno de forma
significativa el aumento de la expresión de las citoquinas TNF-α
y CCL2 incrementadas por LPS. Por otro lado, el uso 4,5 μg/mL
de ARM fue efectivo (p<0,05) para disminuir la expresión de
IL-6 en comparación al control, mientras que no tuvo variación
con los otros tratamientos. De forma interesante, la dosis de
4,5 μg/mL elevó (p<0,05) la expresión de mRNA de IL-1β.
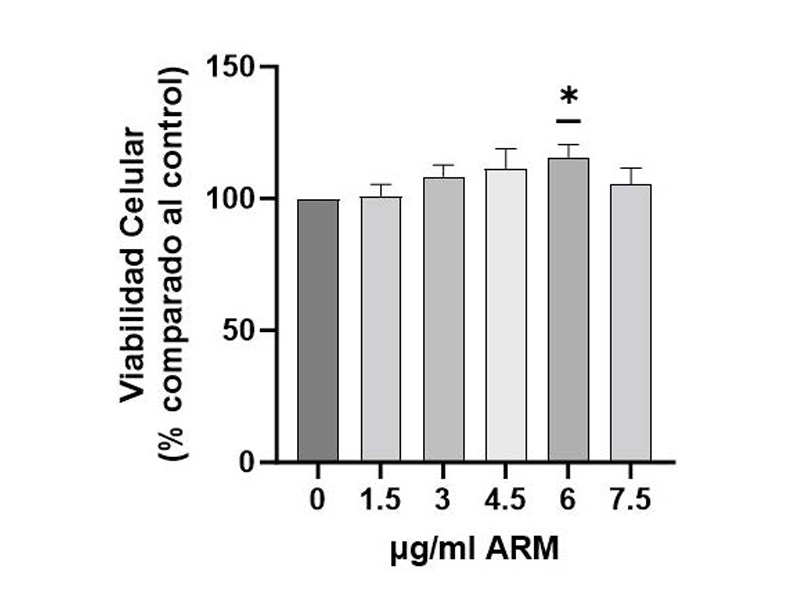 Figura 1: Efecto del aceite de rosa mosqueta (ARM) sobre la viabilidad celular
de células HepG2. Células HepG2 (n=6-7) fueron tratadas con ARM en dosis
de 1.5-7.5 μg/mL por 24 horas. Se utilizó el kit comercial CellTiter 96® AQueous
One Solution Cell Proliferation Assay (MTS). Los datos están graficados como
promedio ± SEM. Los * representan diferencias significativas (p<0.05, test
Wilcoxon Signed Rank) con el control.
Figura 1: Efecto del aceite de rosa mosqueta (ARM) sobre la viabilidad celular
de células HepG2. Células HepG2 (n=6-7) fueron tratadas con ARM en dosis
de 1.5-7.5 μg/mL por 24 horas. Se utilizó el kit comercial CellTiter 96® AQueous
One Solution Cell Proliferation Assay (MTS). Los datos están graficados como
promedio ± SEM. Los * representan diferencias significativas (p<0.05, test
Wilcoxon Signed Rank) con el control. 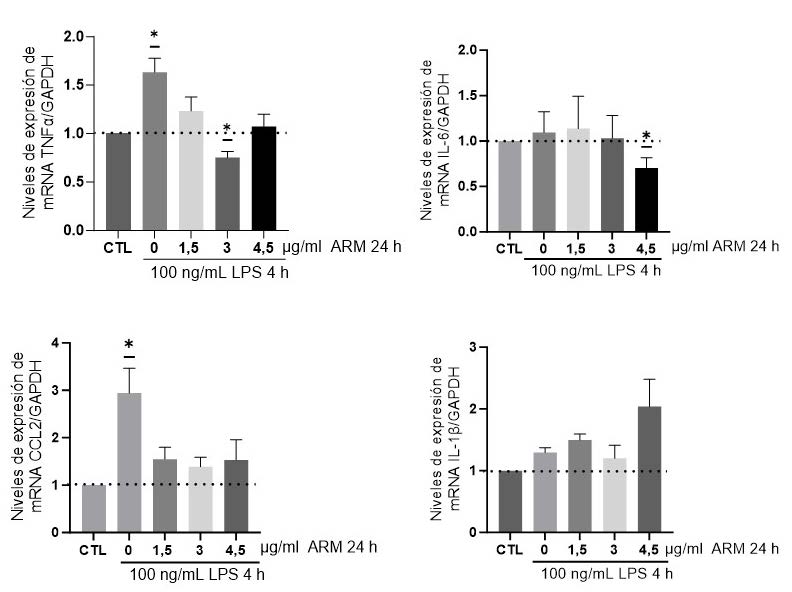 Figura 2: Efecto del aceite de rosa mosqueta (ARM) sobre los niveles de
expresión de mRNA de citoquinas proinflamatorias en células HepG2. Células
HepG2 (n=6) fueron tratadas con ARM en dosis de 1,5-4,5 μg/mL por 24 horas
y posteriormente con 100 ng/mL de LPS por 4 horas. La expresión de mRNA
de TNF-α, IL-6, CCL2 e IL-1β se evaluó por qPCR. Se utilizó la expresión de
GAPDH de cada muestra como control interno. La línea punteada representa
las células control tratadas con vehículo. Los datos están graficados como
promedio ± SEM. Los * representan diferencias significativas (p<0,05, test
Wilcoxon Signed Rank) con respecto al control.
Figura 2: Efecto del aceite de rosa mosqueta (ARM) sobre los niveles de
expresión de mRNA de citoquinas proinflamatorias en células HepG2. Células
HepG2 (n=6) fueron tratadas con ARM en dosis de 1,5-4,5 μg/mL por 24 horas
y posteriormente con 100 ng/mL de LPS por 4 horas. La expresión de mRNA
de TNF-α, IL-6, CCL2 e IL-1β se evaluó por qPCR. Se utilizó la expresión de
GAPDH de cada muestra como control interno. La línea punteada representa
las células control tratadas con vehículo. Los datos están graficados como
promedio ± SEM. Los * representan diferencias significativas (p<0,05, test
Wilcoxon Signed Rank) con respecto al control.3. Efecto del ARM sobre los niveles de NF-κB.
Para evaluar la actividad de NF-κB, se evaluó la fosforilación
de dicha proteína por Western blot, para luego analizar la
relación NF-κB fosforilado versus no fosforilado. El LPS por sí
sólo no generó incremento de la fosforilación de NF-kB. Por
otro lado, el tratamiento con LPS 100 ng/mL + ARM 4,5 μg/
mL incrementó significativamente (170%, p<0,05) la actividad
de NF-κB comparado con LPS solo, mientras que a dosis
menores de ARM no se encontró diferencia con el control o
con LPS (Figura 3).
4. Efecto del ARM sobre la secreción de TNF-α.
Se evaluó la secreción de TNF-α en medios de cultivo de
células HepG2 tratadas con ARM (1,5, 3 y 4,5 μg/mL) por 24
horas y luego con LPS 100 ng/mL por 4 horas. El tratamiento
de 1,5 μg/mL de ARM 24 h + LPS incrementó (300%, p<0,05)
la secreción de TNF-α respecto a LPS, mientras que el
tratamiento con una dosis mayor, de 3 μg/mL de ARM, previno
este aumento (84%, p<0,05). De forma interesante, la dosis
de 4,5 μg/mL de ARM generó valores indetectables de TNF-α
para todos los experimentos evaluados (Figura 4).
5. Efecto del ARM sobre los niveles de expresión proteicos
de OH-1.
Para evaluar el efecto antioxidante del ARM, evaluamos
los niveles de expresión de la proteína OH-1, cuya expresión
es regulada por Nrf2. El tratamiento con LPS no generó una
disminución significativa de la expresión de HO-1, mientras
que 1,5 μg/mL de ARM incrementó en 147% la expresión de
HO-1 comparado con el control (Figura 5).
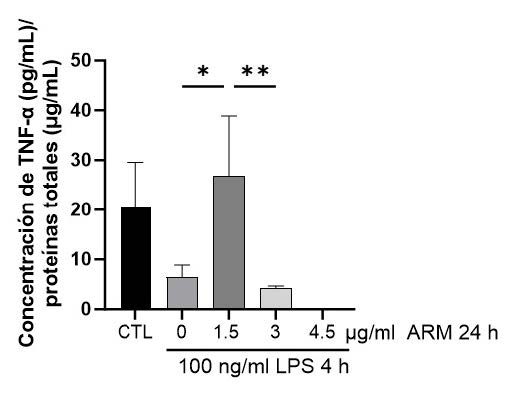 Figura 3: Efecto del aceite de rosa mosqueta (ARM) sobre los niveles de
fosforilación de NF-κB en células HepG2. Células HepG2 (n=6) fueron tratadas
con ARM en dosis de 1,5-4,5 μg/mL por 24 horas y posteriormente con 100
ng/mL de LPS por 4 horas. La fosforilación de NF-ĸB se expresó como la
razón entre fosfo-NF-ĸB y la proteína total NF-ĸB a través de Western blot. Los
datos están graficados como promedio ± SEM. Los * representan diferencias
significativas (p<0,05, Friedman y post test de Dunn) entre los grupos.
Figura 3: Efecto del aceite de rosa mosqueta (ARM) sobre los niveles de
fosforilación de NF-κB en células HepG2. Células HepG2 (n=6) fueron tratadas
con ARM en dosis de 1,5-4,5 μg/mL por 24 horas y posteriormente con 100
ng/mL de LPS por 4 horas. La fosforilación de NF-ĸB se expresó como la
razón entre fosfo-NF-ĸB y la proteína total NF-ĸB a través de Western blot. Los
datos están graficados como promedio ± SEM. Los * representan diferencias
significativas (p<0,05, Friedman y post test de Dunn) entre los grupos. Figura 4: Efecto del aceite de rosa mosqueta (ARM) sobre la secreción de
TNF-α en células HepG2. Células HepG2 (n=6) fueron tratadas con ARM en
dosis de 1,5-4,5 μg/mL por 24 horas y posteriormente con 100 ng/mL de LPS
por 4 horas. Se cuantificó la concentración de TNF-α en medios de cultivo
mediante un ELISA. Los datos están graficados como promedio ± SEM. Los *
representan diferencias significativas (p<0,05, Friedman y post test de Dunn)
entre los grupos.
Figura 4: Efecto del aceite de rosa mosqueta (ARM) sobre la secreción de
TNF-α en células HepG2. Células HepG2 (n=6) fueron tratadas con ARM en
dosis de 1,5-4,5 μg/mL por 24 horas y posteriormente con 100 ng/mL de LPS
por 4 horas. Se cuantificó la concentración de TNF-α en medios de cultivo
mediante un ELISA. Los datos están graficados como promedio ± SEM. Los *
representan diferencias significativas (p<0,05, Friedman y post test de Dunn)
entre los grupos.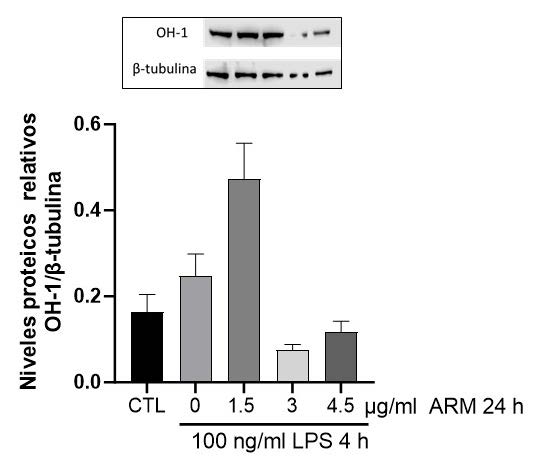 Figura 5: Efecto del aceite de rosa mosqueta (ARM) sobre los niveles de expresión
proteicos de OH-1 (WB) en células HepG2. Células HepG2 (n=3) fueron tratadas
con ARM en dosis de 1,5-4,5 μg/mL por 24 horas y posteriormente con 100 ng/
mL de LPS por 4 horas. Se cuantificó OH-1 a través de Westernblot, utilizando
β-tubulina como control interno. Los datos están graficados como promedio ±
SEM, y se consideró significativo p<0,05, con Friedman y post test de Dunn.
Figura 5: Efecto del aceite de rosa mosqueta (ARM) sobre los niveles de expresión
proteicos de OH-1 (WB) en células HepG2. Células HepG2 (n=3) fueron tratadas
con ARM en dosis de 1,5-4,5 μg/mL por 24 horas y posteriormente con 100 ng/
mL de LPS por 4 horas. Se cuantificó OH-1 a través de Westernblot, utilizando
β-tubulina como control interno. Los datos están graficados como promedio ±
SEM, y se consideró significativo p<0,05, con Friedman y post test de Dunn.Discusión
Este estudio corresponde a una de las primeras evidencias del efecto protector del ARM en células humanas. En este sentido, nuestros resultados sugieren que el pretratamiento con ARM tiene efecto antiinflamatorio en células HepG2 tratadas con LPS. Estos resultados se condicen con lo observado en modelos animales, donde la suplementación con ARM ejerció acciones antinflamatorias y antioxidantes a nivel hepático12.
El tratamiento con ARM a dosis bajas (iguales o menores 3 μg/m) fue adecuado para disminuir la expresión (TNF-α y CCL2) y secreción de citoquinas proinflamatorias (TNF-α). El ARM tiene niveles elevados de ALA y de α y γ -tocoferoles (vitamina E)21, lo que puede explicar los efectos protectores observados. En consonancia con estos resultados, Shen et al22 encontraron que el tratamiento con ALA redujo la respuesta inflamatoria inducida por LPS en células endoteliales humanas. Además de los efectos directos de ALA23, este ácido graso puede bioconvertirse en ácido eicosapentaenoico (EPA) y docosahexaenoico (DHA) a nivel hepático. Tanto el EPA como el DHA son ácidos grasos ω-3 de cadena larga con una gran actividad biológica, pudiendo modular el metabolismo de lípidos hepáticos, promoviendo la beta oxidación y disminuyendo la lipogénesis hepática24. Además, EPA y DHA presentan acción antiinflamatoria al aumentar la expresión de PPAR-α e inhibiendo la acción de NF-kB, un complejo proteico relevante en procesos inflamatorios25. La bioconversión de ALA a EPA y DHA es controversial en humanos, pero ha sido observada en células HepG226. De manera relevante, la mayor tasa de conversión desde ALA (ω-3) a EPA y DHA corresponde a cuando la proporción de ácido linolénico (LA, ω-6) y ALA es 1:1, disminuyendo así la competencia por las desaturasas. En este sentido, el ARM tiene una proporción de LA y ALA de 1,3:1 21, por lo que existe un gran potencial de bioconversión a EPA y DHA en nuestro modelo. Estos datos sugieren que ALA podría ser uno de los componentes claves en otorgar los efectos antiinflamatorios observados en nuestro estudio.
Por otro lado, el ARM tiene un contenido interesante de tocoferoles, presentando 74 mg de α-tocoferol y 359 mg de γ-tocoferol por cada 100 g de aceite11. Ambos tocoferoles presentan propiedades antiinflamatorias, siendo esta actividad mayor para γ-tocoferol27. Los tocoferoles α y γ promueven la actividad del factor antioxidante Nrf228, induciendo su traslocación nuclear y el consecuente aumento de la expresión génica de proteínas antioxidantes, como HO-1. Esta evidencia podría explicar el aumento en los niveles de HO-1 observado en las células tratadas con dosis bajas de ARM (1,5 μg/mL), sugiriendo que, a dichas dosis, el ARM podría desencadenar una respuesta antioxidante. Además de la acción directa de los tocoferoles, éstos son metabolizados produciendo diversos metabolitos bioactivos de cadena larga, los cuales inhiben procesos inflamatorios por medio de la disminución de la expresión de la sintasa de óxido nítrico29.
De manera interesante, observamos que el tratamiento con dosis altas de ARM (4,5 μg/mL) generó un incremento en los marcadores inflamatorios, aumentando la actividad del factor transcripcional NF-kB y la expresión de la citoquina IL-1β. Otros estudios han observado que dosis elevadas de ALA promueven aumento de superóxido intracelular y daño lisosomal in vitro, induciendo estrés oxidativo y citotoxicidad moderada22. Considerando que el estrés oxidativo es uno de los reguladores positivos de NF-κB3, es posible que dosis elevadas de ARM induzcan la activación de NF-κB mediante la generación de estrés oxidativo, lo cual se condice con los resultados obtenidos en este estudio.
En conclusión, estos resultados sugieren un efecto antiinflamatorio y un posible rol antioxidante para dosis bajas de ARM en hepatocitos HepG2 frente al daño con LPS, mientras que dosis elevadas podrían desencadenar procesos inflamatorios dependientes de NF-kB. Se requiere mayor investigación para establecer la seguridad y beneficios del consumo de aceite de RM su consumo en humanos.
Agradecimientos
A Dra. Mariana Cifuentes, Laboratorio OMEGA, INTA,
Universidad de Chile, por el uso de las instalaciones de su
laboratorio durante el desarrollo de este trabajo.
Referencias
- Bashiardes S, Shapiro H, Rozin S, Shibolet O, Elinav E. Non-alcoholic fatty liver and the gut microbiota. Mol Metab. Published online 2016. doi: 10.1016/j.molmet.2016.06.003
- Tumani MF, Tapia G, Aguirre C, Obregón AM, Pettinelli P. Rol de la microbiota intestinal en el desarrollo del hígado graso no alcohólico. Rev Med Chil. 2021; 149(4): 570-579. doi:10.4067/s0034-98872021000400570
- Liu T, Zhang L, Joo D, Sun SC. NF-κB signaling in inflammation. Signal Transduct Target Ther. 2017; 2(1): 17023. doi:10.1038/sigtrans.2017.23
- Raza H, John A, Shafarin J. Potentiation of LPS-induced apoptotic cell death in human hepatoma HepG2 cells by aspirin via ROS and mitochondrial dysfunction: Protection by N-acetyl cysteine. PLoS One. Published online 2016. doi: 10.1371/journal.pone.0159750
- Luo JF, Shen XY, Lio CK, et al. Activation of Nrf2/HO-1 pathway by Nardochinoid C inhibits inflammation and oxidative stress in lipopolysaccharide-stimulated macrophages. Front Pharmacol. Published online 2018. doi:10.3389/fphar.2018.00911
- Liu G H, Q u J , S hen X . N F-κB/p65 a ntagonizes N rf2-ARE p athway by depriving CBP from Nrf2 and facilitating recruitment of HDAC3 to MafK. Biochim Biophys Acta - Mol Cell Res. 2008;1783(5):713-727. doi: 10.1016/j.bbamcr.2008.01.002
- Chen Q, Wang T, Li J, et al. Effects of natural products on fructoseinduced nonalcoholic fatty liver disease (NAFLD). Nutrients. Published online 2017. doi: 10.3390/nu9020096
- Hu Q, Zhang T, Yi L, Zhou X, Mi M. Dihydromyricetin inhibits NLRP3 inflammasome-dependent pyroptosis by activating the Nrf2 signaling pathway in vascular endothelial cells. BioFactors. Published online 2018. doi: 10.1002/biof.1395
- Feng X, Yu W, Li X, et al. Apigenin, a modulator of PPARγ, attenuates HFD-induced NAFLD by regulating hepatocyte lipid metabolism and oxidative stress via Nrf2 activation. Biochem Pharmacol. Published online 2017. doi: 10.1016/j.bcp.2017.04.014
- Juretic N, Sepúlveda R, D’Espessailles A, et al. Dietary alpha and gamma-tocopherols (1:5) supplementation attenuates adipose tissue expansion, hepatic steatosis, and expression of inflammatory markers in a high-fat diet-fed murine model. Nutrition. Published online January 7, 2021: 111139. doi: 10.1016/j.nut.2021.111139
- D’Espessailles A, Dossi CG, Espinosa A, González-Mañán D, Tapia GS. Dietary Rosa mosqueta (Rosa rubiginosa) oil prevents high dietinduced hepatic steatosis in mice. Food Funct. Published online 2015. doi:10.1039/c5fo00741k
- González-Mañán D, Espessailles AD, Dossi CG, Martín MS, Mancilla RA, Tapia GS. Rosa mosqueta oil prevents oxidative stress and inflammation through the upregulation of PPAR-α and NRF2 in C57BL/6J mice fed a high-fat diet. J Nutr. Published online 2017. doi:10.3945/jn.116.243261
- Dossi CG, González-Mañán D, Romero N, Silva D, Videla LA, Tapia GS. Anti-oxidative and anti-inflammatory effects of Rosa Mosqueta oil supplementation in rat liver ischemia-reperfusion. Food Funct. Published online 2018. doi:10.1039/c8fo00969d
- D’Espessailles A, Dossi CG, Espinosa A, González-Mañán D, Tapia GS. Dietary Rosa mosqueta (Rosa rubiginosa) oil prevents high dietinduced hepatic steatosis in mice. Food Funct. 2015; 6(9): 3109-3116. doi: 10.1039/c5fo00741k
- Javitt NB. Hep G2 cells as a resource for metabolic studies: lipoprotein, cholesterol, and bile acids. FASEB J. Published online 1990. doi: 10.1096/fj.1530-6860
- Tapia G, Silva D, Romero N, et al. Role of dietary α- and γ-tocopherol from Rosa mosqueta oil in the prevention of alterations induced by high-fat diet in a murine model. Nutrition. Published online 2018. doi: 10.1016/j.nut.2018.01.012
- Rossi M, Caruso F, Kwok L, et al. Protection by extra virgin olive oil against oxidative stress in vitro and in vivo. Chemical and biological studies on the health benefits due to a major component of the Mediterranean diet. PLoS One. Published online 2017. doi: 10.1371/ journal.pone.0189341
- Villarroel P, Mattar P, D’Espessailles A, et al. Calcium sensing receptor effects in adipocytes and liver cells: Implications for an adiposehepatic crosstalk. Arch Biochem Biophys. 2016; 607. doi: 10.1016/j. abb.2016.08.017
- D’Espessailles A, Mora YA, Fuentes C, Cifuentes M. Calcium-sensing receptor activates the NLRP3 inflammasome in LS14 preadipocytes mediated by ERK1/2 signaling. J Cell Physiol. Published online 2018. doi: 10.1002/jcp.26490
- Pfaffl MW. A new mathematical model for relative quantification in real-time RT-PCR. Nucleic Acids Res. 2001; 29(9): e45. doi: 10.1093/ nar/29.9.e45
- González-Mañán D, Tapia G, Gormaz JG, et al. Bioconversion of α-linolenic acid to n-3 LCPUFA and expression of PPAR-alpha, acyl coenzyme A oxidase 1 and carnitine acyl transferase i are incremented after feeding rats with α-linolenic acid-rich oils. Food Funct. 2012; 3(7): 765-772. doi: 10.1039/c2fo30012e
- Shen Y, Chen G, Xiao A, Xie Y, Liu L, Cao Y. In vitro effect of flaxseed oil and α-linolenic acid against the toxicity of lipopolysaccharide (LPS) to human umbilical vein endothelial cells. Inflammopharmacology. 2018; 26(2): 645-654. doi: 10.1007/s10787-017-0400-x
- Monteiro J, Askarian F, Nakamura MT, Moghadasian MH, Ma DWL. Oils rich in α-linolenic acid independently protect against characteristics of fatty liver disease in the Δ6-desaturase null mouse. Can J Physiol Pharmacol. 2013; 91(6): 469-479. doi: 10.1139/cjpp-2012-0308
- Scorletti E, Bhatia L, Mccormick KG, et al. Effects of purified eicosapentaenoic and docosahexaenoic acids in nonalcoholic fatty liver disease: Results from the WELCOME* study. Hepatology. Published online 2014. doi: 10.1002/hep.27289
- Tapia G, Valenzuela R, Espinosa A, et al. N-3 long-chain PUFA supplementation prevents high fat diet induced mouse liver steatosis and inflammation in relation to PPAR-α upregulation and NF-κB DNA binding abrogation. Mol Nutr Food Res. 2014; 58(6): 1333-1341. doi: 10.1002/mnfr.201300458
- Harnack K, Andersen G, Somoza V. Quantitation of alpha-linolenic acid elongation to eicosapentaenoic and docosahexaenoic acid as affected by the ratio of n6/n3 fatty acids. Nutr Metab (Lond). 2009; 6(1): 8. doi: 10.1186/1743-7075-6-8
- Smolarek AK, So JY, Thomas PE, et al. Dietary tocopherols inhibit cell proliferation, regulate expression of ERα, PPARγ, and Nrf2, and decrease serum inflammatory markers during the development of mammary hyperplasia. Mol Carcinog. Published online 2013. doi: 10.1002/mc.21886
- Niture SK, Khatri R, Jaiswal AK. Regulation of Nrf2-an update. Free Radic Biol Med. 2014; 66: 36-44. doi: 10.1016/j.freeradbiomed.2013.02.008
- Galli F, Azzi A, Birringer M, et al. Vitamin E: Emerging aspects and new directions. Free Radic Biol Med. Published online 2017. doi: 10.1016/j. freeradbiomed.2016.09.017