Expresión de los receptores ErbBs en músculos de ratones obesos por una dieta alta en grasa
Ximena Ramírez1, Gladys Tapia2, Gonzalo Jorquera3, Ernesto Uribe4, Mónica Silva5, Pabla Aguirre6, Bastián Retamales7, Felipe Valdivia7, Paola Llanos8, Nevenka Juretić9,*.
Expression of ErbBs receptors in muscles of obese mice by a high-fat diet
- Tecnóloga Médica. Programa de Biología Celular y Molecular, Instituto de Ciencias Biomédicas (ICBM), Facultad de Medicina, Universidad de Chile, Santiago, Chile.
- Bióloga, PhD. Programa de Farmacología Molecular y Clínica, ICBM, Facultad de Medicina, Universidad de Chile, Santiago, Chile.
- Bioquímico, PhD. Instituto de Nutrición y Tecnología de los Alimentos (INTA), Universidad de Chile, Santiago, Chile.
- Biólogo. Programa de Biología Celular y Molecular, Instituto de Ciencias Biomédicas (ICBM), Facultad de Medicina, Universidad de Chile, Santiago, Chile.
- Licenciada en Biotecnología, Mag. en Fisiología. Programa de Fisiología y Biofísica, ICBM, Facultad de Medicina, Universidad de Chile, Santiago, Chile.
- Ingeniera en Biotecnología Molecular. Instituto de Nutrición y Tecnología de los Alimentos (INTA), Universidad de Chile, Santiago, Chile.
- Estudiante de Tecnología Médica. Programa de Biología Celular y Molecular, Instituto de Ciencias Biomédicas (ICBM), Facultad de Medicina, Universidad de Chile, Santiago, Chile.
- Profesora de Biología y Ciencias Naturales, PhD. Instituto de Investigación en Ciencias Odontológicas (ICOD), Facultad de Odontología, Universidad de Chile, Santiago, Chile.
- Bioquímica, PhD. Programa de Biología Celular y Molecular, Instituto de Ciencias Biomédicas (ICBM), Facultad de Medicina, Universidad de Chile, Santiago, Chile.
*Correspondencia:
Nevenka Juretić / njuretic@uchile.cl
Independencia 1027, Independencia, Santiago, Chile.
Financiamiento: Proyecto Sociedad Chilena de Endocrinología y Diabetes (SOCHED) 2021-06 (NJ), FONDECYT
11220927 (GJ).
Recibido: 03-01-2025.
Aceptado: 06-03-2025.
Resumen
La obesidad junto con el sedentarismo y la alimentación poco saludable contribuyen a la aparición del Síndrome metabólico, conjunto de alteraciones metabólicas que aumentan la posibilidad de padecer diabetes, problemas cardíacos, vasculares y cerebrales. El órgano más importante para la homeostasis de los niveles de glucosa sanguínea es el músculo esquelético, ya que es el responsable de aproximadamente el 80% de la captación y degradación de la glucosa estimulada por insulina en individuos metabólicamente sanos. Estudios previos han propuesto que una disminución de los niveles de la mioquina neuregulina (NRG) se asocia con la obesidad. Recientemente se ha descrito que una dieta alta en grasa (DAG) disminuye la expresión de los receptores de NRG (denominados ErbBs) en hígado y tejido adiposo. Sin embargo, se desconoce el efecto de una DAG en la expresión de ErbBs en músculo. Nuestro objetivo fue comparar la expresión de ErbB2, ErbB3 y ErbB4 en músculos rápidos y lento de ratones obesos y normopesos. Ratones C57BL/6 fueron alimentados con dieta control (DC) o DAG durante 12 semanas (n=7-9/grupo). Se extrajo el músculo lento sóleo (S) y los músculos rápidos flexor digital de los dedos (F) y gastrocnemio (G). Se determinó la expresión génica mediante qPCR y la expresión proteica mediante Western blot. Se observó una disminución significativa de los niveles de mRNA de ErbB2 y ErbB3 sólo en el músculo F al comparar el grupo DAG con DC. Sin embargo, al analizar los niveles proteicos de ErbB3, no se observaron diferencias significativas en los músculos F ni S, pero si se observó un aumento estadísticamente significativo en el músculo G. Concluimos que una DAG aumenta la expresión de los ErbBs en un músculo rápido glicolítico (G), lo que podría estar relacionado con su función y el efecto protector de la vía NRG en ratones obesos.
Palabras clave: ErbBs; Mioquina; Músculos; Neuregulina; Obesidad.
Abstract
Obesity together with a sedentary lifestyle and unhealthy eating habits contribute
to the onset of metabolic syndrome, a set of metabolic disorders that increase the
likelihood of diabetes, heart, vascular and brain problems. The most important organ
for the homeostasis of blood glucose levels is skeletal muscle, which is responsible
for approximately 80% of insulin-stimulated glucose uptake and breakdown in
metabolically healthy individuals. Previous studies have proposed that decreased
levels of the myokine neuregulin (NRG) are associated with obesity. Recently, it has
been reported that a high-fat diet (HFD) decreases the expression of NRG receptors
(called ErbBs) in liver and adipose tissue. However, the effect of a DAG on ErbBs
expression in muscle is unknown. Our aim was to compare the expression of ErbB2,
ErbB3 and ErbB4 in fast and slow muscles of obese and normopese mice. C57BL/6
mice were fed control diet (CD) or DAG for 12 weeks (n=7-9/group). The slow
soleus (S) and fast digital finger flexor (F) and gastrocnemius (G) muscles were excised.
Gene expression was determined by qPCR and protein expression by Western
blot. A significant decrease in ErbB2 and ErbB3 mRNA levels was observed only in
the F muscle when comparing the DAG group with DC. However, when analysing
ErbB3 protein levels, no significant differences were observed in F and S muscles,
but a statistically significant increase was observed in G muscle. We conclude that a
DAG increases the expression of ErbBs in fast glycolytic (G) muscle, which could be
related to its function and the protective effect of the NRG pathway in obese mice.
Keywords: ErbBs; Myokine; Muscles; Neuregulin; Obesity.
Introducción
Chile se ubica dentro de los cinco países con mayores tasas de obesidad en Latinoamérica1. Junto con el sedentarismo y la alimentación poco saludable, la obesidad contribuye a la aparición del Síndrome metabólico, el cual se describe como un conjunto de alteraciones metabólicas que incrementan la posibilidad de padecer diabetes y problemas cardíacos, vasculares y cerebrales2.
El músculo esquelético es el órgano más importante para la homeostasis de la glucosa sanguínea en el organismo, ya que es el responsable de aproximadamente el 80% de la captación y catabolismo de la glucosa estimulada por insulina en individuos metabólicamente sanos. La resistencia a la insulina (RI) aumenta el riesgo de desarrollar diabetes mellitus tipo 2 (DM2), por lo tanto, una desregulación del metabolismo en el músculo es fundamental para el desarrollo de esta patología3.
Neuregulina (NRG) es una mioquina que pertenece a la familia del factor de crecimiento epidermal (EGF). Los receptores para NRG (denominados ErbBs) son una familia de receptores proteicos que presentan actividad tirosina quinasa (TK) y están relacionadas estructuralmente con el receptor de EGF. Existen 3 isoformas: ErbB2, ErbB3 y ErbB44,5. Dentro de las características estructurales de estos receptores, se ha descrito que ErbB2 posee un dominio citosólico TK catalíticamente activo, pero carece de un dominio de unión a ligando; el receptor ErbB3 reconoce a NRG, pero carece de actividad TK. Sólo el receptor ErbB4 posee tanto la capacidad de unión a NRG como la actividad TK, por lo que puede activarse como homo o heterodímero. Por lo tanto, los receptores ErbB2 y ErbB3 deben necesariamente heterodimerizar para complementarse y ser funcionales6.
La vía de señalización NRG/receptores ErbBs ha sido estudiada en diversos contextos. En el músculo esquelético se ha descrito principalmente su participación en el metabolismo de la glucosa durante la contracción muscular, favoreciendo la translocación de los transportadores de glucosa GLUT4 a la membrana celular para facilitar la captación y el ingreso de la glucosa hacia el citosol, por lo que resulta interesante ya que se ha propuesto que la vía de NRG cumple una función análoga a la insulina6.
Además, NRG contribuye a la regulación de la masa muscular esquelética aumentando la síntesis proteica7, incrementa la capacidad oxidativa mitocondrial y la sensibilidad a la insulina8 y puede desempeñar un papel importante en la diferenciación de las células satélites en la regeneración muscular9. Por lo tanto, aunque NRG se describió inicialmente como un factor neurotrófico implicado en la formación de la unión neuromuscular en el músculo esquelético, en los últimos años se ha considerado como una mioquina que ejerce efectos relevantes sobre la miogénesis, la regulación del metabolismo muscular y la regeneración6.
Junto con esto, recientemente se ha descrito que una dieta alta en grasa (DAG) disminuye la expresión de los receptores ErbBs en hígado y tejido adiposo, por lo que se ha propuesto que la vía de NRG cumple un rol protector ante la obesidad10. Sin embargo, hasta la fecha no hay estudios que describan el efecto de una DAG en la expresión de los receptores ErbBs en el músculo esquelético. El objetivo de este estudio fue comparar la expresión de los receptores ErbB2, ErbB3 y ErbB4 en músculos rápidos y lentos de ratones obesos y normopesos.
Materiales y Métodos
Modelo experimental: Ratones macho de la cepa C57BL/6 se obtuvieron del Bioterio Central, Facultad de Medicina, Universidad de Chile. Se mantuvieron en condiciones de temperatura constante de 21°C con libre acceso a agua y alimentación en ciclos de luz/oscuridad de 12 h. Los protocolos de uso y cuidado de animales fueron aprobados por la Comité de Bioética sobre Investigación en Animales de la Facultad de Medicina de la Universidad de Chile (CBA 0639, FMUCH). Los animales de peso inicial de 12-14 g fueron separados aleatoriamente en 2 grupos experimentales y alimentados con distintas dietas durante 12 semanas: Dieta control (DC) (D12450B, Research Diets, NJ, USA; 10% de grasa, 20% de proteínas y 70% de carbohidratos) y DAG (D12492, Research Diets, NJ, USA; 60% de grasa, 20% de proteínas y 20% de carbohidratos). n= 7 a 9 para cada grupo.
Se evaluó peso corporal, glicemia, insulinemia e índice de resistencia a la insulina (HOMA) como medidas de control metabólico.
Determinaciones bioquímicas: La RI se estimó mediante HOMA-IR [insulina en ayunas (μUI/mL) x glucosa en ayunas (mg/dL)/405]11.
Histología del tejido adiposo: El tejido adiposo visceral fue pesado y fijado en amortiguador fosfato/formalina 10% y embebido en parafina para posterior técnica histológica. Las secciones de tejido adiposo se tiñeron con hematoxilinaeosina y se evaluaron mediante microscopía óptica a 400×. Se tomaron diez imágenes aleatorias por portaobjetos utilizando el software Micrometrics SE Premium (Accu Scope Inc., Commack, NY, EE. UU.). Se utilizó el software Fiji (ImageJ v.1.51 n; Institutos Nacionales de Salud, Bethesda, MD, EE. UU.) para medir el área de la sección transversal de los adipocitos individuales en cada imagen.
Extracción de los músculos: Los ratones fueron sometidos a ayuno (6-8 horas) y anestesiados con isofluorano 2,5%. Se extrajeron los músculos sóleos (S), flexor digital de los dedos (F) y gastrocnemios (G).
Extracción del RNA total de músculos enteros: Los músculos fueron homogeneizados utilizando el homogeneizador Fluko Superfine (Sumilab). Las muestras se centrifugaron a 12.000 rpm por 10 min a 4-8ºC y se recuperó el sobrenadante. Se utilizó el reactivo de Trizol (Invitrogen) de acuerdo a las instrucciones del fabricante. Para eliminar el DNA genómico se utilizó el kit TURBO DNA-free ™ (Invitrogen). La concentración de RNA total se determinó espectrofotométricamente mediante la medición de su absorbancia a 260 nm.
Síntesis de cDNA por transcripción reversa: Se siguió el protocolo incluido en el kit para RT-PCR de la enzima Super Script II (Invitrogen). Se incluyó como control un tubo -RT que contenía todos los reactivos excepto la enzima. El cDNA fue guardado a -20ºC hasta su utilización.
Reacción en cadena de la polimerasa cuantitativo (qPCR): Se realizó en un Termociclador Stratagene Mx3000p QPCR System (Agilent Technologies), utilizando el reactivo 5X HOT FIREPol EvaGreen QPCR Mix Plus (Solis BioDyne), de acuerdo a las instrucciones del fabricante. Se incluyó como control un blanco, que contiene todos los reactivos excepto el cDNA de las muestras. Todos los experimentos se realizaron por duplicado.
Los partidores utilizados se describen en la siguiente tabla. Se utilizó Gliceraldehído 3-fosfato deshidrogenasa (GAPDH) como gen constitutivo:
| Partidor | Secuencia |
| ErbB2 (66 pb) ́ | (S) 5 ́-GCTGCCCGAAACGTGCTA-3 ́ (AS) 5 ́-CCGTGCCAGCCCGAA-3 |
| ErbB3 (72 pb) | (S) 5 ́-AGGCTTGTCTGGATTCTGTGGTT-3 ́ (AS) 5 ́-GGGATCGGGTGCAGAGAGA-3 ́ |
| ErbB4 (70 pb) | (S) 5 -́ GGAGGCTGCTCAGGACCAA-3 ́ (AS) 5 -́ ACGCAGGCTCCACTGTCAT-3 ́ |
| GAPDH (350 pb) | (S) 5`-TCCGCCCCTTCCGCTGATG-3` (AS) 5`-CACGGAAGGCCATGCCAGTGA-3 |
Para realizar la cuantificación del cDNA se utilizó el programa Mxpro Software (Comparative cuantification) de Stratagene. El análisis de los resultados se efectuó a través del algoritmo Delta-Delta Ct (2-ΔΔCt)12.
Western blot: Los músculos fueron homogeneizados junto a un buffer de lisis que contiene tampón T-PER (Sigma- Aldrich, St. Louis, MO, USA), inhibidores de proteasas (EGTA 100mM, EDTA 100mM, BAPTA 100mM, PMSF 200mM, Benzamidina), inhibidores de fosfatasas (Na3VO4 1M, NaF 1M) y un cóctel completo de inhibidores 2x (Sigma-Aldrich, St. Louis, MO, USA). Los lisados celulares fueron sonicados y centrifugados. La determinación de la concentración de proteínas se realizó por el método Sulfosalicílico. 40 μg totales de proteínas fueron separadas en geles SDS-PAGE al 8% y transferidas a membranas PVDF. Los anticuerpos primarios anti-ErbB2 (Neu C-18; sc-284), anti-ErbB3 (G-4; sc-7390) y anti-ErbB4 (C-18; sc-283) fueron adquiridos en Santa Cruz Biotechnology, Inc. El anticuerpo anti-β-actina (8H10D10; mouse mAb #3700) fue adquirido en Cell Signaling. El anticuerpo secundario anti-conejo (Goat Anti-Rabbit IgG H&L (HRP) ab6721) fue obtenido de Abcam. La detección se realizó por quimioluminiscencia por métodos estándares. Para el análisis de los resultados se utilizó el programa ImageJ.
Análisis estadístico: Los resultados se expresaron como promedios ± error estándar medio (SEM) utilizando el software GraphPad Prism 6.0©. Los análisis se realizaron mediante test de t de Student para datos no pareados y el test no paramétrico Mann-Whitney considerando significativo un valor de p<0,05.
Resultados
Parámetros generales. La DAG aumentó significativamente el peso corporal (PC) final de los ratones, como también la glicemia y el HOMA-IR en comparación con el grupo DC (Figura 1). Además, la DAG aumentó el tamaño de los adipocitos (Figura 2A y 2B), observándose también un aumento de la relación tejido adiposo/PC x 100 (Figura 2C). Junto con esto, se observó un aumento significativo (p<0,05) de los triacilglicéridos plasmáticos (DC= 69 ± 2,5 mg/dL; DAG= 147 ± 10 mg/dl; datos no mostrados).
Expresión de los receptores ErbBs en distintos tipos de músculos de ratones obesos y normopesos, mediante qPCR
Los niveles de mRNA de ErbB2 y ErbB3 disminuyeron significativamente en el músculo F de ratones alimentados con DAG comparado con el grupo DC. No se observaron diferencias significativas en los músculos S y G (Figura 3A y 3B).
Además, no se observaron diferencias significativas en los niveles del mRNA de ErbB4 en ninguno de los tres músculos estudiados (Figura 3C).
Niveles de expresión proteicos de los receptores ErbBs en distintos tipos de músculos de ratones obesos y normopesos, mediante Western blot
Se observó un aumento significativo en los niveles proteicos de ErbB3 en el músculo G, al comparar el grupo DAG con DC. En tanto, no se observaron diferencias estadísticamente significativas en los músculos S y F (Figura 4).
Además, al analizar los niveles proteicos de ErbB2, los resultados fueron similares a lo obtenido con ErbB3 (datos nos mostrados).
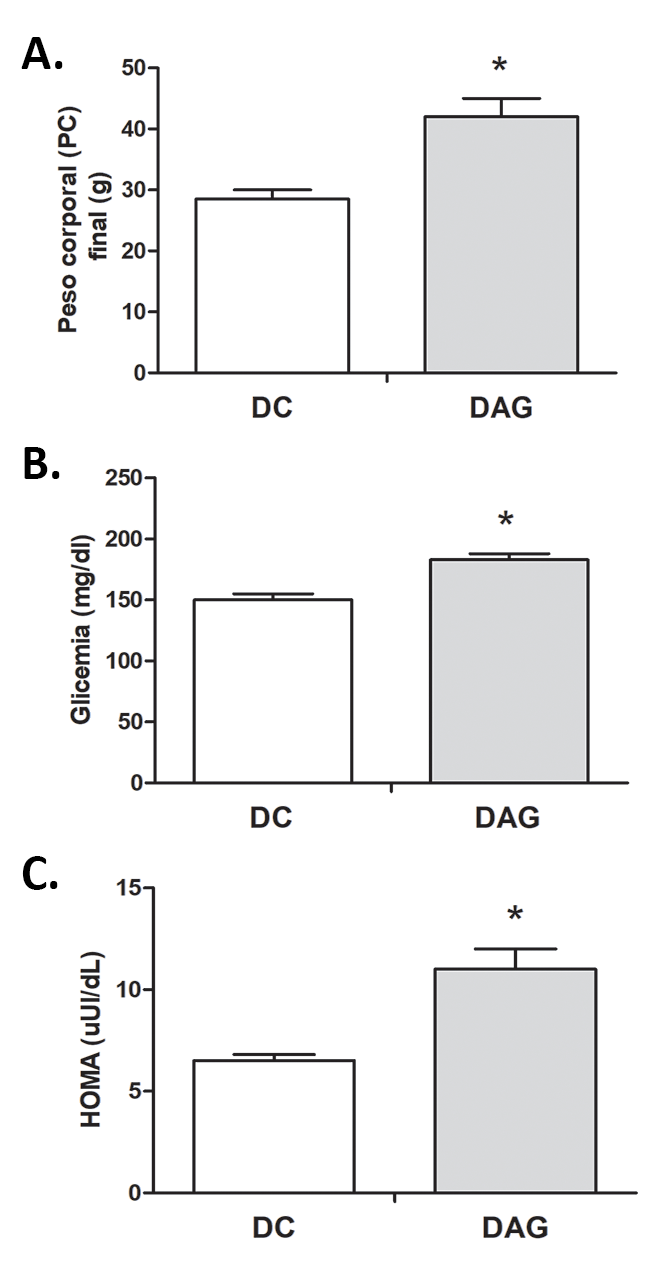
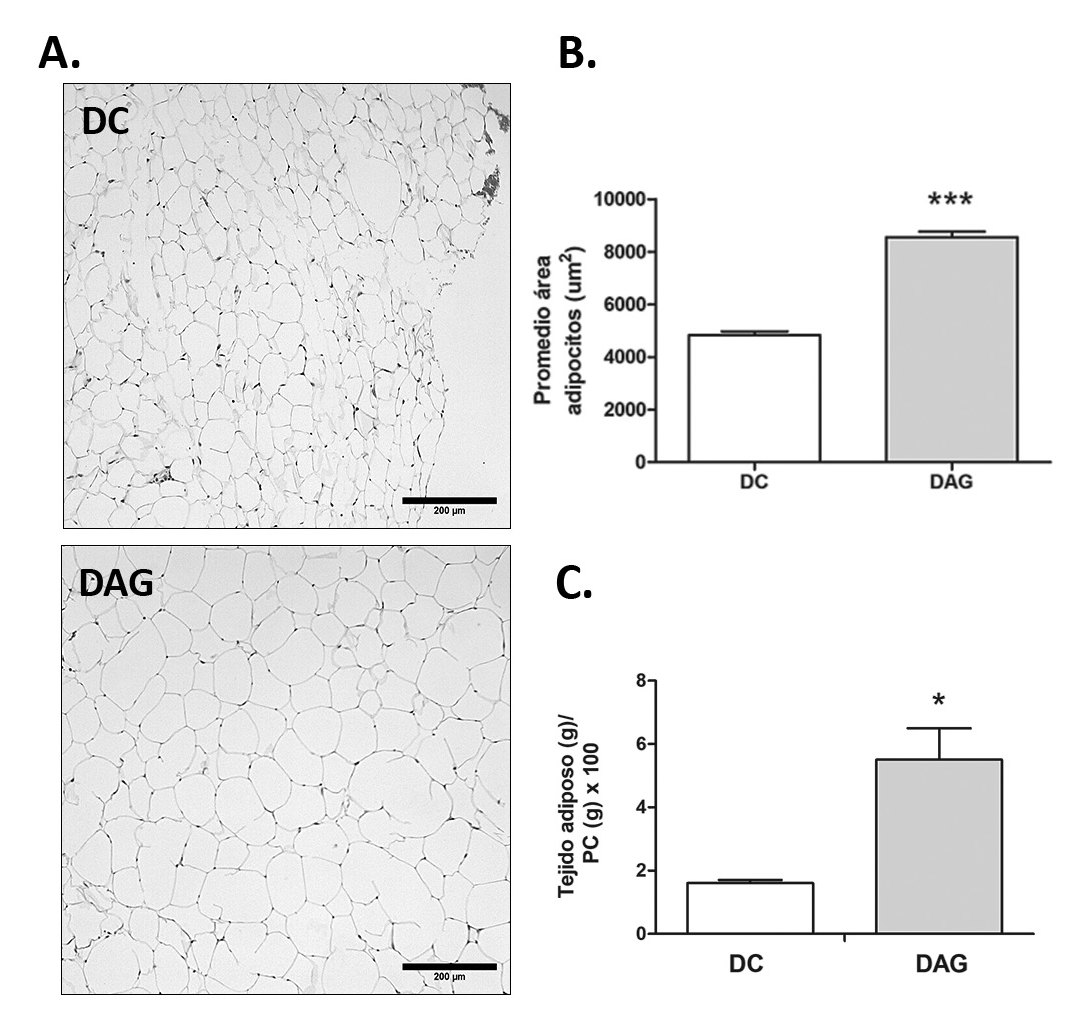
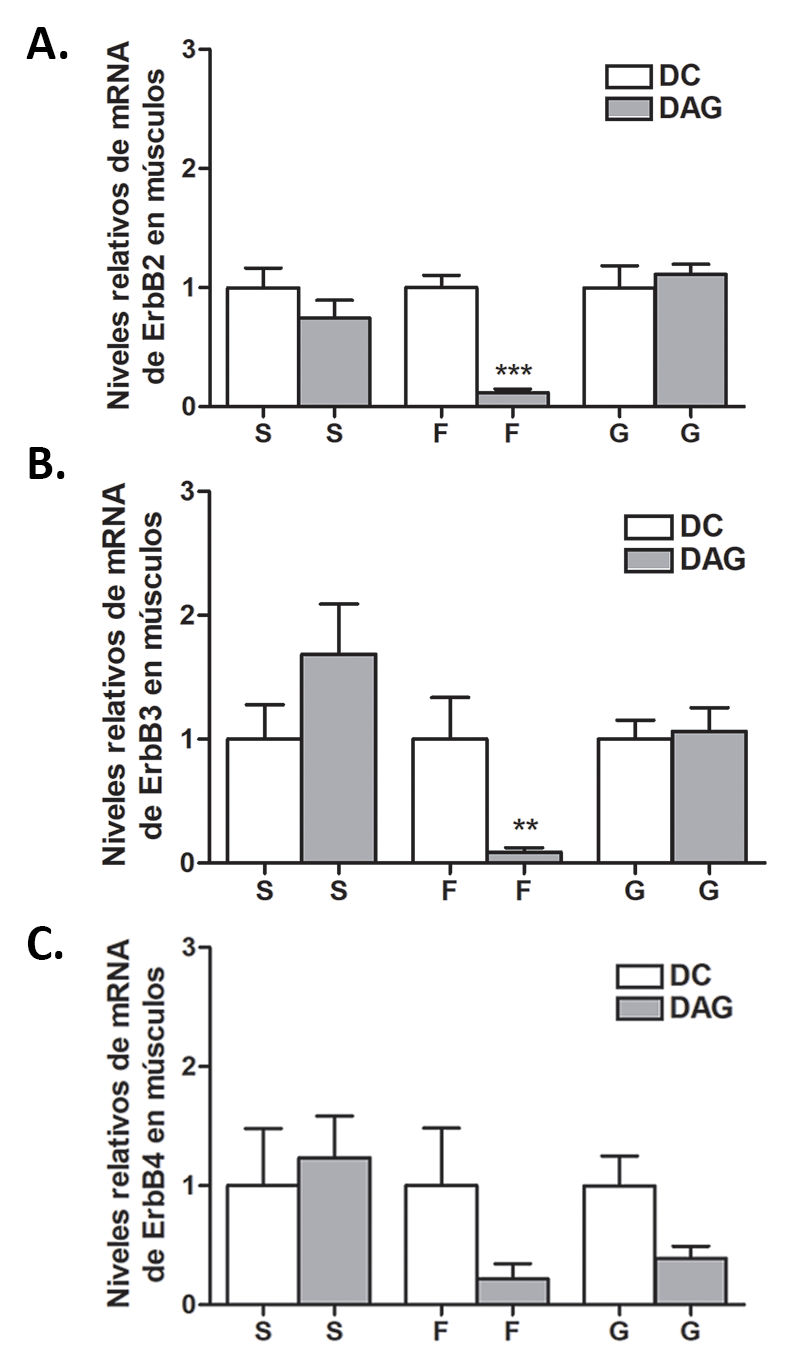 Figura 3: Niveles relativos de mRNA para los receptores ErbBs en
diferentes músculos de ratones alimentados con DC y DAG. (A) ErbB2,
(B) ErbB3, (C) ErbB4. Los resultados se presentan como el promedio ±
SEM (n=7-9/grupo). La normalización fue realizada respecto a los niveles
de mRNA de GAPDH. t de Student para datos no apareados. (***)
p<0,0001, (**) p<0,001.
Figura 3: Niveles relativos de mRNA para los receptores ErbBs en
diferentes músculos de ratones alimentados con DC y DAG. (A) ErbB2,
(B) ErbB3, (C) ErbB4. Los resultados se presentan como el promedio ±
SEM (n=7-9/grupo). La normalización fue realizada respecto a los niveles
de mRNA de GAPDH. t de Student para datos no apareados. (***)
p<0,0001, (**) p<0,001.
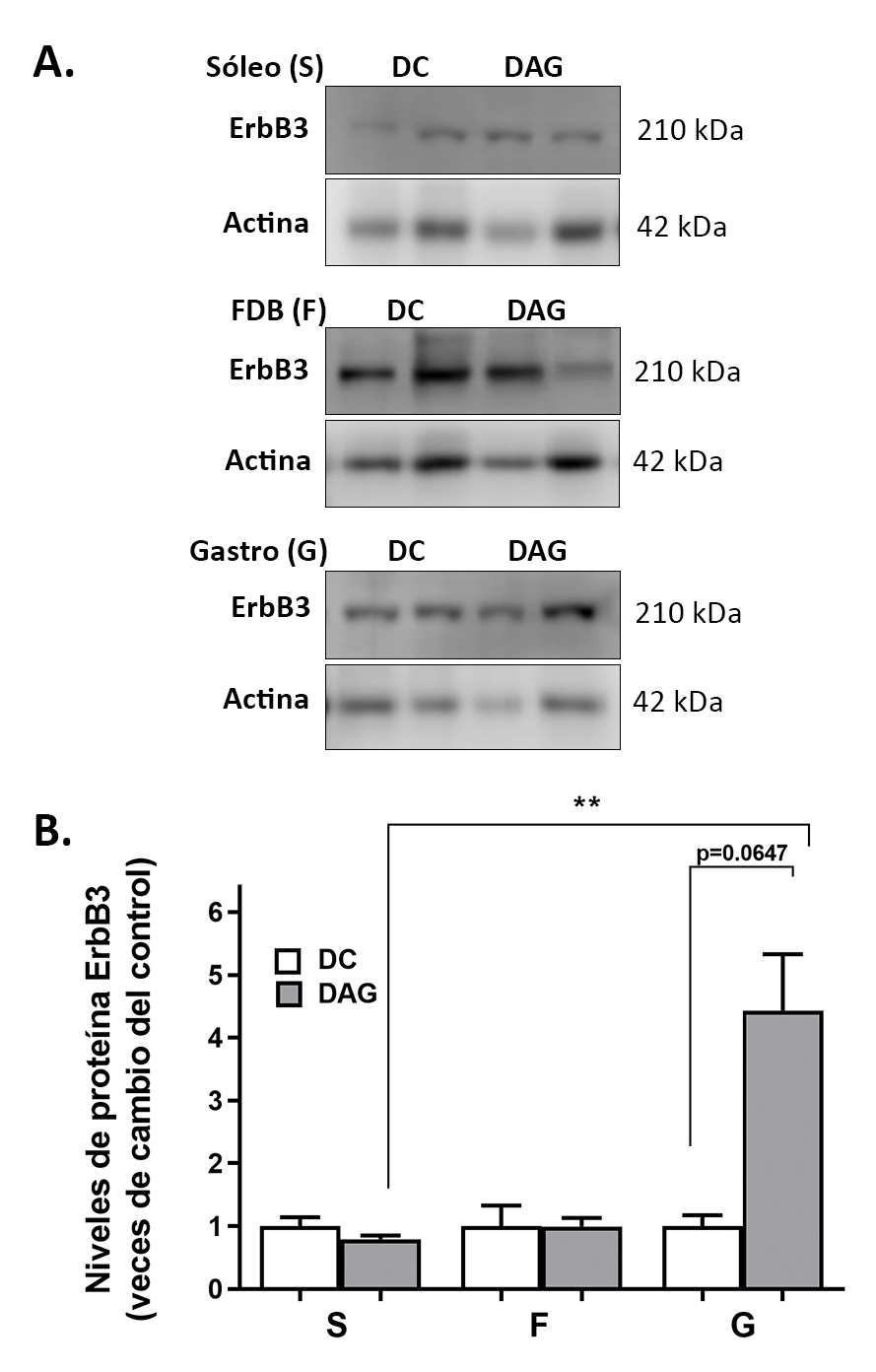 Figura 3: Niveles proteicos relativos de los receptores ErbBs en diferentes
músculos de ratones alimentados con DC y DAG. (A) ErbB2, (B) ErbB3,
(C) ErbB4. Se cargaron 40 μg de proteínas totales por carril en un gel de
poliacrilamida al 8%. La normalización fue realizada respecto a los niveles
proteicos de β-actina. Los resultados se presentan como el promedio ±
SEM (n=5/grupo). Test no paramétrico Mann-Whitney. (**) p<0,001.
Figura 3: Niveles proteicos relativos de los receptores ErbBs en diferentes
músculos de ratones alimentados con DC y DAG. (A) ErbB2, (B) ErbB3,
(C) ErbB4. Se cargaron 40 μg de proteínas totales por carril en un gel de
poliacrilamida al 8%. La normalización fue realizada respecto a los niveles
proteicos de β-actina. Los resultados se presentan como el promedio ±
SEM (n=5/grupo). Test no paramétrico Mann-Whitney. (**) p<0,001.
Discusión
Los receptores ErbBs pertenecen a la familia de receptores con actividad TK, los cuales han sido relacionados en múltiples aspectos del desarrollo del músculo esquelético y de la regulación de su metabolismo energético6. A pesar de las relevantes funciones descritas, aún se desconoce las isoformas de los receptores ErbBs que se expresan en los distintos tipos de músculo en condiciones fisiológicas y de obesidad.
El objetivo de este estudio fue evaluar la expresión de los receptores ErbBs (ErbB2, ErbB3 y ErbB4) en un músculo lento y músculos rápidos de ratones obesos y normopesos. Para ello, ratones C57BL/6 fueron alimentados con DC o DAG durante 12 semanas y se analizaron los músculos sóleo (S), flexor digital de los dedos (F) y gastrocnemio (G).
Con respecto a los parámetros generales, nuestros resultados muestran un aumento significativo en el peso corporal final, la glicemia y el HOMA-IR en el grupo DAG comparado con el grupo DC (Figura 1). Además, observamos un aumento en el área de los adipocitos del tejido adiposo visceral de los ratones alimentados con DAG (Figura 2), resultados que son coherentes con estudios previos13,14, indicando que nuestros animales presentan obesidad y RI, alteraciones metabólicas que afectan el tejido muscular.
Al comparar la expresión génica de los receptores ErbBs en los distintos tipos de músculos (S, F y G) en el grupo DAG vs DC, observamos una disminución significativa en los niveles de mRNA de ErbB2 y ErbB3 sólo en el músculo F (Figura 3). Sin embargo, al analizar los niveles proteicos de ErbB3, no se observaron diferencias estadísticamente significativas en el músculo F ni tampoco en el músculo S, pero si se observó un aumento significativo en el músculo G (Figura 4). Estos resultados sugieren que una DAG estimula la expresión proteica del receptor ErbB3 sólo en el músculo G. Este mismo efecto se observó para ErbB2 (datos no mostrados).
Considerando que la unidad funcional del músculo es la fibra muscular y que existen distintos tipos de fibras musculares que varían de acuerdo a sus propiedades mecánicas, bioquímicas y metabólicas, en ratones de la cepa C57BL/6J se ha descrito que en el músculo S hay un predominio de fibras tipo I y IIA, mientras que el músculo F hay un predominio de fibras tipo IIA. En tanto, el músculo G posee predominantemente fibras tipo IIB15.
Las fibras tipo I son fibras de contracción lenta, presentan alta resistencia a la fatiga, poseen alta capacidad oxidativa y son ricas en mitocondrias. Las fibras tipo II son de contracción rápida debido a su alta intensidad y velocidad durante la contracción, por ello es que se fatigan rápidamente. Además, las fibras tipo II poseen una subclasificación en fibras IIA, IIX y IIB. Las fibras IIA poseen características oxidativas, mientras que las IIB un predominio del metabolismo glucolítico para sus funciones16. De esta manera, el músculo S ha sido clasificado como un músculo lento oxidativo. En tanto, el músculo F ha sido clasificado como un músculo rápido oxidativo y el músculo G como rápido glicolítico15. Junto con esto, se ha descrito que la sensibilidad a la insulina y la captación de glucosa es diferente en los distintos fenotipos de músculo17. Por lo tanto, estas diferencias funcionales podrían explicar los resultados obtenidos.
Nuestros resultados sugieren que una DAG aumenta la expresión de los ErbBs en un músculo glicolítico (rápido: G), pero no altera su expresión en los músculos oxidativos (lento: S, ni rápido: F) en un modelo murino. Estudios previos han relacionado la vía de NRG/receptores ErbBs con el metabolismo de la glucosa en el músculo. De hecho, NRG cumple una función análoga a la insulina, ya que ambos participan en la translocación de los transportadores GLUT4 a la membrana plasmática en el músculo6, por lo que potenciar la expresión y/o activación de los receptores ErbBs sería beneficioso en obesidad.
Por otra parte, se ha descrito que el contenido lipídico varía de acuerdo al tipo de fibra muscular. Por lo general, las fibras lentas del tipo oxidativas contienen mayores niveles lipídicos que las fibras de contracción rápida tipo II, y a su vez, las fibras rápidas oxidativas (IIA) poseen mayores niveles que las rápidas glicolíticas (IIB)18.
El músculo esquelético es un órgano que posee una gran capacidad de flexibilidad metabólica, cambiando predominantemente la oxidación de lípidos durante las condiciones de ayuno (acompañada de altas tasas de absorción de ácidos grasos), a una mayor captación, oxidación y almacenamiento de glucosa en condiciones estimuladas con insulina. Sin embargo, en condiciones de obesidad, donde se observa una RI periférica, se manifiesta una mayor oxidación de los lípidos durante las condiciones estimuladas con insulina, lo que da cuenta de la pérdida de la flexibilidad metabólica que posee un músculo esquelético no sano18.
Junto con esto, se ha descrito que los músculos de ratones alimentados con una DAG por 12 semanas cambian su morfología adaptando el tipo de fibra muscular desde fibras IIB (fibras rápidas y glicolíticas; como el caso del músculo G) a fibras IIA (rápidas y oxidativas; como el músculo F)19,20,21, por lo que resulta interesante seguir estudiando la expresión de los receptores ErbBs en este proceso de adaptación en condiciones de obesidad y, por ejemplo, el impacto que tendría el ejercicio.
En resumen, nuestros resultados sugieren que una DAG aumenta la expresión de los ErbBs en un músculo rápido glicolítico de ratones C57BL/6, lo que podría estar asociado con su función y el efecto protector de la vía de NRG/receptores ErbBs en ratones obesos, lo cual permitiría estudiar su implicancia en trastornos metabólicos relacionados con la obesidad.
Referencias
- MINSAL. Encuesta Nacional de Salud 2016-2017. Primeros resultados. Departamento de Epidemiología División de Planificación Sanitaria Subsecretaría de Salud Pública. Santiago. 2017.
- Rochlani Y, Pothineni NV, Kovelamudi S, Mehta JL. Metabolic syndrome: pathophysiology, management, and modulation by natural compounds. Ther Adv Cardiovasc Dis .2017; 11(8): 215-225.
- Wu H, Ballantyne CM. Skeletal muscle inflammation and insulin resistance in obesity. J Clin Invest. 2017; 127(1): 43-54.
- Tzahar E, Waterman H, Chen X, Levkowitz G, Karunagaran D, Lavi S, et al. A hierarchical network of interreceptor interactions determines signal transduction by Neu differentiation factor/neuregulin and epidermal growth factor. Mol Cell Biol. 1996; 16(10): 5276-5287.
- Citri A, Skaria KB, Yarden Y. The deaf and the dumb: the biology of ErbB-2 and ErbB-3. Exp Cell Res. 2003; 284(1): 54-65.
- Gumà A, Martínez-Redondo V, López-Soldado I, Cantó C, Zorzano A. Emerging role of neuregulin as a modulator of muscle metabolism. Am J Physiol Endocrinol Metab. 2010; 298: E742–E750.
- Hellyer NJ, Mantilla CB, Park EW, Zhan WZ, Sieck GC. Neuregulindependent protein synthesis in C2C12 myotubes and rat diaphragm muscle. Am J Physiol Cell Physiol. 2006; 291(5): C1056-C1061.
- Cantó C, Pich S, Paz JC, Sanchez R, Martínez V, Orpinell M, et al. Neuregulins increase mitochondrial oxidative capacity and insulin sensitivity in skeletal muscle cells. Diabetes 2007; 56(9): 2185-2193.
- Hirata M, Sakuma K, Okajima S, Fujiwara H, Inashima S, Yasuhara M, et al. Increased expression of neuregulin-1 in differentiating muscle satellite cells and in motoneurons during muscle regeneration. Acta Neuropathol 2007; 113(4): 451-459.
- Tapia G, Escobedo K, Campos V, Llanos P, Juretić N. High fat dietinduced obesity decreases ErbB receptors expression in liver and adipose tissue in C57BL/6 mice. Rev Chil Nutr 2024; 51(1): 23-31.
- Matthews DR, Hosker JP, Rudenski AS, Naylor BA, Treacher DF, Turner RC. Homeostasis model assessment: insulin resistance and beta-cell function from fasting plasma glucose and insulin concentrations in man. Diabetologia 1985; 28: 412-419
- Pfaffl MW. A new mathematical model for relative quantification in real-time RT-PCR. Nucleic Acids Res 2001; 29: e45
- Tapia G, Silva D, Romero N, Pettinelli P, Dossi CG, de Miguel M, et al. Role of dietary α- and γ-tocopherol from Rosa mosqueta oil in the prevention of alterations induced by high-fat diet in a murine model. Nutrition 2018; 53: 1-8.
- Juretić N, Sepúlveda R, D’Espessailles A, Vera DB, Cadagan C, de Miguel M, et al. Dietary alpha- and gamma-tocopherol (1:5 ratio) supplementation attenuates adipose tissue expansion, hepatic steatosis, and expression of inflammatory markers in a high-fat-dietfed murine model. Nutrition 2021; 85:111139.
- Albers PH, Pedersen AJ, Birk JB, Kristensen DE, Vind BF, Baba O, et al. Human muscle fiber type-specific insulin signaling: impact of obesity and type 2 diabetes. Diabetes 2015; 64(2): 485-497.
- Augusto V, Padovani CR, Eduardo G, Campos R. Skeletal Muscle Fiber Types in C57bl6j Mice. Braz. J Morphol Sci 2004; 21(2): 89- 94.
- Qaisar R, Bhaskaran S, Van Remmen H. Muscle fiber type diversification during exercise and regeneration. Free Radic Biol Med 2016; 98: 56-67.
- Kelley DE, Goodpaster BH. Skeletal Muscle Triglyceride. Diabetes Care 2001; 24(5): 933.
- Shortreed KE, Krause MP, Huang JH, Dhanani D, Moradi J, Ceddia RB, et al. Muscle-Specific Adaptations, Impaired Oxidative Capacity and Maintenance of Contractile Function Characterize Diet-Induced Obese Mouse Skeletal Muscle. Lucia A, editor. PLoS ONE 2009; 4(10): e7293.
- Thomas MM, Trajcevski KE, Coleman SK, Jiang M, Di Michele J, O’Neill HM, et al. Early oxidative shifts in mouse skeletal muscle morphology with high‐fat diet consumption do not lead to functional improvements. Physiol Rep 2014; 2(9): e12149.
- Eshima H, Tamura Y, Kakehi S, Kurebayashi N, Murayama T, Nakamura K, et al. Long-term, but not short-term high-fat diet induces fiber composition changes and impaired contractile force in mouse fasttwitch skeletal muscle. Physiol Rep 2017; 5(7): e13250.