Caracterización metabólica y frecuencia del polimorfismo I/D (rs4646994) del gen ACE1 en adultos con diagnóstico de diabetes de nueva aparición posterior a COVID-19
Lissette Duarte1, Verónica Sambra1, Matías Carrasco-Cabezas4, Ana Claudia Villarroel2,3, Gladys Morales2, Víctor Garrido4, Francisca Salas-Pérez4*
Metabolic characterization and frequency of ACE1 gene I/D (rs4646994) polymorphism in adults diagnosed with new-onset diabetes after COVID-19
- Departamento de Nutrición. Facultad de Medicina Norte. Universidad de Chile. Santiago, Chile.
- Centro Médico Endocrino. Clínica Santa María. Santiago, Chile.
- Hospital Clínico Universidad de Chile. Santiago, Chile.
- Instituto de Ciencias de la Salud, Universidad de O`Higgins. Rancagua, Chile.
*Correspondencia: Francisca Salas / francisca.salas@uoh.cl
Financiamiento: Proyecto SOCHED 2020-03.
Recibido: 16-08-2024.
Aceptado: 04-09-2024.
Resumen: Evidencia reciente ha demostrado que el virus SARS-CoV-2 causante
de la enfermedad COVID-19 puede producir daño directo al páncreas sugiriendo un
posible efecto diabetógeno. El objetivo de este estudio de caso-control fue evaluar
el perfil metabólico y determinar la frecuencia del alelo de riesgo del gen de la enzima
convertidora de angiotensina (ACE1), en adultos con diabetes mellitus (DM)
de nueva aparición post COVID-19. Se reclutaron 41 participantes (16 casos y 25
controles) de ambos sexos. Los casos fueron sujetos con DM de nueva aparición
post COVID-19, de acuerdo con los criterios de la Asociación Americana de Diabetes
(ADA). Los controles fueron sujetos con diagnóstico de COVID-19 pero sin DM.
Se evaluó el estado nutricional, metabólico y la presencia del polimorfismo I/D del
gen ACE1 en muestras de ADN genómico. Se encontró que el perfil metabólico de
ambos grupos es similar, con un incremento significativo en los niveles de glicemia,
hemoglobina glicosilada (Hb1Ac) y calcio sérico. No se encontraron diferencias en
la detección del autoanticuerpo Anti-GAD65 y la frecuencia del polimorfismo I/D del
gen de ACE1 no se encontró asociada a los casos de DM post COVID-19 en esta
población. El estudio encontró que este polimorfismo no está asociado con la diabetes
de nueva aparición post COVID-19, a pesar de las alteraciones metabólicas
significativas observadas en los pacientes.
Palabras clave: Diabetes; COVID-19; ACE1; Glicemia.
Abstract: The SARS-CoV-2 virus causes COVID-19 disease. Evidence suggests
that it can directly harm the pancreas, indicating a potential to cause diabetes. This
study aimed to assess the metabolic profile and determine the frequency of the
risk allele of the angiotensin-converting enzyme (ACE) gene in adults who developed
new-onset diabetes mellitus (DM) after contracting COVID-19, compared to
control subjects. Our study involved forty-one participants, including 16 cases and
25 controls of both sexes. The cases were individuals who developed new-onset
diabetes after COVID-19, as per the American Diabetes Association (ADA) criteria,
while the controls were individuals diagnosed with COVID-19 but without diabetes.
We evaluated the nutritional and metabolic status of the participants, as well as the
ACE1 gene I/D polymorphism in their genomic DNA samples, using a significance
level of p<0.05 for statistical analyses. The metabolic profiles of both groups were
similar, showing a significant increase in glycemia levels, glycosylated hemoglobin
(Hb1Ac), and serum calcium. No differences were found in detecting Anti-GAD65 autoantibodies, and the ACE1 gene I/D polymorphism frequency was not associated
with new-onset diabetes post-COVID-19 in this population. In conclusion, our study
found that the ACE1 gene I/D polymorphism is not associated with new-onset diabetes
post-COVID-19, despite the significant metabolic alterations observed in patients.
Keywords: Diabetes; COVID-19; ACE1; Glycemia.
Introducción
A inicios del año 2020 se identificó una nueva cepa de coronavirus denominada SARS-CoV-2, que da origen a la enfermedad COVID-19, la cual ha resultado en más de 5 millones de casos y más de 62.711 fallecidos en Chile1. La infección por SARS-CoV-2 causa principalmente neumonía, pero también ha sido asociado con síntomas a nivel gastrointestinal, neurológico y cardiovascular2. Si bien, todos los individuos se encuentran en riesgo, el cuadro clínico está determinado por factores como la edad, sexo, comorbilidades y factores genéticos3. El virus SARS-CoV-2 ingresa a las células a través de la enzima convertidora de angiotensina II (ACE2), la cual se expresa en diversos tejidos incluyendo el tejido adiposo y las células beta-pancreáticas4. Por otra parte, la enzima convertidora de angiotensina I (ACE1) y su homólogo (ACE2) son moléculas claves para la regulación del sistema de renina-angiotensina, regulación vascular y del sistema inmune. ACE1 convierte la angiotensina I en angiotensina II, estimulando la vasoconstricción y procesos inflamatorios. Diversos estudios señalan que una menor expresión de ACE2 y un aumento de angiotensina II durante la infección viral, se asocia con la patogénesis y la progresión del COVID-195,4. Esto podría llevar a la falla respiratoria y a una mayor respuesta del sistema inmune6. Diversos estudios han analizado el rol de la inserción/deleción (I/D) de una repetición de una secuencia alu de 287 pares de bases en el gen ACE1, y su relación con las complicaciones causadas por la infección con el virus SARS-CoV-2 como la falla cardiaca, hipertensión, diabetes, falla renal y neumonía7,8. La presencia de este polimorfismo puede dar cuenta de hasta el 47% de las variaciones fenotípicas. Las variaciones alélicas del gen ACE1 se dividen en tres genotipos II, ID y DD, definido por la presencia (inserción: I) o la ausencia (deleción: D) de la secuencia; donde los individuos con el genotipo DD tienen los niveles circulantes de ACE más elevados, lo que a su vez incrementa el riesgo de accidente cerebrovascular y nefropatía diabética9,10. Además, se ha descrito que la elevada frecuencia del genotipo DD en países occidentales ha sido asociada a una mayor mortalidad por COVID-19 en comparación con poblaciones asiáticas11.
En este contexto, se ha documentado una relación bidireccional entre COVID-19 y DM, reportándose el diagnóstico de “DM de nueva aparición” en pacientes con COVID-1912. Esto sugiere un posible efecto diabetogénico secundario a la infección con SARS-CoV-2. Dado que el SARS-CoV-2 ingresa a la célula a través de distintos receptores, siendo ACE2 el más común, es posible hipotetizar que la presencia de variantes genéticas en el gen ACE pudiesen estar involucradas en el desarrollo de DM de nueva aparición. Un mecanismo propuesto señala que la infección podría causar un deterioro agudo en la secreción de insulina o la destrucción de las células beta, lo que, sumado al desarrollo de una tormenta de citoquinas, podría conducir a un rápido deterioro metabólico13. A raíz de estos antecedentes, resulta clave caracterizar y comprender los mecanismos que subyacen el desarrollo de DM de nueva aparición posterior a COVID-19. Por tanto, el objetivo de este estudio fue caracterizar metabólicamente a pacientes con diagnóstico reciente de DM, así como también determinar la presencia del polimorfismo I/D en el gen ACE1 y su posible asociación con las manifestaciones clínicas de la DM.
Materiales y Métodos
Diseño del estudio: Se reclutaron 41 sujetos adultos de los cuales 16 tenían diagnóstico de diabetes post-COVID-19 y 25 sujetos controles, quienes fueron diagnosticados con COVID-19 y sin diagnóstico de diabetes. El reclutamiento se llevó a cabo vía redes sociales para personas que vivían en la Región Metropolitana desde agosto 2021 hasta septiembre 2022. Todos los participantes firmaron un consentimiento informado aprobado por el comité de ética de la Facultad de Medicina de la Universidad de Chile y por el comité de ética de la Clínica Santa María. El diagnóstico de diabetes se realizó según los criterios definidos por la Asociación Americana de Diabetes 2020 (ADA)14. Posterior al reclutamiento, todos los participantes completaron una encuesta de antecedentes médicos y se determinó su estado nutricional utilizando métodos estandarizados15.
Toma de muestras. Las muestras de sangre fueron tomadas en condiciones de ayuno nocturno. Se recolectaron 12 mL de sangre, mediante punción venosa, para la obtención de ADN genómico, plasma y suero, las cuales fueron centrifugadas a 4.000 rpm y almacenadas a -80 ºC. La presencia de hemólisis fue detectada por espectrofotometría a 450 nm.
Determinación del estado metabólico: Se determinó el perfil lipídico, bioquímico, hemoglobina glicosilada (HbA1c) y péptido C, de acuerdo con los procedimientos de rutina del laboratorio clínico.
Análisis serológico: Se cuantificó la presencia de anticuerpos anti-GAD65, mediante inmunoensayo enzimático (ELISA) con el uso del kit comercial Anti-GAD ELISA, (Euroimmun, Germany) de acuerdo con las instrucciones del fabricante.
Extracción de ADN genómico: La determinación del polimorfismo ACE I/D en casos y controles, se realizó a partir de ADN genómico utilizando un kit comercial (E.Z.N.A Blood DNA Mini Kit) y se amplificó el fragmento específico mediante PCR convencional utilizando partidores específicos para detectar el alelo D en el gen ACE1. Secuencias: (Forward: 5′-CTGGAGACCACTCCCATCCTTTCT-3′ y Reverse: 5′-GATGTGGCCATCACATTCGTCAGAT-3′). Posteriormente, los fragmentos amplificados fueron corridos en un gel de agarosa al 2%, como ha sido previamente descrito16.
Análisis estadísticos: La normalidad de los datos se evaluó a través de una prueba de Shapiro-Wilk. Para evaluar la presencia de diferencias significativas se utilizó la prueba t de Student para variables paramétricas y la prueba U de Mann-Whitney para variables no paramétricas. Se consideró un nivel de significancia p<0,05. En relación con los análisis de genotipo, las frecuencias alélicas se determinaron por conteo simple de genes y el equilibrio de Hardy-Weinberg fue a través de la prueba de chi-cuadrado. Las frecuencias alélicas y genotípicas fueron comparadas con la prueba de chi-cuadrado. Además, los genotipos fueron analizados entre grupos a través de los modelos de herencia codominante, dominante y recesivo, de acuerdo con lo reportado previament17.
Resultados
Caracterización antropométrica y clínica de los participantes.
Se incluyeron en este estudio 41 sujetos, de los cuales 16
corresponden a casos y 25 a controles, cuyas características
se describen en la tabla 1. El rango de edad de los casos fue
de 18 a 70 años, mientras que en los controles fue de 20 a 60
años. Al analizar las variables clínicas de los participantes se
observaron diferencias significativas entre casos y controles
para la edad (p= 0,04), glicemia (p= 0,01), calcio (p= 0,01) y
HbA1c (p= 0,001).
Determinación de anticuerpo AntiGAD65 en suero de
participantes del estudio
Al realizar determinación de la presencia de anticuerpo
AntiGAD65 en suero de los participantes se observó que
sólo un sujeto del grupo de casos, presentó este anticuerpo
positivo (Tabla 2). En el grupo de controles no se observó
positividad de este anticuerpo, como era esperable por ser
el grupo sin diagnóstico.
Determinación de la frecuencia del polimorfismo I/D del
gen ACE
Finalmente, se realizó la categorización de los sujetos
estudiados según presencia del genotipo D/D, I/I o I/D del
gen ACE1 y posteriormente se estudió si existían diferencias
en la frecuencia de este polimorfismo entre casos y controles.
Al analizar la presencia de los distintos genotipos se puede
observar que están la población está en equilibrio de Hardy-
Weinberg. Por otra parte, la prueba de Chi-cuadrado no encontró
diferencias en la frecuencia genotípica entre casos y controles
(Tabla 3) y no se encontraron diferencias significativas en los
análisis univariados para distintos parámetros metabólicos. En
la tabla 4 se muestra el análisis para HOMA-IR en los distintos
modelos de herencia.
Tabla 1. Características de los participantes del estudio y parámetros bioquímicos
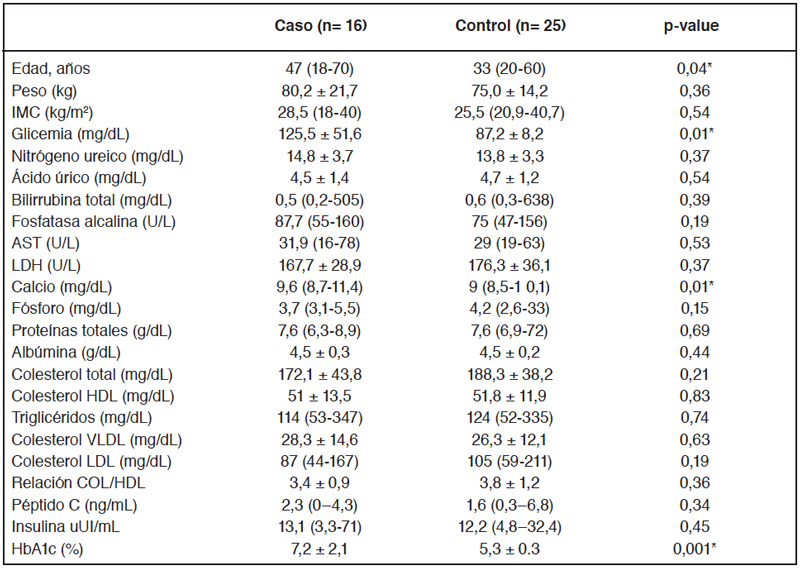
Datos expresados como media ± DS para datos paramétricos y como mediana y rango para datos no paramétricos. IMC: índice de masa corporal; GOT (transaminasa glutámica oxalacética) o AST (aspartato aminotransferasa); LDH: Deshidrogenasa láctica; HDL: colesterol de lipoproteínas de alta densidad; VLDL: colesterol de lipoproteína de muy baja densidad; LDL: colesterol de lipoproteína de baja densidad; HbA1c: Hemoglobina glicosilada.
Tabla 2. Detección de autoanticuerpos en suero.

AntiGAD65: Anticuerpos anti-glutamato- decarboxilasa.
Tabla 3. Genotipos y frecuencias alélicas de las variantes del gen ACE1.
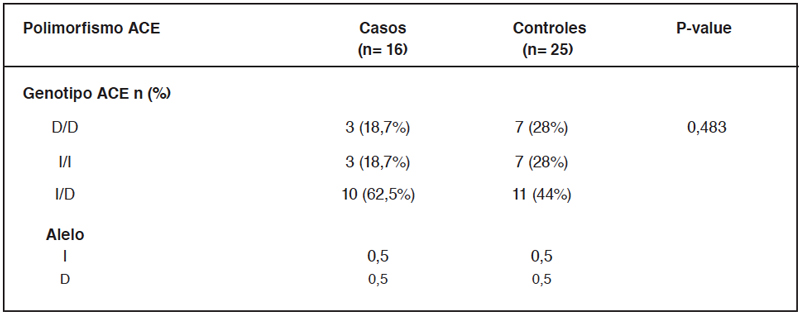
Los datos están presentados como número y porcentaje (n=40). Los valores de P fueron calculados utilizando el test de chicuadrado.
Tabla 4. Análisis univariado según modelos de herencia para HOMA-IR.
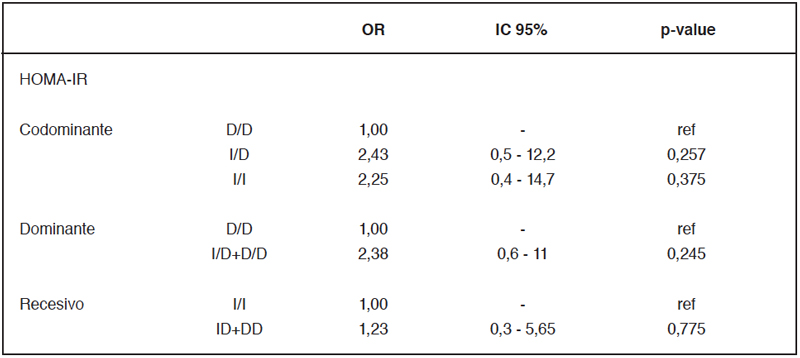
D: deleción; I: inserción. OR: odds ratio; IC: intervalo de confianza.
Discusión
La diabetes de nueva aparición asociada con la infección por COVID-19 (New onset diabetes after COVID19 o NODAC) se caracteriza por un aumento significativo de la glucosa en sangre, lo que puede llevar a la hiperglucemia y, en algunos casos, a la cetoacidosis diabética. Los mecanismos propuestos para esta relación incluyen la inflamación persistente que contribuye a la resistencia a la insulina y el daño directo a las células beta del páncreas por el SARS-CoV-2, lo que afecta la producción de insulina18,19. En este contexto, se ha descrito que la diabetes de nueva aparición asociada con la infección por COVID-19 muestra una alta prevalencia en niños, con un incremento notable en casos de diabetes tipo 1. Un estudio en el Reino Unido reportó un aumento del 80% en nuevos casos de diabetes tipo 1 en niños durante la pandemia, con aproximadamente el 70% presentando cetoacidosis diabética (CAD) y el 52% con CAD severa20, por lo que es necesario realizar un monitoreo cercano y tratamiento oportuno para evitar complicaciones graves en niños infectados por COVID-19.
Dentro de los principales hallazgos de nuestro estudio fue un incremento significativo en los niveles de glicemia y hemoglobina glicosilada, lo cual es concordante con el diagnóstico de diabetes, indicando una mayor alteración en el metabolismo de la glucosa en el grupo de casos en comparación con los controles. Sin embargo, no se encontró diferencias en los niveles de insulina. Esto puede ser explicado dado que los pacientes con diabetes tipo 2 pueden tener niveles de insulina que parecen normales o elevados, pero la incapacidad de normalizar la glucosa en sangre refleja un defecto relativo en la secreción de insulina estimulada por la glucosa21. Por lo tanto, la secreción de insulina es defectuosa en estos pacientes e insuficiente para compensar la resistencia a la insulina. Lo anterior resulta relevante ya que se ha documentado que el virus SARS-CoV-2 puede provocar perturbación del metabolismo de la glucosa a través de un aumento de la resistencia a la insulina22. A pesar de esto, no se observaron diferencias en los niveles de insulina entre los sujetos de control y aquellos con diabetes de nueva aparición. Esto podría deberse a que la mayoría de estos pacientes fueron diagnosticados con diabetes tipo 2, en la que inicialmente los niveles de insulina pueden parecer normales, pero son insuficientes para contrarrestar la resistencia a la insulina y mantener los niveles de glucosa dentro de un rango normal21. Las observaciones de nuestro estudio respaldan la hipótesis de un posible efecto diabetogénico del SARS-CoV-2, sugiriendo que la infección podría causar un deterioro agudo en la secreción de insulina o la destrucción de las células beta, lo cual, junto con una respuesta inflamatoria excesiva, podría llevar a un rápido deterioro metabólico23. Es importante destacar que la toma de muestras se realizó al menos dos meses después del diagnóstico de COVID-19, con el objetivo de descartar el posible efecto hiperglicémico de los glucocorticoides utilizados durante el tratamiento de la infección24. Los glucocorticoides, comúnmente empleados para manejar la inflamación y otras complicaciones del COVID-19, pueden aumentar los niveles de glucosa en sangre, lo que podría sesgar los resultados del estudio. Al esperar este periodo, se buscó asegurar que los valores de glicemia y HbA1c reflejen de manera más precisa el estado metabólico basal de los participantes, sin la influencia transitoria de estos medicamentos. Esto permite una evaluación más precisa de la relación entre la infección por SARS-CoV-2 y la aparición de diabetes de nueva aparición.
Dado que durante la pandemia se planteó la interrogante de si esta patología corresponde a un nuevo tipo de diabetes, determinamos los niveles del autoanticuerpo GAD65 en suero para detectar la presencia de marcadores de autoinmunidad. En nuestro estudio, detectamos sólo un caso positivo para antiGAD65. En este sentido, se han descrito casos con y sin marcadores de autoinmunidad en pacientes con diagnóstico de diabetes de nueva aparición, sugiriendo un posible impacto de la infección viral sobre la autoinmunidad25,26,27.
Por otra parte, el análisis de los resultados del polimorfismo I/D del gen ACE mostró que no existen diferencias en la frecuencia de estos polimorfismos entre los casos y controles en nuestra muestra. Estos hallazgos son consistentes con algunos estudios previos, mientras que otros han sugerido una posible relación entre el alelo D y la severidad de la infección por COVID-1928. Información reciente sobre el polimorfismo I/D del gen ACE1 ha indicado que este podría influir en la expresión de ACE1, el receptor celular que el SARS-CoV-2 utiliza para ingresar a las células. Aunque algunos estudios han encontrado una correlación entre la variante D del polimorfismo y una mayor gravedad del COVID-19, los resultados han sido contradictorios y no concluyentes. La variabilidad en los resultados puede deberse a diferencias en las poblaciones estudiadas, el tamaño de las muestras y otros factores genéticos y ambientales que influyen en la progresión de la enfermedad y la respuesta del huésped29,30. En ese sentido, el tamaño muestral de nuestro estudio es reducido al compararse con otros estudios de polimorfismos, lo que limita las posibles conclusiones obtenidas. Finalmente, el impacto de la vacunación contra COVID-19 en la incidencia de diabetes de nueva aparición es un área que merece mayor investigación. El riesgo de desarrollar diabetes posterior a la infección por COVID-19 es mayor en pacientes no vacunados, mientras que se ha reportado que la población pre-diabética es más propensa a debutar con diabetes tipo 1, siendo evidente luego de la vacunación31,32. La relación entre la vacunación y la aparición de diabetes es compleja y aún no completamente comprendida. Investigaciones iniciales han sugerido que la vacunación podría influir en la respuesta inmunitaria y, por lo tanto, en la incidencia de enfermedades autoinmunes como la diabetes. Sin embargo, los datos actuales son limitados y se necesita más investigación para entender plenamente esta relación y sus posibles implicancias en la salud pública.
Dentro de las principales limitaciones de este estudio corresponde al tamaño de la muestra relativamente pequeño, lo que podría afectar la interpretación de la frecuencia de polimorfismos. Además, durante el período de reclutamiento, los voluntarios no recibieron las mismas dosis o tipo de vacunas, lo que puede aumentar la variabilidad del efecto que puedan tener las vacunas sobre el riesgo de desarrollar diabetes de nueva aparición. Para futuros estudios, sería beneficioso considerar investigaciones longitudinales más amplias y con mayor tamaño muestral para tener mayor poder estadístico y confirmar estos hallazgos, especialmente para evaluar la frecuencia de los polimorfismos en el gen ACE que pueden estar asociados con el riesgo de DM post COVID-19.
Conclusión
En resumen, nuestro estudio evaluó un número pequeño de casos de diabetes de nueva aparición posterior a la infección por COVID-19, donde se identificaron alteraciones metabólicas asociadas al diagnóstico de diabetes, sin la presencia de marcadores de autoinmunidad. Se requieren estudios más extensos para identificar la relación causal entre la infección y el desarrollo de esta patología, sin embargo, se sugiere evaluar el control glicémico posterior a la infección viral, con el objetivo de monitorear el metabolismo de la glucosa en población de riesgo, como aquellos con antecedentes de intolerancia a la glucosa o estados de pre-diabetes.
Referencias
- COVID-19 Cases | WHO COVID-19 Dashboard Available online: https:// data.who.int/dashboards/covid19/cases?m49=152&n=o (accessed on 5 August 2024).
- Huang C, Wang Y, Li X, Ren L, Zhao J, Hu Y, Zhang L, Fan G, Xu J, Gu X, et al. Clinical Features of Patients Infected with 2019 Novel Coronavirus in Wuhan, China. The Lancet. 2020; 395: 497-506. doi:10.1016/S0140- 6736(20)30183-5.
- Kharroubi S.A. Diab-El-Harake M. Sex-Differences in COVID-19 Diagnosis, Risk Factors and Disease Comorbidities: A Large US-Based Cohort Study. Front Public Health. 2022; 10. doi:10.3389/FPUBH.2022.1029190.
- Hamming I, Timens W, Bulthuis M.L.C, Lely A.T, Navis G.J, van Goor H. Tissue Distribution of ACE2 Protein, the Functional Receptor for SARS Coronavirus. A First Step in Understanding SARS Pathogenesis. J Pathol. 2004; 203: 631-637. doi:10.1002/PATH.1570.
- Huang Y, Yang C, Xu X, feng Xu, W, Liu S. wen Structural and Functional Properties of SARS-CoV-2 Spike Protein: Potential Antivirus Drug Development for COVID-19. Acta Pharmacologica Sinica. 2020 41:9 2020, 41, 1141–1149. doi: 10.1038/s41401-020-0485-4.
- Guillon A, Hiemstra P.S, Si-Tahar M. Pulmonary Immune Responses against SARS-CoV-2 Infection: Harmful or Not? Intensive Care Med. 2020; 46: 1897. doi:10.1007/S00134-020-06170-8.
- Raza S.T, Abbas S, Siddiqi Z, Mahdi F. Association between ACE (Rs4646994), FABP2 (Rs1799883), MTHFR (Rs1801133), FTO (Rs9939609) Genes Polymorphism and Type 2 Diabetes with Dyslipidemia. Int J Mol Cell Med. 2017; 6: 121-130. doi: 10.22088/ACADPUB.BUMS.6.2.6.
- Kuba K, Imai Y, Rao S, Gao H, Guo F, Guan B, Huan Y, Yang P, Zhang Y, Deng W, et al. A Crucial Role of Angiotensin Converting Enzyme 2 (ACE2) in SARS Coronavirus–Induced Lung Injury. Nature Medicine. 2005; 11: 8 2005, 11, 875-879. doi:10.1038/nm1267.
- Marshall R.P, Webb S, Bellingan G.J, Montgomery H.E, Chaudhari B, McAnulty, R.J, Humphries S.E, Hill M.R, Laurent G.J. Angiotensin Converting Enzyme Insertion/Deletion Polymorphism Is Associated with Susceptibility and Outcome in Acute Respiratory Distress Syndrome. Am J Respir Crit Care Med. 2002; 166: 646-650. doi:10.1164/RCCM.2108086.
- Villar J, Flores C, Pérez-Méndez L, Maca-Meyer N, Espinosa E, Blanco J, Sangüesa R, Muriel A, Tejera P, Muros M, et al. Angiotensin-Converting Enzyme Insertion/Deletion Polymorphism Is Not Associated with Susceptibility and Outcome in Sepsis and Acute Respiratory Distress Syndrome. Intensive Care Med. 2008; 34: 488-495. doi: 10.1007/S00134- 007-0937-Z.
- Zheng H, Cao J.J. Angiotensin-Converting Enzyme Gene Polymorphism and Severe Lung Injury in Patients with Coronavirus Disease 2019. Am J Pathol. 2020; 190: 2013-2017. doi: 10.1016/J.AJPATH.2020.07.009.
- Lai H, Yang M, Sun M, Pan B, Wang Q, Wang J, Tian J, Ding G, Yang K, Son, X, et al. Risk of Incident Diabetes after COVID-19 Infection: A Systematic Review and Meta-Analysis. Metabolism. 2022; 137. doi: 10.1016/J.METABOL.2022.155330.
- Rayman G, Lumb A, Kennon B, Cottrell C, Nagi D, Page E, Voigt D, Courtney H, Atkins H, Platts J, et al. Guidance on the Management of Diabetic Ketoacidosis in the Exceptional Circumstances of the COVID-19 Pandemic. Diabet Med. 2020; 37: 1214-1216. doi:10.1111/DME.14328.
- Association, A.D. 2. Classification and Diagnosis of Diabetes: Standards of Medical Care in Diabetes-2020. Diabetes Care. 2020; 43. S14-S31. doi:10.2337/DC20-S002.
- NHLBI Obesity Education Initiative Expert Panel on the Identification, E. and T. of O. in A. (US) Clinical Guidelines on the Identification, Evaluation, and Treatment of Overweight and Obesity in Adults. 1998.
- Verma S, Abbas M, Verma S, Khan F.H, Raza S.T, Siddiqi Z, Ahmad I, Mahdi F. Impact of I/D Polymorphism of Angiotensin-Converting Enzyme 1 (ACE1) Gene on the Severity of COVID-19 Patients. Infect Genet Evol. 2021; 91. doi: 10.1016/J.MEEGID.2021.104801.
- Zintzaras E, Lau J. Synthesis of Genetic Association Studies for Pertinent Gene-Disease Associations Requires Appropriate Methodological and Statistical Approaches. J Clin Epidemiol. 2008; 61: 634-645. doi: 10.1016/J. JCLINEPI.2007.12.011.
- Pantea Stoian A, Bica I.C, Salmen T, Al Mahmeed W, Al-Rasadi K, Al- Alawi K, Banach M, Banerjee Y, Ceriello A, Cesur M, et al. New-Onset Diabetes Mellitus in COVID-19: A Scoping Review. Diabetes Therapy. 2024; 15: 33-60. doi: 10.1007/S13300-023-01465-7/FIGURES/2.
- Khunti K, Prato S. Del, Mathieu C, Kahn S.E, Gabbay R.A, Buse J.B. COVID-19, Hyperglycemia, and New-Onset Diabetes. Diabetes Care. 2021; 44: 2645-2655. doi:10.2337/DC21-1318.
- Unsworth R, Wallace S, Oliver N.S, Yeung S, Kshirsagar A, Naidu H, Kwong R.M.W, Kumar P, Logan K.M. New-Onset Type 1 Diabetes in Children During COVID-19: Multicenter Regional Findings in the U.K. Diabetes Care. 2020; 43: e170-e171. doi:10.2337/DC20-1551.
- Committee, A.D.A.P.P. 2. Classification and Diagnosis of Diabetes: Standards of Medical Care in Diabetes-2022. Diabetes Care. 2022; 45: S17-S38. doi:10.2337/DC22-S002.
- He X, Liu C, Peng J, Li Z, Li F, Wang J, Hu A, Peng M, Huang K, Fan D, et al. COVID-19 Induces New-Onset Insulin Resistance and Lipid Metabolic Dysregulation via Regulation of Secreted Metabolic Factors. Signal Transduction and Targeted Therapy. 2021 6:1 2021, 6, 1-12. doi:10.1038/ s41392-021-00822-x.
- Santos A, Magro D.O, Evangelista-Poderoso R, Saad M.J.A. Diabetes, Obesity, and Insulin Resistance in COVID-19: Molecular Interrelationship and Therapeutic Implications. Diabetol Metab Syndr. 2021; 13: 1-14. doi:10.1186/S13098-021-00639-2/FIGURES/5.
- Cho J.H, Suh S. Glucocorticoid-Induced Hyperglycemia: A Neglected Problem. Endocrinol Metab (Seoul). 2024; 39: 222-238. doi:10.3803/ ENM.2024.1951.
- Chandrashekhar Joshi S, Pozzilli P. COVID-19 Induced Diabetes: A Novel Presentation. Diabetes Res Clin Pract. 2022; 191: 110034, doi: 10.1016/J. DIABRES.2022.110034.
- Batista-Roche J.L, Mirabent-Casals M, Manzanares D, Lund G, García- Gasca A. New-Onset Diabetes Mellitus after COVID-19: Combined Effects of SARS-CoV-2 Variants, Molecular Mimicry, and M6A RNA Methylation. COVID. 2024; 4: 481-494. doi:10.3390/COVID4040032/S1.
- Boboc A.A, Novac C.N, Marin A.G, Ieșanu M.I, Plătică C Buzescu, T, Coșoreanu M.T, Galoș F. SARS-CoV-2 Positive Serology and Islet Autoantibodies in Newly Diagnosed Pediatric Cases of Type 1 Diabetes Mellitus: A Single-Center Cohort Study. Int J Mol Sci. 2023; 24. doi: 10.3390/IJMS24108885.
- Delanghe J.R, Speeckaert M.M, De Buyzere M.L. ACE Polymorphism Is a Determinant for COVID-19 Mortality in the Post-Vaccination Era. Clin Chem Lab Med. 2022; 60: E32-E33. doi:10.1515/CCLM-2021-1001/ MACHINEREADABLECITATION/RIS.
- Molina S, Rocamora N, Bendicho A.I, Vázquez E.G, Zorio E, Rodriguez F.D, Ortuño G Rodríguez, A.I, Sánchez-López A.J, Jara Rubio R, et al. Polymorphisms in ACE, ACE2, AGTR1 Genes and Severity of COVID-19 Disease. PLoS One. 2022; 17: e0263140. doi: 10.1371/JOURNAL. PONE.0263140.
- Sheikhian F, Sadeghi Mofrad S, Tarashi S Ghazanfari Jajin M, Sakhaee F, Ahmadi I, Anvari E, Sheikhpour M, Fateh A. The Impact of ACE2 Polymorphisms (Rs1978124, Rs2285666, and Rs2074192) and ACE1 Rs1799752 in the Mortality Rate of COVID-19 in Different SARS-CoV-2 Variants. Hum Genomics. 2023; 17. doi: 10.1186/S40246-023-00501-8.
- Kwan A.C, Ebinger J.E, Botting P, Navarrette J, Claggett B, Cheng S. Association of COVID-19 Vaccination with Risk for Incident Diabetes After COVID-19 Infection. JAMA Netw Open. 2023; 6: e2255965–e2255965. doi:10.1001/JAMANETWORKOPEN.2022.55965.
- Sivaprakasam D.R, Ohiri H.O, Asif M.S, Jahangir M.S, Khan M.K.G, Nabeel M.A, Abdullah R.M. COVID-19 Vaccination and Its Relation to New-Onset Diabetes: A Narrative Review. Cureus. 2023; 15. doi:10.7759/ CUREUS.47056.